I.按要求完成下列题目:
(1)下列反应中,属于吸热反应的是________ (填字母)。
(2)已知氢气的燃烧热为285.8kJ/mol,写出表示氢气燃烧热的热化学方程式:________ 。
(3)利用中和热实验装置测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol•L-1的盐酸,则还需加入________ (填序号)。
A.1.0gNaOH固体
B.50mL0.50mol•L-1NaOH溶液
C.50mL0.55mol•L-1NaOH溶液
II.回答下列问题:
(4)在体积为1L密闭容器中充入3molCO2(g)和9molH2(g),发生反应2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。
CH3OCH3(g)+3H2O(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。

①反应到达3min时,v正________ v逆(填“>”“<”或“=”)。
②0~5min内,v(CO2)=________ mol•L-1•min-1。
③反应达到平衡状态时,CH3OCH3(g)的体积分数为________ %(保留1位小数)。
④a、b、c三点中代表达到平衡的是________ 。
(1)下列反应中,属于吸热反应的是
| A.碳与水蒸气反应 | B.氧化钙和水反应 |
| C.CaCO3受热分解 | D.锌与盐酸反应 |
(2)已知氢气的燃烧热为285.8kJ/mol,写出表示氢气燃烧热的热化学方程式:
(3)利用中和热实验装置测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol•L-1的盐酸,则还需加入
A.1.0gNaOH固体
B.50mL0.50mol•L-1NaOH溶液
C.50mL0.55mol•L-1NaOH溶液
II.回答下列问题:
(4)在体积为1L密闭容器中充入3molCO2(g)和9molH2(g),发生反应2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。
CH3OCH3(g)+3H2O(g),测得CO2(g)、CH3OCH3(g)的物质的量随时间变化如图所示。
①反应到达3min时,v正
②0~5min内,v(CO2)=
③反应达到平衡状态时,CH3OCH3(g)的体积分数为
④a、b、c三点中代表达到平衡的是
更新时间:2023-11-09 15:26:16
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】已知下列热化学方程式:
①2H2(g) +O2(g) = 2H2O(l) △H = -571.6 kJ/mol
②C(s) + O2(g) = CO2(g) △H = -393.5 kJ/mol
③C(s) + H2O(g) = CO(g) + H2(g) △H = +131.5 kJ/mol
请回答:
(1)上述反应中属于放热反应的是_______ (填序号),固体碳的燃烧热为_______ 。
(2)1molH2完全燃烧生成液态水,放出的热量为_______ 。
(3)依据事实,写出下列反应的热化学方程式。
①1molN2(g)与适量O2(g)反应生成NO(g),需吸收68 kJ的热量,该反应的热化学方程式为_______ 。
②已知HCl稀溶液与NaOH稀溶液反应生成1mol H2O时,放出57.3kJ热量,用离子方程式表示该反应的热化学方程为_______ 。
①2H2(g) +O2(g) = 2H2O(l) △H = -571.6 kJ/mol
②C(s) + O2(g) = CO2(g) △H = -393.5 kJ/mol
③C(s) + H2O(g) = CO(g) + H2(g) △H = +131.5 kJ/mol
请回答:
(1)上述反应中属于放热反应的是
(2)1molH2完全燃烧生成液态水,放出的热量为
(3)依据事实,写出下列反应的热化学方程式。
①1molN2(g)与适量O2(g)反应生成NO(g),需吸收68 kJ的热量,该反应的热化学方程式为
②已知HCl稀溶液与NaOH稀溶液反应生成1mol H2O时,放出57.3kJ热量,用离子方程式表示该反应的热化学方程为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】尿素(H2NCONH2)是一种非常重要的高氮化肥,氨基甲酸铵(NH2COONH4)是尿素合成过程的中间体,某研究小组在实验室进行氨基甲酸铵分解反应平衡常数和分解反应速率的测定。
(1)工业上合成尿素的反应:2NH3(g)+CO2(g) H2O(1)+H2NCONH4(1) ΔH=-103.7kJ·mol-1
H2O(1)+H2NCONH4(1) ΔH=-103.7kJ·mol-1
①上述可逆反应的逆反应为_______ (填“放热”或“吸热”)反应
②下列措施中有利于提高尿素产率的是_______ (填字母)。
A.采用高压 B.采用高温 C.寻找更高效的催化剂
(2)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g) ΔH。
2NH3(g)+CO2(g) ΔH。
实验测得不同温度下的平衡数据列于下表:
①ΔH_______ (填“>”或“<”)
②根据表中数据,计算25.0℃时氨基甲酸铵分解反应的平衡常数K=_______ (mol·L-1)3。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下分解应达到平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量_______ (填“增加“减少”或“不变”)。
(1)工业上合成尿素的反应:2NH3(g)+CO2(g)
 H2O(1)+H2NCONH4(1) ΔH=-103.7kJ·mol-1
H2O(1)+H2NCONH4(1) ΔH=-103.7kJ·mol-1①上述可逆反应的逆反应为
②下列措施中有利于提高尿素产率的是
A.采用高压 B.采用高温 C.寻找更高效的催化剂
(2)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)
 2NH3(g)+CO2(g) ΔH。
2NH3(g)+CO2(g) ΔH。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/(mol/L) | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
②根据表中数据,计算25.0℃时氨基甲酸铵分解反应的平衡常数K=
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下分解应达到平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】现有反应:
A.2H2O2 H2O+O2↑
H2O+O2↑
B.Fe+H2SO4=FeSO4+H2↑
C.Na2CO3·10H2O与NH4NO3反应制作冷敷袋
D.2KOH+H2SO4=K2SO4+2H2O
(1)上述四个反应过程中能量变化符合如图甲的是_______ (填序号)。
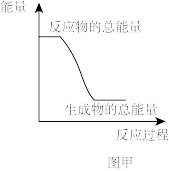
(2)上述四个反应中可用于设计成如图乙的原电池的反应是_______ (填反应序号)。根据该原电池回答下列问题:
①负极反应式为_______ ;正极发生_______ (填“氧化”或“还原”)反应。
②当导线中有2mol电子通过时,理论上发生的变化是_______ (填序号)。
a.溶液增重56g b.溶液增重54g c.析出1g H2 d.析出11.2L H2(标准状况)

(3)FeCl3常用于腐蚀印刷电路铜板(2FeCl3+Cu=2FeCl2+CuCl2),请将此反应设计成原电池,请根据图乙画出该原电池的装置图,注明电极材料,电解质溶液,电子流向。_______
A.2H2O2
 H2O+O2↑
H2O+O2↑ B.Fe+H2SO4=FeSO4+H2↑
C.Na2CO3·10H2O与NH4NO3反应制作冷敷袋
D.2KOH+H2SO4=K2SO4+2H2O
(1)上述四个反应过程中能量变化符合如图甲的是

(2)上述四个反应中可用于设计成如图乙的原电池的反应是
①负极反应式为
②当导线中有2mol电子通过时,理论上发生的变化是
a.溶液增重56g b.溶液增重54g c.析出1g H2 d.析出11.2L H2(标准状况)

(3)FeCl3常用于腐蚀印刷电路铜板(2FeCl3+Cu=2FeCl2+CuCl2),请将此反应设计成原电池,请根据图乙画出该原电池的装置图,注明电极材料,电解质溶液,电子流向。
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】化学是一门以实验为基础的自然科学,根据已有实验知识回答下列问题: 盐酸,然后通过注射器注入50mL
盐酸,然后通过注射器注入50mL
 溶液,通过测定反应过程中所放出的热量可计算反应热。回答下列问题:
溶液,通过测定反应过程中所放出的热量可计算反应热。回答下列问题:
(1)塑料瓶外泡沫板的作用是_____________ ,缺少的仪器是___________ 。
(2)假设盐酸和氢氧化钠溶液的密度都是 ,又知中和反应后生成溶液的比热容
,又知中和反应后生成溶液的比热容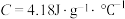 ,为了计算中和热,某学生记录实验数据如下:
,为了计算中和热,某学生记录实验数据如下:
依该学生的实验数据计算,该实验测得的中和热
______ (结果保留一位小数)。
(数据处理时取盐酸和氢氧化钠溶液的平均值记为反应前体系起始温度)
Ⅱ.实验室经常用量气法测量化学反应的速率。___________________ 。
(4)也可以将图1中的注射器改为连通器如图3,为了准确地测量 的体积,在读取反应后甲管中液面的读数时,应注意
的体积,在读取反应后甲管中液面的读数时,应注意__________ (填写序号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管液面不再上升时读数
c.读数时应上、下移动乙管,使甲、乙两管液面相平
d.反应结束立即读数

 盐酸,然后通过注射器注入50mL
盐酸,然后通过注射器注入50mL
 溶液,通过测定反应过程中所放出的热量可计算反应热。回答下列问题:
溶液,通过测定反应过程中所放出的热量可计算反应热。回答下列问题:(1)塑料瓶外泡沫板的作用是
(2)假设盐酸和氢氧化钠溶液的密度都是
 ,又知中和反应后生成溶液的比热容
,又知中和反应后生成溶液的比热容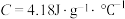 ,为了计算中和热,某学生记录实验数据如下:
,为了计算中和热,某学生记录实验数据如下:依该学生的实验数据计算,该实验测得的中和热

实验序号 | 起始温度 | 终止温度 | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.4 |
2 | 20.2 | 20.4 | 23.8 |
3 | 20.3 | 20.5 | 25.6 |
Ⅱ.实验室经常用量气法测量化学反应的速率。

(4)也可以将图1中的注射器改为连通器如图3,为了准确地测量
 的体积,在读取反应后甲管中液面的读数时,应注意
的体积,在读取反应后甲管中液面的读数时,应注意a.视线与凹液面最低处相平
b.等待片刻,待乙管液面不再上升时读数
c.读数时应上、下移动乙管,使甲、乙两管液面相平
d.反应结束立即读数
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】回答下列问题:
(1)①中和反应反应热的测定实验中,需用到如图所示的仪器,其名称是_____ ,除此外还需要的仪器是_______ 。

②由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和反应反应热的实验,实验试剂及其用量如下表。
注:表中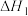 和
和 表示生成1 mol水的反应热
表示生成1 mol水的反应热
甲在实验之前预计 ,他的根据是
,他的根据是_____ ;
乙在实验之前预计 ,他的根据是
,他的根据是____ 。
实验测得两组实验的终了温度不同,A组的终了温度为31.9℃。设充分反应后溶液的比热容 ,溶液密度均为1g·cm-3,忽略实验仪器的比热容及溶液体积的变化,则
,溶液密度均为1g·cm-3,忽略实验仪器的比热容及溶液体积的变化,则
___ 。(只需列表达式)B组的终了温度____ (填“>”、“<”)31.9℃
(2) 溶液中存在以下平衡:
溶液中存在以下平衡:

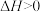 ,在对
,在对 溶液加热时,
溶液加热时,___ (填“能”、“否”)观察到 的黄色,原因是
的黄色,原因是_____ 。稀释 溶液,平衡移动的方向是
溶液,平衡移动的方向是______ (填“不移动”、“向正反应方向”、“向逆反应方向")
(1)①中和反应反应热的测定实验中,需用到如图所示的仪器,其名称是

②由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和反应反应热的实验,实验试剂及其用量如下表。
注:表中
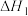 和
和 表示生成1 mol水的反应热
表示生成1 mol水的反应热| 反应物 | 起始温度 | 终了温度 | 反应热 |
A. 溶液50 mL、 溶液50 mL、 溶液50 mL 溶液50 mL | 25.1 | 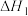 | |
B. 溶液50 mL、 溶液50 mL、 溶液50 mL 溶液50 mL | 25.1 |  |
甲在实验之前预计
 ,他的根据是
,他的根据是乙在实验之前预计
 ,他的根据是
,他的根据是实验测得两组实验的终了温度不同,A组的终了温度为31.9℃。设充分反应后溶液的比热容
 ,溶液密度均为1g·cm-3,忽略实验仪器的比热容及溶液体积的变化,则
,溶液密度均为1g·cm-3,忽略实验仪器的比热容及溶液体积的变化,则
(2)
 溶液中存在以下平衡:
溶液中存在以下平衡:
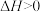 ,在对
,在对 溶液加热时,
溶液加热时, 的黄色,原因是
的黄色,原因是 溶液,平衡移动的方向是
溶液,平衡移动的方向是
您最近一年使用:0次
【推荐3】化学反应伴随能量变化,获取反应能量变化有多种途径。
(1)下列反应中,属于吸热反应的是___________(填字母)。
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
则2H2(g)+O2(g)=2H2O(g)ΔH=___________ kJ·mol-1。
②通过物质所含能量计算。
已知反应A+B=C+D中A、B、C、D所含能量依次可表示为EA、EB、EC、ED,该反应ΔH=___________ 。
③通过盖斯定律计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+ O2(g)=Na2O(s)ΔH=-414kJ·mol-1
O2(g)=Na2O(s)ΔH=-414kJ·mol-1
Ⅱ.2Na(s)+O2(g)=Na2O2(s)ΔH=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:___________ 。
④利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol·L-1盐酸,则还需加入___________ (填字母)。
A.50mL0.50mol·L-1NaOH溶液
B.50mL0.55mol·L-1NaOH溶液
C.1.0gNaOH固体
(1)下列反应中,属于吸热反应的是___________(填字母)。
| A.Na2O与水反应 | B.甲烷的燃烧反应 | C.CaCO3受热分解 | D.锌与盐酸反应 |
①通过化学键的键能计算。已知:
| 化学键 | H—H | O=O | O—H |
| 键能/(kJ·mol-1) | 436 | 498 | 463.4 |
②通过物质所含能量计算。
已知反应A+B=C+D中A、B、C、D所含能量依次可表示为EA、EB、EC、ED,该反应ΔH=
③通过盖斯定律计算。已知在25℃、101kPa时:
Ⅰ.2Na(s)+
 O2(g)=Na2O(s)ΔH=-414kJ·mol-1
O2(g)=Na2O(s)ΔH=-414kJ·mol-1Ⅱ.2Na(s)+O2(g)=Na2O2(s)ΔH=-511kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:
④利用实验装置测量。测量盐酸与NaOH溶液反应的热量变化的过程中,若取50mL0.50mol·L-1盐酸,则还需加入
A.50mL0.50mol·L-1NaOH溶液
B.50mL0.55mol·L-1NaOH溶液
C.1.0gNaOH固体
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】肼(N2H4)是一种良好的火箭推进剂,其与适当的氧化剂(如过氧化氢、氧气等)配合,可组成比冲最高的可贮存液体推进剂。

(1)液态肼和液态过氧化氢混合反应时,即产生大量氮气和水蒸气,并放出大量热。若每生成1molN2,放出642kJ的热量,则该反应的热化学方程式为_______ ,消耗16g液态肼放出的热量为_______ 。
(2)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g)
ΔH=-544kJ·mol-1,键能数据如下表:
则氮氮三键的键能为_______ 。若H2O(l)=H2O(g) ΔH=+44kJ·mol-1,则N2H4(g)的燃烧热为_______ 。
(3)氨基甲酸铵(H2NCOONH4)为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究。
已知:Ⅰ.N2(g)+3H2(g) 2NH3(g) ΔH1=-92.4kJ·mol-1
2NH3(g) ΔH1=-92.4kJ·mol-1
Ⅱ.C(s)+O2(g) CO2(g) ΔH2=-393.8kJ·mol-1
CO2(g) ΔH2=-393.8kJ·mol-1
Ⅲ.N2(g)+3H2(g)+C(s)+O2(g) H2NCOONH4(s) ΔH3=-645.7kJ·mol-1
H2NCOONH4(s) ΔH3=-645.7kJ·mol-1
写出H2NCOONH4分解生成NH3与CO2气体的热化学方程式:_______ 。

(1)液态肼和液态过氧化氢混合反应时,即产生大量氮气和水蒸气,并放出大量热。若每生成1molN2,放出642kJ的热量,则该反应的热化学方程式为
(2)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g)
ΔH=-544kJ·mol-1,键能数据如下表:
| 化学键 | N-N | N-H | O=O | O-H |
| 键能/(kJ·mol-1) | 193 | 391 | 497 | 463 |
(3)氨基甲酸铵(H2NCOONH4)为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究。
已知:Ⅰ.N2(g)+3H2(g)
 2NH3(g) ΔH1=-92.4kJ·mol-1
2NH3(g) ΔH1=-92.4kJ·mol-1Ⅱ.C(s)+O2(g)
 CO2(g) ΔH2=-393.8kJ·mol-1
CO2(g) ΔH2=-393.8kJ·mol-1Ⅲ.N2(g)+3H2(g)+C(s)+O2(g)
 H2NCOONH4(s) ΔH3=-645.7kJ·mol-1
H2NCOONH4(s) ΔH3=-645.7kJ·mol-1写出H2NCOONH4分解生成NH3与CO2气体的热化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】根据已知,回答下列问题。
(1)已知:0.3mol气态高能燃料乙硼烷( )在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量。写出该反应的热化学方程式
)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量。写出该反应的热化学方程式___________ 。
(2)在25℃、101kPa下,1g甲烷燃烧生成 和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为
和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为___________ 。
(3)已知: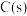 与水蒸气反应制取水煤气(一氧化碳和氢气)时,每转移
与水蒸气反应制取水煤气(一氧化碳和氢气)时,每转移 个电子)吸收65.75kJ的热量。写出该反应的热化学方程式
个电子)吸收65.75kJ的热量。写出该反应的热化学方程式___________ 。
(4)常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能,下表是一些键能数(KJ·mol-1)
根据键能数据计算以下反应的反应热 :
:
 =
=___________ 。
(5)随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、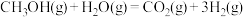
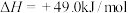
B、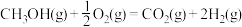
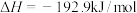
由上述方程式可知,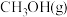 的燃烧热
的燃烧热___________ (填“大于”、“等于”或“小于”)192.9kJ/mol
(6)火箭的常规燃料是液态四氧化二氮和液态肼( ),
), 作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:
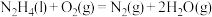
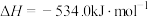
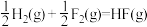
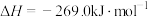
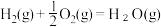
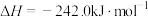
请写出肼和氟气反应的热化学方程式:___________ 。
(1)已知:0.3mol气态高能燃料乙硼烷(
 )在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量。写出该反应的热化学方程式
)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量。写出该反应的热化学方程式(2)在25℃、101kPa下,1g甲烷燃烧生成
 和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为
和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为(3)已知:
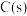 与水蒸气反应制取水煤气(一氧化碳和氢气)时,每转移
与水蒸气反应制取水煤气(一氧化碳和氢气)时,每转移 个电子)吸收65.75kJ的热量。写出该反应的热化学方程式
个电子)吸收65.75kJ的热量。写出该反应的热化学方程式(4)常温常压下,断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能,下表是一些键能数(KJ·mol-1)
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-H | 414 | C-F | 489 |  | 565 |
 | 436 |  | 391 |  | 158 |
 :
:
 =
=(5)随着科学技术的进步,人们研制了多种甲醇质子交换膜燃料电池,以满足不同的需求。有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、
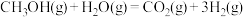
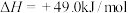
B、
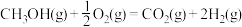
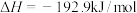
由上述方程式可知,
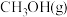 的燃烧热
的燃烧热(6)火箭的常规燃料是液态四氧化二氮和液态肼(
 ),
), 作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
作氧化剂,有人认为若用氟气代替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。已知:
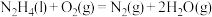
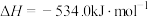
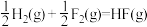
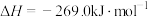
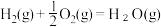
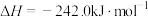
请写出肼和氟气反应的热化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】“氢能”是未来最理想的新能源。
(1)实验测得,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧热的热化学方程式为________ (填选项字母)。
A.2H2(g)+O2(g)=2H2O(l) ΔH=-142.9 kJ·mol-1
B.H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2O+O2=2H2O(l) ΔH=-571.6 kJ·mol-1
D.H2(g)+ O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O CaO+2HBr
CaO+2HBr
②2HBr+Hg HgBr2+H2
HgBr2+H2
③HgBr2+________ ________+________
________+________
④2HgO 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:_____________ ;请根据“绿色化学”的思想评估该方法制H2的主要缺点:___________ 。
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。

请写出化学方程式:
反应①__________________________ 。
反应②__________________________ 。
(1)实验测得,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧热的热化学方程式为
A.2H2(g)+O2(g)=2H2O(l) ΔH=-142.9 kJ·mol-1
B.H2(g)+
 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1C.2H2O+O2=2H2O(l) ΔH=-571.6 kJ·mol-1
D.H2(g)+
 O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-285.8 kJ·mol-1(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O
 CaO+2HBr
CaO+2HBr②2HBr+Hg
 HgBr2+H2
HgBr2+H2③HgBr2+________
 ________+________
________+________④2HgO
 2Hg+O2↑
2Hg+O2↑请你根据“原子经济”的思想完成上述步骤③的化学方程式:
(3)利用核能把水分解制氢气,是目前正在研究的课题。下图是其中的一种流程,其中用了过量的碘。

请写出化学方程式:
反应①
反应②
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】Ⅰ.某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。

(1)该反应的化学方程式是___________ 。
(2)从反应开始到5min时,用Z表示的反应速率为_________ 。
II.800℃、2L密闭容器反应2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的变化如表:
计算并回答下列问题:
(1)反应进行到2s时c(NO)=________ 。
(2)反应达到平衡状态时NO的转化率=_______ 。
III.家用液化气中主要成分之一是丁烷。当1g气态丁烷(C4H10)完全燃烧并生成CO2和液态水时,放出热量50kJ。试写出丁烷燃烧的热化学方程式:___________ .

(1)该反应的化学方程式是
(2)从反应开始到5min时,用Z表示的反应速率为
II.800℃、2L密闭容器反应2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的变化如表:
时间(S) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)反应进行到2s时c(NO)=
(2)反应达到平衡状态时NO的转化率=
III.家用液化气中主要成分之一是丁烷。当1g气态丁烷(C4H10)完全燃烧并生成CO2和液态水时,放出热量50kJ。试写出丁烷燃烧的热化学方程式:
您最近一年使用:0次
【推荐2】研究反应Ⅰ的逆反应对提高尿素产率有重要意义。某研究学习小组把一定量的氨基甲酸铵固体放入容积为2L的密闭容器中,在T℃下分解:NH2COONH4(s) 2NH3(g)+CO2(g),t1时达到化学平衡。c(CO2)随时间t变化曲线如图所示。
2NH3(g)+CO2(g),t1时达到化学平衡。c(CO2)随时间t变化曲线如图所示。

(1)可以判断该分解反应已经达到平衡的是___________。
(2)T 时,该反应的化学平衡常数K的值为
时,该反应的化学平衡常数K的值为___________ 。
(3)在0~t1时间内该化学反应速率v(NH3)=___________ 。
(4)若其他条件不变,t2时将容器体积压缩到1L,t3时达到新的平衡。请在图中画出t2~t4时间内c(CO2)随时间t变化的曲线。___________
 2NH3(g)+CO2(g),t1时达到化学平衡。c(CO2)随时间t变化曲线如图所示。
2NH3(g)+CO2(g),t1时达到化学平衡。c(CO2)随时间t变化曲线如图所示。
(1)可以判断该分解反应已经达到平衡的是___________。
| A.混合气体的平均摩尔质量不变 | B.密闭容器中总压强不变 |
| C.密闭容器中混合气体的密度不变 | D.密闭容器中氨气的体积分数不变 |
 时,该反应的化学平衡常数K的值为
时,该反应的化学平衡常数K的值为(3)在0~t1时间内该化学反应速率v(NH3)=
(4)若其他条件不变,t2时将容器体积压缩到1L,t3时达到新的平衡。请在图中画出t2~t4时间内c(CO2)随时间t变化的曲线。
您最近一年使用:0次

 /℃
/℃ /℃
/℃ ,在2 s末时,测得容器中含有0.4 mol的NH3,求该反应的v(NH3)=
,在2 s末时,测得容器中含有0.4 mol的NH3,求该反应的v(NH3)=

