钛酸钙是最典型的钙钛矿型化合物,该类化合物具有特殊的理化性质。
(1)基态 的核外电子排布式为
的核外电子排布式为_______________ 。
(2)氧原子核外电子有__________ 种空间运动状态。比较离子半径大小
___________ 
(3)关于钛元素下列说法不正确的是________
(4)钛酸钙的阴、阳离子均可被半径相近的其它离子替代,从而衍生出多种钙钛矿型化合物。
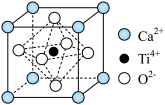
①钛酸钙的晶胞如图所示,1个晶胞中含有 的个数是
的个数是____________
1个 周围等距且最近的
周围等距且最近的 有
有_________ 个。
②已知,钛酸钙晶体的晶胞形状为立方体,其棱长为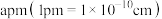 ,则钛酸钙晶体密度
,则钛酸钙晶体密度
__________  (列出计算式)。
(列出计算式)。
(5)通过离子替代可获得具有优异光电性能的有机钙钛矿型化合物 。其中有机阳离子
。其中有机阳离子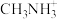 可由甲胺(
可由甲胺(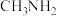 )制得。
)制得。
①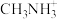 中
中 的杂化方式为
的杂化方式为________________ 。
②请从化学键的角度解释由甲胺形成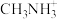 的过程:
的过程:_______________ 。
(1)基态
 的核外电子排布式为
的核外电子排布式为(2)氧原子核外电子有


(3)关于钛元素下列说法不正确的是________
A.钛原子的原子轨道能量: |
| B.在钛的电子云图中,用小黑点表示绕核做高速圆周运动的电子 |
C.钛原子中,电子从 的状态跃迁到 的状态跃迁到 的状态时,将释放能量 的状态时,将释放能量 |
| D.钛在周期表中的位置是第四周期第IB族 |
(4)钛酸钙的阴、阳离子均可被半径相近的其它离子替代,从而衍生出多种钙钛矿型化合物。
①钛酸钙的晶胞如图所示,1个晶胞中含有
 的个数是
的个数是1个
 周围等距且最近的
周围等距且最近的 有
有
②已知,钛酸钙晶体的晶胞形状为立方体,其棱长为
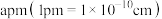 ,则钛酸钙晶体密度
,则钛酸钙晶体密度
 (列出计算式)。
(列出计算式)。(5)通过离子替代可获得具有优异光电性能的有机钙钛矿型化合物
 。其中有机阳离子
。其中有机阳离子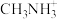 可由甲胺(
可由甲胺(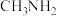 )制得。
)制得。①
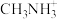 中
中 的杂化方式为
的杂化方式为②请从化学键的角度解释由甲胺形成
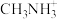 的过程:
的过程:
更新时间:2023-11-01 07:39:09
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
【推荐1】铝及其化合物在日常生活、工业上有广泛的应用。
(1)铝原子核外有_____ 种不同运动状态的电子,有_____ 种能量不同的电子。
(2)氮化铝具有强度高,耐磨,抗腐蚀,熔点可达2200℃。推测氮化铝是______ 晶体,试比较组成该物质的两微粒半径大小____________________ 。
(3)可用铝和氧化钡反应可制备金属钡:2Al+4BaO 3Ba↑+BaO·Al2O3的主要原因是
3Ba↑+BaO·Al2O3的主要原因是 __________ (选填编号)。
(4)氢氧化铝在水中发生酸式电离的电离方程式为:____________________ ,
滴入少量盐酸,上述体系中Al3+浓度_______ (填“增加”、“减少”或“不变”)。
(5)工业上用氢氧化铝、氢氟酸和碳酸钠制取冰晶石(Na3AlF6)。其反应物中有两种元素在周期表中位置相邻,可比较它们金属性或非金属性强弱的是_______ (选填编号)。
a.气态氢化物的稳定性
b.最高价氧化物对应水化物的酸(碱)性
c.单质与氢气反应的难易
d.单质与同浓度酸发生反应的快慢
(6)冰晶石可做电解氧化铝的助熔剂,此反应中若有0.6mol电子转移,则在________ 极可得金属铝的质量为__________ 克。工业上不用电解氯化铝而是用电解氧化铝的方法获得铝单质的原因_____________________ 。
(1)铝原子核外有
(2)氮化铝具有强度高,耐磨,抗腐蚀,熔点可达2200℃。推测氮化铝是
(3)可用铝和氧化钡反应可制备金属钡:2Al+4BaO
 3Ba↑+BaO·Al2O3的主要原因是
3Ba↑+BaO·Al2O3的主要原因是 a.Al活泼性大于Ba | b.Ba沸点比Al的低 | c.BaO·Al2O3比Al2O3稳定 |
滴入少量盐酸,上述体系中Al3+浓度
(5)工业上用氢氧化铝、氢氟酸和碳酸钠制取冰晶石(Na3AlF6)。其反应物中有两种元素在周期表中位置相邻,可比较它们金属性或非金属性强弱的是
a.气态氢化物的稳定性
b.最高价氧化物对应水化物的酸(碱)性
c.单质与氢气反应的难易
d.单质与同浓度酸发生反应的快慢
(6)冰晶石可做电解氧化铝的助熔剂,此反应中若有0.6mol电子转移,则在
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】已知:V、W、R、T四种元素均位于元素周期表前四周期,它们的原子序数逐渐增大。其相关信息如表:
请回答下列问题:
(1)T元素的名称为______ ,在元素周期表中的位置是_____ 。
(2)基态W原子中能量最高的电子所占据能级的电子云在空间有_____ 个方向,原子轨道呈_____ 形。
(3)W的单质易溶于V、W形成的化合物中,其原因是_____ 。
(4)V、W、R三种元素最高价氧化物对应水化物的酸性从强到弱的顺序是______ (用化学式表示),原因是_____ 。
(5)写出W、T元素的单质加热时发生化合的化学方程式:______ 。
| V元素是形成有机物的必备元素 |
| W元素基态原子最外层p轨道电子数是最外层s轨道电子数的2倍,其单质常温下为固体 |
| R元素与W元素位于同一周期并相邻 |
| T元素原子中p轨道电子数与d轨道电子数之比为6:5;其盐溶液通常呈蓝色 |
(1)T元素的名称为
(2)基态W原子中能量最高的电子所占据能级的电子云在空间有
(3)W的单质易溶于V、W形成的化合物中,其原因是
(4)V、W、R三种元素最高价氧化物对应水化物的酸性从强到弱的顺序是
(5)写出W、T元素的单质加热时发生化合的化学方程式:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】据《科学》报道,中国科学家首次实现超导体(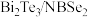 )中分段费米面。回答下列问题:
)中分段费米面。回答下列问题:
(1)Bi与P位于同主族,基态P原子的价层电子排布式为_______ 。基态Se原子核外电子云轮廓图呈哑铃形的能级上共有_______ 个电子
(2)二氯二茂铌的组成为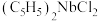 环戊二烯阴离子(
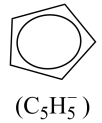
环戊二烯阴离子(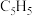 )的平面结构简式如图所示:
)的平面结构简式如图所示:
①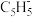 中C原子的杂化类型是
中C原子的杂化类型是_______ 。
②已知分子中的大π键可以用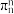 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则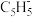 中大π键可以表示为
中大π键可以表示为_______ 。
(3)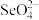 的空间构型为
的空间构型为_______ 。
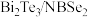 )中分段费米面。回答下列问题:
)中分段费米面。回答下列问题:(1)Bi与P位于同主族,基态P原子的价层电子排布式为
(2)二氯二茂铌的组成为
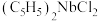 环戊二烯阴离子(
环戊二烯阴离子(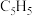 )的平面结构简式如图所示:
)的平面结构简式如图所示:
①
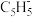 中C原子的杂化类型是
中C原子的杂化类型是②已知分子中的大π键可以用
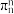 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则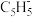 中大π键可以表示为
中大π键可以表示为(3)
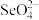 的空间构型为
的空间构型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】碳族元素中的碳、硅、锗及其化合物在诸多领域具有重要用途。回答下列问题:
(1)锗元素位于周期表____ 区,基态硅原子核外电子排布式为_______ 。
(2)草酸(分子式:H2C2O4,结构简式:HOOCCOOH)与NiSO4溶液反应,可制备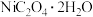 。
。
①组成H2C2O4的元素中第一电离能最大的为______ (填元素符号),该分子中σ键与π键的个数比为______ 。
② 中的键角为
中的键角为_______ ,该离子的空间结构为________ 。
(3)金刚石的结构及某碳硅化合物的晶胞结构如图所示,晶胞参数为a nm。_____ ( 为阿伏加德罗常数的值,下同)。
为阿伏加德罗常数的值,下同)。
②该碳硅化合物的化学式为______ ,其晶体的密度为______  。
。
(1)锗元素位于周期表
(2)草酸(分子式:H2C2O4,结构简式:HOOCCOOH)与NiSO4溶液反应,可制备
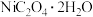 。
。①组成H2C2O4的元素中第一电离能最大的为
②
 中的键角为
中的键角为(3)金刚石的结构及某碳硅化合物的晶胞结构如图所示,晶胞参数为a nm。
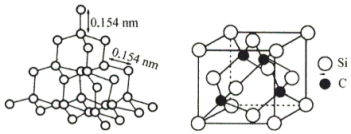
 为阿伏加德罗常数的值,下同)。
为阿伏加德罗常数的值,下同)。②该碳硅化合物的化学式为
 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据下列相关信息回答问题:
(1)A的元素符号为_______ ,D的元素名称为_______ 。
(2)基态B原子中能量最高的电子所在的原子轨道的电子云在空间有_______ 个伸展方向,原子轨道呈_______ 形。
(3)某同学根据上述信息,推断C基态原子的核外电子轨道表示式为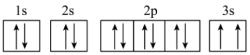 。该同学所写的轨道表示式违反了
。该同学所写的轨道表示式违反了_______ 。
(4)E元素原子核外有_______ 种运动状态不同的电子。
(5)G原子外围电子排布式为_______ 。
(6)检验F元素的方法是_______ 。
| A | 元素原子半径在周期表中最小,也是宇宙中最丰富的元素 |
| B | 元素原子的核外p轨道总电子数比s轨道总电子数少1 |
| C | 元素的第一至第四电离能分别是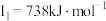 、 、 、 、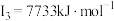 、 、 |
| D | 原子核外所有p轨道全满或半满 |
| E | 元素的主族序数与周期序数的差为4,原子半径在同周期中最小 |
| F | 是前四周期中电负性最小的元素 |
| G | 在周期表的第七列 |
(2)基态B原子中能量最高的电子所在的原子轨道的电子云在空间有
(3)某同学根据上述信息,推断C基态原子的核外电子轨道表示式为
 。该同学所写的轨道表示式违反了
。该同学所写的轨道表示式违反了(4)E元素原子核外有
(5)G原子外围电子排布式为
(6)检验F元素的方法是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】近年来,中国科学家首次在月球上发现新矿物,将其命名为“嫦娥石”,“嫦娥石”中包含了Fe、Cu、Ti、Cr、Ni、Mo、N、O等多种元素。回答下列问题:
(1)基态Ni原子价层电子排布图为___________ ,在 中阴离子的空间结构为
中阴离子的空间结构为___________ 。
(2)Cu催化烯烃硝化反应过程中会产生 。键角:
。键角:
___________ (填“>”或“<”) ,其原因是
,其原因是___________ 。
(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为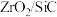 。四方
。四方 晶胞如图所示,
晶胞如图所示, 在晶胞中的配位数为
在晶胞中的配位数为___________ 。若该晶胞的参数为 ,
, 与最近
与最近 的距离为
的距离为___________ 。
(4) 、
、 、
、 。和
。和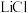 等可作锂离子聚合物电池的材料。在
等可作锂离子聚合物电池的材料。在 的组成元素的基态原子中,单电子数由多到少的顺序是
的组成元素的基态原子中,单电子数由多到少的顺序是___________ 。相同条件下,电池材料“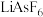 ”与“
”与“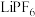 ”相比,“
”相比,“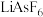 ”中的
”中的 脱嵌迁移速度较快,原因是
脱嵌迁移速度较快,原因是___________ 。
(1)基态Ni原子价层电子排布图为
 中阴离子的空间结构为
中阴离子的空间结构为(2)Cu催化烯烃硝化反应过程中会产生
 。键角:
。键角:
 ,其原因是
,其原因是(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为
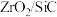 。四方
。四方 晶胞如图所示,
晶胞如图所示, 在晶胞中的配位数为
在晶胞中的配位数为 ,
, 与最近
与最近 的距离为
的距离为
(4)
 、
、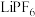 、
、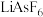 。和
。和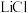 等可作锂离子聚合物电池的材料。在
等可作锂离子聚合物电池的材料。在 的组成元素的基态原子中,单电子数由多到少的顺序是
的组成元素的基态原子中,单电子数由多到少的顺序是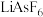 ”与“
”与“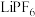 ”相比,“
”相比,“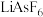 ”中的
”中的 脱嵌迁移速度较快,原因是
脱嵌迁移速度较快,原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】I.新型储氢材料是开发利用氢能的重要研究方向,Ti(BH4)3是一种储氢材料,可由LiBH4和TiCl4反应制得。
(1)基态B原子有___________ 种运动状态的电子,Li属于___________ 区(填“s”或“p”或“d”或“f”);
(2)LiBH4由Li+和 构成,
构成, 的空间结构是
的空间结构是___________ ,与 互为等电子体的分子为
互为等电子体的分子为___________ ,Li、Be、B元素的第一电离能由大到小排列顺序为___________ ;
(3)某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
M是___________ (填元素名称)。
II.叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H-N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为:N2H4+HNO2=2H2O+HN3.HN3的酸性和醋酸相近,可微弱电离出H+和 。回答下列问题:
。回答下列问题:
(4)下列有关说法正确的是___________(填序号);
(5)叠氮酸根能与许多金属离子等形成配合物,如[Co(N3)(NH3)5]SO4,该配合物中心离子显___________ 价;钴价电子排布式为___________ ;NH3空间构型是___________ 。
(1)基态B原子有
(2)LiBH4由Li+和
 构成,
构成, 的空间结构是
的空间结构是 互为等电子体的分子为
互为等电子体的分子为(3)某储氢材料是短周期金属元素M的氢化物。M的部分电离能如下表所示:
| I1/kJ·mol-1 | I2/kJ·mol-1 | I3/kJ·mol-1 | I4/kJ·mol-1 | I5/kJ·mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
M是
II.叠氮化合物是一类重要的化合物,其中氢叠氮酸(HN3)是一种弱酸,其分子结构可表示为H-N=N≡N,肼(N2H4)被亚硝酸氧化时便可得到氢叠氮酸(HN3),发生的反应为:N2H4+HNO2=2H2O+HN3.HN3的酸性和醋酸相近,可微弱电离出H+和
 。回答下列问题:
。回答下列问题:(4)下列有关说法正确的是___________(填序号);
| A.HN3中含有5个σ键 | B.HN3、HNO2、H2O、N2H4都是极性分子 |
| C.HN3中含有2个π键 | D.N2H4沸点高达113.5℃,说明肼分子间可形成氢键 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
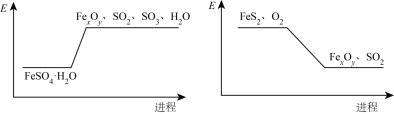
【推荐2】FeSO4·7H2O失水后可转为FeSO4·H2O,与FeS2可联合制备铁粉精(FexOy)和H2SO4。
I.FeSO4·H2O结构如图所示。
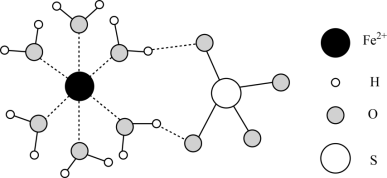
(1)Fe2+价层电子排布式为_______ 。
(2)比较键角大小:SO
_______ H2O分子(填“>”“<”或“=”),理由:_______ 。
(3)H2O与Fe2+、SO 和H2O的作用分别为
和H2O的作用分别为_______ 、_______ 。
(4)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构_______ 。
II.FeS2晶胞为立方体,边长为a nm,如图所示。

(5)①与Fe2+紧邻的阴离子个数为_______ 。
②晶胞的密度为_______ g/cm3。
(6)以FeS2为燃料,配合FeSO4·H2O可以制备铁粉精(FexOy)和H2SO4.结合图示解释可充分实现能源和资源有效利用的原因为______ 。
I.FeSO4·H2O结构如图所示。

(1)Fe2+价层电子排布式为
(2)比较键角大小:SO

(3)H2O与Fe2+、SO
 和H2O的作用分别为
和H2O的作用分别为(4)固态氟化氢中存在(HF)n形式,画出(HF)3的链状结构
II.FeS2晶胞为立方体,边长为a nm,如图所示。

(5)①与Fe2+紧邻的阴离子个数为
②晶胞的密度为
(6)以FeS2为燃料,配合FeSO4·H2O可以制备铁粉精(FexOy)和H2SO4.结合图示解释可充分实现能源和资源有效利用的原因为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】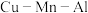 合金为磁性形状记忆合金材料之一,是制作逆变器和微电子机械系统的重要材料。
合金为磁性形状记忆合金材料之一,是制作逆变器和微电子机械系统的重要材料。
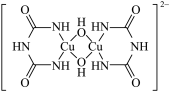
(1) 在碱性条件下加入双缩脲[
在碱性条件下加入双缩脲[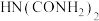 ]生成紫色物质,该物质为-2价的配位阴离子,其结构如图所示。该反应原理在化学上可以用于检验蛋白质。1mol该离子含有配位键的数目为
]生成紫色物质,该物质为-2价的配位阴离子,其结构如图所示。该反应原理在化学上可以用于检验蛋白质。1mol该离子含有配位键的数目为___________ 。
(2)利用单质Cu和液态 反应成功制备了无水
反应成功制备了无水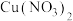 ,
,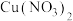 中的N原子的杂化类型为
中的N原子的杂化类型为___________ , 阴离子空间构型是
阴离子空间构型是___________ ,与 互为等电子体的分子有
互为等电子体的分子有___________ (写出两种)。
(3)已知 熔点为1040℃,
熔点为1040℃, 的熔点为194℃,分析其差异的原因:
的熔点为194℃,分析其差异的原因:___________ 。
(4) 合金的晶胞如a图所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,图b是沿立方格子对角面取得的截图,其中Al原子与相邻Cu原子相切。
合金的晶胞如a图所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,图b是沿立方格子对角面取得的截图,其中Al原子与相邻Cu原子相切。
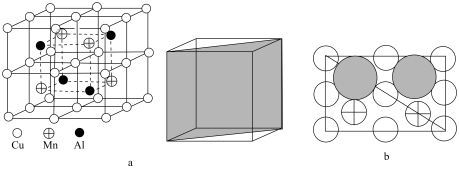
①有晶胞可知该合金的化学式为___________ ;
②已知半径: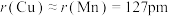 ,
, ,则该晶胞中Cu原子之间的最短核间距为
,则该晶胞中Cu原子之间的最短核间距为___________ pm。
 合金为磁性形状记忆合金材料之一,是制作逆变器和微电子机械系统的重要材料。
合金为磁性形状记忆合金材料之一,是制作逆变器和微电子机械系统的重要材料。(1)
 在碱性条件下加入双缩脲[
在碱性条件下加入双缩脲[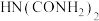 ]生成紫色物质,该物质为-2价的配位阴离子,其结构如图所示。该反应原理在化学上可以用于检验蛋白质。1mol该离子含有配位键的数目为
]生成紫色物质,该物质为-2价的配位阴离子,其结构如图所示。该反应原理在化学上可以用于检验蛋白质。1mol该离子含有配位键的数目为
(2)利用单质Cu和液态
 反应成功制备了无水
反应成功制备了无水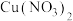 ,
,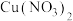 中的N原子的杂化类型为
中的N原子的杂化类型为 阴离子空间构型是
阴离子空间构型是 互为等电子体的分子有
互为等电子体的分子有(3)已知
 熔点为1040℃,
熔点为1040℃, 的熔点为194℃,分析其差异的原因:
的熔点为194℃,分析其差异的原因:(4)
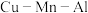 合金的晶胞如a图所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,图b是沿立方格子对角面取得的截图,其中Al原子与相邻Cu原子相切。
合金的晶胞如a图所示,该晶胞可视为Mn、Al位于Cu形成的立方体体心位置,图b是沿立方格子对角面取得的截图,其中Al原子与相邻Cu原子相切。
①有晶胞可知该合金的化学式为
②已知半径:
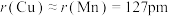 ,
, ,则该晶胞中Cu原子之间的最短核间距为
,则该晶胞中Cu原子之间的最短核间距为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】2021年10月18日出版的《自然-化学》刊登了我国科学技术大学吴长征团队的研究新成果:AgCrS2在室温下具有超离子行为,该研究成果为未来新结构二维材料的合成和探索提供了新思路。
(1)基态铬原子电子排布式为_______ ,以顺时针方向自旋的电子最多有_______ 个,第一电离能P>S的原因是_______ 。
(2)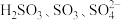 等微粒中,则H2S的中心原子杂化类型为
等微粒中,则H2S的中心原子杂化类型为_______ ,键角SO2________ SO3(填“>”、“=”、“<”), 的空间构型是
的空间构型是_______ 。
(3)CrF3、CrBr3的熔点分别为1100℃、79℃,其可能的主要原因是_______ 。
(4)氧铬酸钙是一种复合材料,可用于配制无机防锈颜料等,其晶胞结构如图
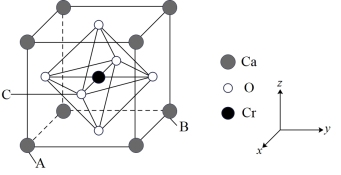
①已知A、B的原子坐标参数分别为(1,0,0)、(0,1,0),则C的原子坐标参数为_______ 。
②氧铬酸钙的化学式为_______ ,该晶体密度为ρg/cm3,钙和氧的最近距离为a nm,则代表阿伏加德罗常数NA=_________ mol-1
(1)基态铬原子电子排布式为
(2)
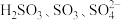 等微粒中,则H2S的中心原子杂化类型为
等微粒中,则H2S的中心原子杂化类型为 的空间构型是
的空间构型是(3)CrF3、CrBr3的熔点分别为1100℃、79℃,其可能的主要原因是
(4)氧铬酸钙是一种复合材料,可用于配制无机防锈颜料等,其晶胞结构如图

①已知A、B的原子坐标参数分别为(1,0,0)、(0,1,0),则C的原子坐标参数为
②氧铬酸钙的化学式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】在铜、银催化下,乙烯与氧气反应生成环氧乙烷( )和乙醛,下图是该反应的部分历程。
)和乙醛,下图是该反应的部分历程。

(2)鉴别以上产物乙醛和环氧乙烷可以用___________。
| A.原子发射光谱 | B.原子吸收光谱 | C.核磁共振氢谱 | D.红外光谱 |
(3)以下电子排布式和价电子轨道表示式中,正确且对应微粒为基态原子的是___________。
A.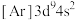 | B.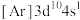 |
C. | D.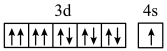 |
(4)已知
 的熔点为1235℃,
的熔点为1235℃, 的熔点为1130℃,二者晶体结构类似,且熔点都较高,但
的熔点为1130℃,二者晶体结构类似,且熔点都较高,但 熔点比
熔点比 高,其原因是
高,其原因是(5)
 晶胞结构如图所示,其中
晶胞结构如图所示,其中 代表的原子是
代表的原子是 ,晶胞参数为a pm,则阿伏加德罗常数值
,晶胞参数为a pm,则阿伏加德罗常数值
 和a的代数式表示)
和a的代数式表示)
 可以形成一种配位化合物,其结构如下图所示。以下说法正确的是___________。
可以形成一种配位化合物,其结构如下图所示。以下说法正确的是___________。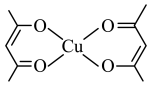
A. 的配位数是2 的配位数是2 |
| B.此配合物中存在配位键、极性键、非极性键 |
| C.配体中O原子提供空轨道 |
D. 提供孤电子对 提供孤电子对 |
(7)已知:常温下,①
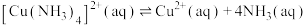
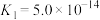 ;
;②


则常温下
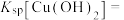
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】铜和硫的化合物在化工、医药材料等领域具有广泛的用途。回答下列问题:
(1)原子轨道是指电子在原子核外的___________ ,基态S原子的原子轨道数是____ 个。
(2)基态Cu原子中,核外电子占据的原子轨道为球形的最高能级符号是______ ,占据该能级的电子数为__________ 。
(3)Cl、S、Se在元素周期表中处于相邻的位置,其第一电离能的大小顺序为_______ 。
(4)下图是含元素Cu、S的有机物的结构简式:

①该有机化合物结构中含有的化学键类型是_______ (填“共价键““离子键”或“共价键、离子键”)、配位键,其中1个该有机物分子中配位键数为_____ 个,这些配位键中提供孤电子对的元素是__________ 。
②S原子的杂化方式为_______ 、带*N原子的杂化方式为_______ 。
(5)下图是Cu-Au合金的一种立方晶体结构:
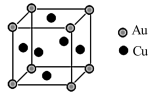
已知该合金的密度分dg/cm3,阿伏伽德罗常数的值为NA,若Au原子的半径为bpm(lpm=10-10cm),则铜原子的半径为______ cm(写出计算表达式)。
(1)原子轨道是指电子在原子核外的
(2)基态Cu原子中,核外电子占据的原子轨道为球形的最高能级符号是
(3)Cl、S、Se在元素周期表中处于相邻的位置,其第一电离能的大小顺序为
(4)下图是含元素Cu、S的有机物的结构简式:

①该有机化合物结构中含有的化学键类型是
②S原子的杂化方式为
(5)下图是Cu-Au合金的一种立方晶体结构:

已知该合金的密度分dg/cm3,阿伏伽德罗常数的值为NA,若Au原子的半径为bpm(lpm=10-10cm),则铜原子的半径为
您最近一年使用:0次



