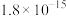某化学小组模拟工业生产原理:以废铁屑(含少量 、Mn、C等杂质)为原料生产配合物乙二胺四乙酸铁钠(EDTA铁钠盐),并测定所制取的样品中铁元素的含量。
、Mn、C等杂质)为原料生产配合物乙二胺四乙酸铁钠(EDTA铁钠盐),并测定所制取的样品中铁元素的含量。
已知:①乙二胺四乙酸铁钠,易溶于水和稀酸,微溶于乙醇;该螯合型配合物稳定性好
②氢氧化铁沉淀通常呈胶体状态,有较强的吸附性
Ⅰ.制备乙二胺四乙酸铁钠晶体
实验原理:
实验流程:
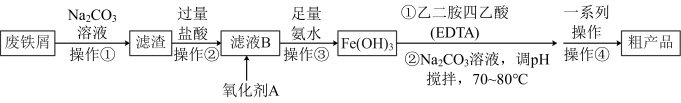
方案1:
(1)由 制乙二胺四乙酸铁钠可以选择
制乙二胺四乙酸铁钠可以选择_________ (填“酒精灯直接加热”或“水浴加热”)。
(2)氧化剂A可以选择 ,试写出该步反应的离子方程式
,试写出该步反应的离子方程式___________ 。
(3)下列说法正确的是___________ 。
A.为避免 沉淀中裹入过多杂质,可以采用一次性加入氨水
沉淀中裹入过多杂质,可以采用一次性加入氨水
B.该流程中两次用到 溶液,均可用
溶液,均可用 溶液代替
溶液代替
C.操作④洗涤时宜采用冷水洗涤
D.“一系列的操作”是指“蒸发浓缩,趁热过滤、洗涤、干燥”
E.乙二胺四乙酸铁钠溶液中滴入KSCN溶液不一定会显红色
方案2:用EDTA、 与
与 反应,制备乙二胺四乙酸铁钠,此法EDTA先被
反应,制备乙二胺四乙酸铁钠,此法EDTA先被 中和后再和
中和后再和 直接反应。两个方案都有不足之处,方案1的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。
直接反应。两个方案都有不足之处,方案1的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。
(4)为使沉淀颗粒增大,实验中往往可以采取___________ (填实验条件)。
(5)方案2的缺点:产品中含杂质多,纯度不好。方案2后剩余废液可用层柱法(利用筛网孔径与微粒孔径不同的一种分离方法)可得到反应的副产物___________ (填名称)。
Ⅱ.测定所制取样品中铁的含量(EDTA标准溶液滴定法)
取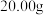 样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成
样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成 溶液,取出
溶液,取出 加入过量的
加入过量的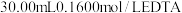 标准溶液并加热煮沸,充分反应后,再用
标准溶液并加热煮沸,充分反应后,再用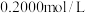 的
的 标准溶液滴定过量的EDTA至终点,消耗
标准溶液滴定过量的EDTA至终点,消耗 标准溶液体积为
标准溶液体积为 。
。
已知: 、
、 与EDTA反应的化学计量比均为
与EDTA反应的化学计量比均为 。
。
(6)实验室进行萃取操作时,需要打开分液漏斗活塞放气,正确的放气图示___________。
(7)计算铁元素的质量分数___________ 。
 、Mn、C等杂质)为原料生产配合物乙二胺四乙酸铁钠(EDTA铁钠盐),并测定所制取的样品中铁元素的含量。
、Mn、C等杂质)为原料生产配合物乙二胺四乙酸铁钠(EDTA铁钠盐),并测定所制取的样品中铁元素的含量。已知:①乙二胺四乙酸铁钠,易溶于水和稀酸,微溶于乙醇;该螯合型配合物稳定性好
②氢氧化铁沉淀通常呈胶体状态,有较强的吸附性
Ⅰ.制备乙二胺四乙酸铁钠晶体
实验原理:

实验流程:
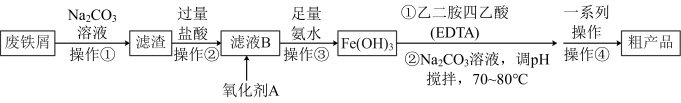
方案1:
(1)由
 制乙二胺四乙酸铁钠可以选择
制乙二胺四乙酸铁钠可以选择(2)氧化剂A可以选择
 ,试写出该步反应的离子方程式
,试写出该步反应的离子方程式(3)下列说法正确的是
A.为避免
 沉淀中裹入过多杂质,可以采用一次性加入氨水
沉淀中裹入过多杂质,可以采用一次性加入氨水B.该流程中两次用到
 溶液,均可用
溶液,均可用 溶液代替
溶液代替C.操作④洗涤时宜采用冷水洗涤
D.“一系列的操作”是指“蒸发浓缩,趁热过滤、洗涤、干燥”
E.乙二胺四乙酸铁钠溶液中滴入KSCN溶液不一定会显红色
方案2:用EDTA、
 与
与 反应,制备乙二胺四乙酸铁钠,此法EDTA先被
反应,制备乙二胺四乙酸铁钠,此法EDTA先被 中和后再和
中和后再和 直接反应。两个方案都有不足之处,方案1的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。
直接反应。两个方案都有不足之处,方案1的缺点:氢氧化铁沉淀成胶体状态,难以过滤和洗涤。(4)为使沉淀颗粒增大,实验中往往可以采取
(5)方案2的缺点:产品中含杂质多,纯度不好。方案2后剩余废液可用层柱法(利用筛网孔径与微粒孔径不同的一种分离方法)可得到反应的副产物
Ⅱ.测定所制取样品中铁的含量(EDTA标准溶液滴定法)
取
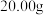 样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成
样品溶于水,然后将其中的铁元素用萃取剂从配合物中“反萃取”出来并配成 溶液,取出
溶液,取出 加入过量的
加入过量的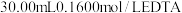 标准溶液并加热煮沸,充分反应后,再用
标准溶液并加热煮沸,充分反应后,再用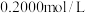 的
的 标准溶液滴定过量的EDTA至终点,消耗
标准溶液滴定过量的EDTA至终点,消耗 标准溶液体积为
标准溶液体积为 。
。已知:
 、
、 与EDTA反应的化学计量比均为
与EDTA反应的化学计量比均为 。
。(6)实验室进行萃取操作时,需要打开分液漏斗活塞放气,正确的放气图示___________。
A.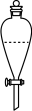 | B. | C.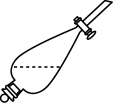 | D. |
(7)计算铁元素的质量分数
23-24高三上·浙江·阶段练习 查看更多[2]
更新时间:2023-12-06 10:29:18
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】被誉为“工业维他命”的铂族金属钌(Ru)广泛用于航天航空、石油化学、信息传感工业、制药等高科技领域。以下工艺实现了电子废弃物中铂族金属钌 的回收利用。已知电子废弃物主要成分为
的回收利用。已知电子废弃物主要成分为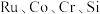 等物质,请回答以下问题:
等物质,请回答以下问题: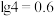 ②常见物质的
②常见物质的 如下表所示:
如下表所示:
(1)为加快“酸浸”时的浸取速率,下列措施中无法达到目的是______ (填字母)。
a.将样品粉碎 b.延长浸取时间 c.充分搅拌 d.适当增加盐酸浓度 e.适当升高温度
(2)滤渣2为______ 。
(3)“氧化溶浸”环节生成配离子 反应的离子方程式为
反应的离子方程式为______ 。
(4)“还原1”环节所需氧化剂和还原剂的物质的量之比为1:1,则 的氧化产物为
的氧化产物为______ 。
(5)滤液1中含 和
和 的浓度分别为
的浓度分别为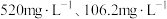 ,“调
,“调 ”时调
”时调 的范围为
的范围为______ 。(已知:当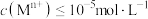 时,可认为
时,可认为 已经沉淀完全)
已经沉淀完全)
(6)沉钴。向除杂后的 溶液中加入
溶液中加入 溶液或
溶液或 溶液作沉淀剂,可得到
溶液作沉淀剂,可得到 ,不能用同浓度的
,不能用同浓度的 溶液代替
溶液代替 溶液的原因是
溶液的原因是______ 。
(7)制备 。将所得的
。将所得的 草酸钴晶体
草酸钴晶体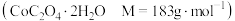 高温灼烧,其热重分析曲线如图:
高温灼烧,其热重分析曲线如图: 点对应的物质的化学式:
点对应的物质的化学式:______ ,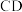 段发生反应的化学方程式为:
段发生反应的化学方程式为:______ 。
 的回收利用。已知电子废弃物主要成分为
的回收利用。已知电子废弃物主要成分为 等物质,请回答以下问题:
等物质,请回答以下问题: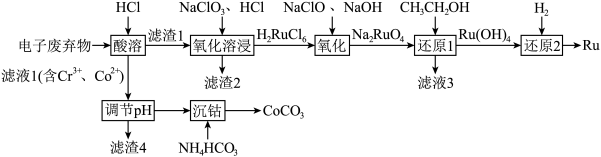
 ②常见物质的
②常见物质的 如下表所示:
如下表所示:化合物 |
|
|
|
|
|
(1)为加快“酸浸”时的浸取速率,下列措施中无法达到目的是
a.将样品粉碎 b.延长浸取时间 c.充分搅拌 d.适当增加盐酸浓度 e.适当升高温度
(2)滤渣2为
(3)“氧化溶浸”环节生成配离子
 反应的离子方程式为
反应的离子方程式为(4)“还原1”环节所需氧化剂和还原剂的物质的量之比为1:1,则
 的氧化产物为
的氧化产物为(5)滤液1中含
 和
和 的浓度分别为
的浓度分别为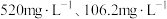 ,“调
,“调 ”时调
”时调 的范围为
的范围为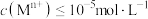 时,可认为
时,可认为 已经沉淀完全)
已经沉淀完全)(6)沉钴。向除杂后的
 溶液中加入
溶液中加入 溶液或
溶液或 溶液作沉淀剂,可得到
溶液作沉淀剂,可得到 ,不能用同浓度的
,不能用同浓度的 溶液代替
溶液代替 溶液的原因是
溶液的原因是(7)制备
 。将所得的
。将所得的 草酸钴晶体
草酸钴晶体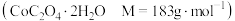 高温灼烧,其热重分析曲线如图:
高温灼烧,其热重分析曲线如图: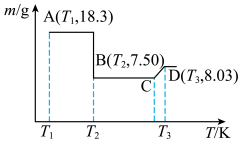
 点对应的物质的化学式:
点对应的物质的化学式: 段发生反应的化学方程式为:
段发生反应的化学方程式为:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】碳酸氢钠是一种应用广泛的盐,化学小组对其进行了探究。
(1)NaHCO3可称为钠盐或碳酸氢盐,它是由Na+和___________ (填离子符号)构成,医疗上能用于治疗胃酸(含有盐酸)过多症,反应的离子方程式为___________ 。
【提出问题】实验室中如何制取少量NaHCO3?
【查阅资料】
材料一:侯氏制碱的原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;2NaHCO3 Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
材料二:研究发现,NaHCO3溶于水时吸收热量,Na2CO3溶于水时放出热量。
【实验制备】根据侯氏制碱原理设计如图1所示装置制取NaHCO3。
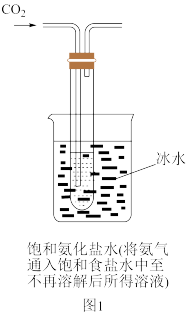
反应结束后,将试管中的混合物过滤洗涤,低温烘干得白色固体。
(2)烧杯中冰水的作用是___________ 。
(3)能进一步确认该白色固体是NaHCO3的实验方案是___________ (须用到的仪器和药品:试管、温度计、水)。
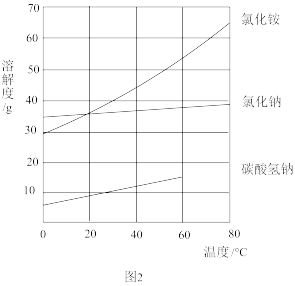
(4)如图2中碳酸氢钠的溶解度在60℃后无数据的原因可能是___________ 。
【性质探究】
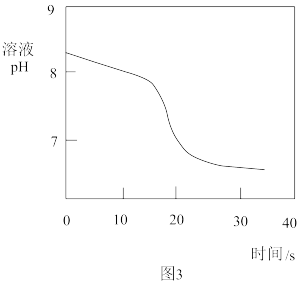
常温下,取一定量的NaHCO3溶液于烧杯中,插入pH传感器,向烧杯中持续滴加CaCl2溶液,有白色沉淀生成,当溶液的pH变为6.68时开始有无色气体产生。反应过程中溶液的pH随时间变化如图3所示。
【查阅资料】
材料三NaHCO3溶于水后,少量的 能同时发生如下变化:
能同时发生如下变化:
变化①: +H2O
+H2O H2CO3+OH-;
H2CO3+OH-;
变化②:

 +H+。
+H+。
材料四:溶液的酸碱性与溶液中H+和OH-数目的相对大小有关。常温下,当单位体积溶液中OH-的数目大于H+的数目时溶液的pH>7,反之pH<7;单位体积溶液中所含的H+数目越大,溶液的pH越小。
【交流反思】
(5)NaHCO3溶液显___________ (填“酸”“碱”或“中”)性,结合材料三、四从微观角度说明原因:___________ 。
(1)NaHCO3可称为钠盐或碳酸氢盐,它是由Na+和
【提出问题】实验室中如何制取少量NaHCO3?
【查阅资料】
材料一:侯氏制碱的原理:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;2NaHCO3
 Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。材料二:研究发现,NaHCO3溶于水时吸收热量,Na2CO3溶于水时放出热量。
【实验制备】根据侯氏制碱原理设计如图1所示装置制取NaHCO3。

反应结束后,将试管中的混合物过滤洗涤,低温烘干得白色固体。
(2)烧杯中冰水的作用是
(3)能进一步确认该白色固体是NaHCO3的实验方案是
(4)如图2中碳酸氢钠的溶解度在60℃后无数据的原因可能是

【性质探究】
常温下,取一定量的NaHCO3溶液于烧杯中,插入pH传感器,向烧杯中持续滴加CaCl2溶液,有白色沉淀生成,当溶液的pH变为6.68时开始有无色气体产生。反应过程中溶液的pH随时间变化如图3所示。

【查阅资料】
材料三NaHCO3溶于水后,少量的
 能同时发生如下变化:
能同时发生如下变化:变化①:
 +H2O
+H2O H2CO3+OH-;
H2CO3+OH-;变化②:


 +H+。
+H+。材料四:溶液的酸碱性与溶液中H+和OH-数目的相对大小有关。常温下,当单位体积溶液中OH-的数目大于H+的数目时溶液的pH>7,反之pH<7;单位体积溶液中所含的H+数目越大,溶液的pH越小。
【交流反思】
(5)NaHCO3溶液显
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】浓硫酸、五氧化二磷都是常用的酸性干燥剂。某小组为了探究它们的干燥能力,设计如下实验(加热装置省略),实验中观察到B中白色粉末变蓝,D中产生白色沉淀,且品红溶液不褪色。回答下列问题:

部分信息如下:
①已知几种物质的熔点、沸点如下表所示:
②Ba3(PO4)2为白色固体,难溶于水。
(1)仪器M的名称是___________ 。D中倒置漏斗的作用是___________ 。
(2)根据B中现象,可推断从A中逸出的物质含___________ (填化学式)。
(3)D中反应的离子方程式为___________ 。
(4)根据实验结果推知,五氧化二磷的干燥能力___________ (填“强于”、“弱于”或“等于”)98.3%硫酸。
(5)下列气体可以用98.3%硫酸干燥,也可以用五氧化二磷干燥的是___________ (填标号)。
a.硫化氢 b.氨气 c.二氧化氮 d.氯气
(6)加热A装置时温度不宜超过213℃,其原因是___________ 。

部分信息如下:
①已知几种物质的熔点、沸点如下表所示:
| 98.3%硫酸 | 磷酸 | 三氧化硫 | |
| 熔点/℃ | 10.5 | 42 | 16.8 |
| 沸点/℃ | 338 | 213 | 44.8 |
(1)仪器M的名称是
(2)根据B中现象,可推断从A中逸出的物质含
(3)D中反应的离子方程式为
(4)根据实验结果推知,五氧化二磷的干燥能力
(5)下列气体可以用98.3%硫酸干燥,也可以用五氧化二磷干燥的是
a.硫化氢 b.氨气 c.二氧化氮 d.氯气
(6)加热A装置时温度不宜超过213℃,其原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
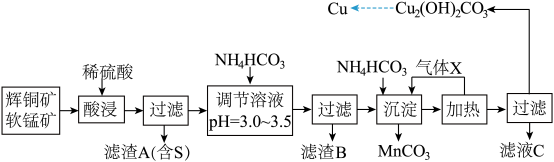
【推荐1】已知辉铜矿、软锰矿的主要成分如下表所示:
某化工厂拟以这两种矿石为原料采用湿法冶炼铜,工艺如下:
回答下列问题:
(1)气体 X 遇浓硝酸产生“白烟”,写出气体 X 的电子式:______________________________ 。
(2)提高“酸浸”速率的措施有______________________________ (填两条)。
(3)用离子方程式表示“酸浸”中 MnO2的作用:______________________________ ,被氧化的元素是______________________________ (填元素符号)。
(4)已知 CH3COONH4溶液呈中性,则常温下,NH4HCO3溶液 pH______________________________ (填“>”、“<”或“=”)7,理由是__________ 。
(5)从滤液 C 中可以提取一种化学肥料,它的化学式为_____________________________ 。
(6) 从溶液中析出的碱式碳酸铜可能带有结晶水,设其通式为 Cu2(OH)2CO3·xH2O。准确称取a g 样品,灼烧至恒重,称得 CuO 的质量,固体质量减轻 b g,则 x 为______________________________ 。
| 矿石 | 辉铜矿 | 软锰矿 |
| 主要成分 | Cu2S、Fe2O3、SiO2 | MnO2、SiO2 |
某化工厂拟以这两种矿石为原料采用湿法冶炼铜,工艺如下:

回答下列问题:
(1)气体 X 遇浓硝酸产生“白烟”,写出气体 X 的电子式:
(2)提高“酸浸”速率的措施有
(3)用离子方程式表示“酸浸”中 MnO2的作用:
(4)已知 CH3COONH4溶液呈中性,则常温下,NH4HCO3溶液 pH
(5)从滤液 C 中可以提取一种化学肥料,它的化学式为
(6) 从溶液中析出的碱式碳酸铜可能带有结晶水,设其通式为 Cu2(OH)2CO3·xH2O。准确称取a g 样品,灼烧至恒重,称得 CuO 的质量,固体质量减轻 b g,则 x 为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】锰酸锂( )是一种锂离子电池正极材料。以软锰矿浆液(含
)是一种锂离子电池正极材料。以软锰矿浆液(含 及少量
及少量 、
、 、
、 、
、 、
、 、
、 等的氧化物)烟气脱硫吸收液为原料,制备锰酸锂的流程如下:
等的氧化物)烟气脱硫吸收液为原料,制备锰酸锂的流程如下:

(1)“浸取”在题图所示的装置中进行,反应生成 ,
, 将
将 转化为
转化为 的离子方程式为
的离子方程式为_______ 。 局部过量会产生
局部过量会产生 ,保持温度、流速、反应时间、反应物和溶剂的量不变,为减少
,保持温度、流速、反应时间、反应物和溶剂的量不变,为减少 的产生可采取的措施是
的产生可采取的措施是_______ 。

(2)“浸取”液除杂后可获得较纯的 溶液(重金属离子质量浓度小于
溶液(重金属离子质量浓度小于 )。重金属离子质量浓度(
)。重金属离子质量浓度( )在除杂中的变化如下表所示。
)在除杂中的变化如下表所示。
已知:① 的价格:3000元/吨;
的价格:3000元/吨; 的价格:57500元/吨。
的价格:57500元/吨。
②大量使用 会造成污染,实验的滤液中按
会造成污染,实验的滤液中按 用量添加
用量添加 溶液沉淀重金属。
溶液沉淀重金属。
③中和氧化液的 在5~6之间。浸取液中
在5~6之间。浸取液中 沉淀完全,需要
沉淀完全,需要 大于9.
大于9.
请设计“除杂”的实验方案:量取浸取液,_______ ,得到较纯的 溶液。[须使用的试剂:
溶液。[须使用的试剂: 、
、 溶液、空气]。
溶液、空气]。
(3)为确定“锂化”需加入的 的质量,需要知道沉锰所得固体[
的质量,需要知道沉锰所得固体[ 、
、 和
和 ]中
]中 元素的质量。若
元素的质量。若 与沉锰所得固体在
与沉锰所得固体在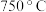 恰好完全反应,则
恰好完全反应,则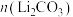 与
与 、
、 和
和 需要满足的关系为
需要满足的关系为_______ 。
(4)固相法制备 的实验过程如下:将高纯
的实验过程如下:将高纯 和
和 按一定的比例混合均匀,控制温度为
按一定的比例混合均匀,控制温度为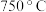 使其充分反应,两者恰好完全反应生成
使其充分反应,两者恰好完全反应生成 和气体。
和气体。
①纯净的 分解为
分解为 和
和 的温度为
的温度为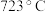 ,而固相法制备
,而固相法制备 的实验中,当温度升高至
的实验中,当温度升高至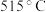 时,便产生
时,便产生 气体,其可能的原因是
气体,其可能的原因是_______ 。
②固相法制备 的实验中产生的气体有
的实验中产生的气体有_______ 。
③用沉锰所得固体制备 与固相法制备
与固相法制备 的相比,其优点为
的相比,其优点为_______ 。
 )是一种锂离子电池正极材料。以软锰矿浆液(含
)是一种锂离子电池正极材料。以软锰矿浆液(含 及少量
及少量 、
、 、
、 、
、 、
、 、
、 等的氧化物)烟气脱硫吸收液为原料,制备锰酸锂的流程如下:
等的氧化物)烟气脱硫吸收液为原料,制备锰酸锂的流程如下:
(1)“浸取”在题图所示的装置中进行,反应生成
 ,
, 将
将 转化为
转化为 的离子方程式为
的离子方程式为 局部过量会产生
局部过量会产生 ,保持温度、流速、反应时间、反应物和溶剂的量不变,为减少
,保持温度、流速、反应时间、反应物和溶剂的量不变,为减少 的产生可采取的措施是
的产生可采取的措施是
(2)“浸取”液除杂后可获得较纯的
 溶液(重金属离子质量浓度小于
溶液(重金属离子质量浓度小于 )。重金属离子质量浓度(
)。重金属离子质量浓度( )在除杂中的变化如下表所示。
)在除杂中的变化如下表所示。已知:①
 的价格:3000元/吨;
的价格:3000元/吨; 的价格:57500元/吨。
的价格:57500元/吨。②大量使用
 会造成污染,实验的滤液中按
会造成污染,实验的滤液中按 用量添加
用量添加 溶液沉淀重金属。
溶液沉淀重金属。③中和氧化液的
 在5~6之间。浸取液中
在5~6之间。浸取液中 沉淀完全,需要
沉淀完全,需要 大于9.
大于9.| 离子 |  |  |  |  |  |  |
| 浸出液 | 1058.2 | 1131 | 56.87 | 41.23 | 20.58 | 18.69 |
| 中和氧化液 | 3.51 | 6.23 | 54.26 | 37.67 | 18.32 | 17.89 |
| 硫化后液 | 0.43 | 0.89 | 0.59 | 0.13 | 0.06 | 0.04 |
 溶液。[须使用的试剂:
溶液。[须使用的试剂: 、
、 溶液、空气]。
溶液、空气]。(3)为确定“锂化”需加入的
 的质量,需要知道沉锰所得固体[
的质量,需要知道沉锰所得固体[ 、
、 和
和 ]中
]中 元素的质量。若
元素的质量。若 与沉锰所得固体在
与沉锰所得固体在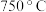 恰好完全反应,则
恰好完全反应,则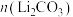 与
与 、
、 和
和 需要满足的关系为
需要满足的关系为(4)固相法制备
 的实验过程如下:将高纯
的实验过程如下:将高纯 和
和 按一定的比例混合均匀,控制温度为
按一定的比例混合均匀,控制温度为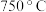 使其充分反应,两者恰好完全反应生成
使其充分反应,两者恰好完全反应生成 和气体。
和气体。①纯净的
 分解为
分解为 和
和 的温度为
的温度为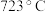 ,而固相法制备
,而固相法制备 的实验中,当温度升高至
的实验中,当温度升高至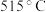 时,便产生
时,便产生 气体,其可能的原因是
气体,其可能的原因是②固相法制备
 的实验中产生的气体有
的实验中产生的气体有③用沉锰所得固体制备
 与固相法制备
与固相法制备 的相比,其优点为
的相比,其优点为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】氟化镨(PrF3)常用于电弧碳棒添加剂。利用方镨矿精矿(Pr2S3,难溶于水)制备氟化镨的流程如下:
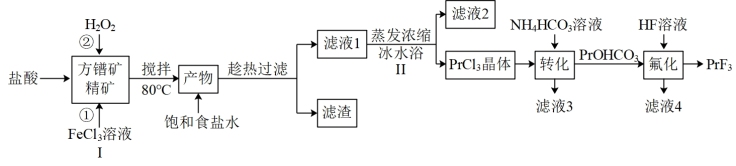
已知:① ;
;
② 、
、 以氢氧化物的形式完全沉淀时,溶液的pH分别为3.2、10.1。
以氢氧化物的形式完全沉淀时,溶液的pH分别为3.2、10.1。
(1)步骤I中加入 溶液后生成
溶液后生成 和S,该反应中氧化剂与还原剂的物质的量之比为
和S,该反应中氧化剂与还原剂的物质的量之比为_______ ,加入盐酸的另一个目的是控制pH在0.5~1.0,原因是_______ 。
(2)请用离子方程式解释反应②中加入 的作用:
的作用:_______ 。
(3)请用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因:_______ 。
(4)完成 溶液转化为
溶液转化为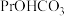 沉淀的离子方程式:□
沉淀的离子方程式:□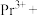 □
□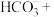 □
□ □
□ □
□ 。
。_______
(5)滤液3可用作_______ 。
(6)镨蓄电池具有稳定性高等有点,充电后两个电极上沉积的 分别转化为
分别转化为 和Pr,充电时阴极的电极反应式为
和Pr,充电时阴极的电极反应式为_______ 。

已知:①
 ;
;②
 、
、 以氢氧化物的形式完全沉淀时,溶液的pH分别为3.2、10.1。
以氢氧化物的形式完全沉淀时,溶液的pH分别为3.2、10.1。(1)步骤I中加入
 溶液后生成
溶液后生成 和S,该反应中氧化剂与还原剂的物质的量之比为
和S,该反应中氧化剂与还原剂的物质的量之比为(2)请用离子方程式解释反应②中加入
 的作用:
的作用:(3)请用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因:
(4)完成
 溶液转化为
溶液转化为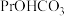 沉淀的离子方程式:□
沉淀的离子方程式:□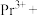 □
□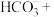 □
□ □
□ □
□ 。
。(5)滤液3可用作
(6)镨蓄电池具有稳定性高等有点,充电后两个电极上沉积的
 分别转化为
分别转化为 和Pr,充电时阴极的电极反应式为
和Pr,充电时阴极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程如下:
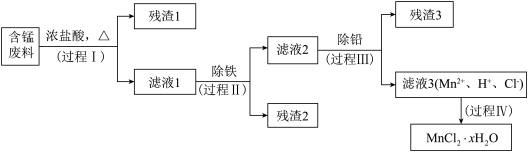
资料a.Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
注:金属离子的起始浓度为0.1mol·L-1
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnOOH与浓盐酸反应的离子方程式是_____ 。
②检验滤液1中含Fe3+的试剂____ 。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3++2Cl- b.4Fe2++O2+4H+=2Fe3++2H2O c._____ 。
(2)过程Ⅱ的目的是除铁。有如下两种方法,
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,再加盐酸酸化至pH小于5.5。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在_____ 之间。
②两种方法比较,氨水法除铁的缺点是_____ 。
(3)过程Ⅲ的目的是除铅。加入的试剂是___ 。
(4)过程Ⅳ所得固体中的x的测定如下,取m1g样品,置于氯化氢氛围中加热至失去全部结晶水时,质量变为m2g。则x=___ 。

资料a.Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b.生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
(1)过程Ⅰ的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnOOH与浓盐酸反应的离子方程式是
②检验滤液1中含Fe3+的试剂
③Fe3+由Fe2+转化而成,可能发生的反应有:
a.2Fe2++Cl2=2Fe3++2Cl- b.4Fe2++O2+4H+=2Fe3++2H2O c.
(2)过程Ⅱ的目的是除铁。有如下两种方法,
ⅰ.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ⅱ.焙烧法:将滤液1浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,再加盐酸酸化至pH小于5.5。
已知:焙烧中发生的主要反应为2FeCl3+3O2=2Fe2O3+3Cl2,MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在
②两种方法比较,氨水法除铁的缺点是
(3)过程Ⅲ的目的是除铅。加入的试剂是
(4)过程Ⅳ所得固体中的x的测定如下,取m1g样品,置于氯化氢氛围中加热至失去全部结晶水时,质量变为m2g。则x=
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】叠氮化钠(NaN3)常用作汽车安全气囊及头孢类药物生产等。水合肼还原亚硝酸甲酯(CH3ONO)制备叠氮化钠(NaN3)的工艺流程如下:
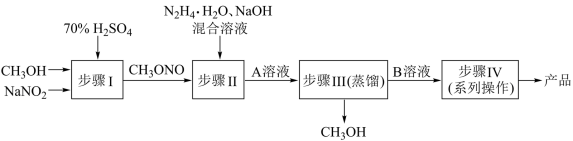
已知:i.叠氮化钠受热或剧烈撞击易分解,具有较强的还原性。
ii.相关物质的物理性质如下表:
(1)步骤I总反应的化学方程式为___________ 。
(2)实验室模拟工艺流程步骤II、III的实验装置如图。
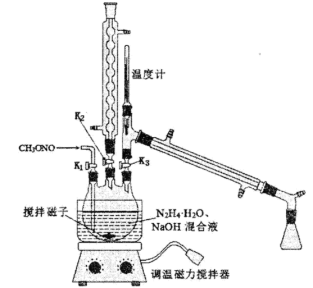
①步骤II三颈烧瓶中发生反应的化学方程式为___________ 。该反应放热,但在20℃左右选择性和转化率最高,实验中控制温度除使用冷水浴,还需采取的措施是___________ 。
②步骤II开始时的操作为___________ (选填字母编号)。步骤III蒸馏时的操作顺序是___________ (选填字母编号)。
a.打开K1、K2 b.关闭K1、K2 c.打开K3 d.关闭K3 e.水浴加热 f.通冷凝水
(3)步骤IV对B溶液加热蒸发至溶液体积的三分之一,冷却析出NaN3晶体,减压过滤,晶体用乙醇洗涤2~3次后,再___________ 干燥。精制NaN3的方法是___________ 。
(4)实验室用滴定法测定产品纯度。测定过程涉及的反应为:
2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑
Ce4++Fe2+=Ce3++Fe3+
称取2.50 g产品配成250 mL溶液,取25.00 mL置于锥形瓶中,加入V1 mLc1 mol·L-1(NH4)2Ce(NO3)6溶液,充分反应后稍作稀释,向溶液中加适量硫酸,滴加2滴邻菲罗啉指示剂,用c2 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗标准溶液V2 mL。
①产品纯度为___________ 。
②为了提高实验的精确度,该实验还需要___________ 。

已知:i.叠氮化钠受热或剧烈撞击易分解,具有较强的还原性。
ii.相关物质的物理性质如下表:
| 相关物质 | 熔点℃ | 沸点℃ | 溶解性 |
| CH3OH | -97 | 67.1 | 与水互溶 |
| 亚硝酸甲酯(CH3ONO) | -17 | -12 | 溶于乙醇、乙醚 |
| 水合肼(N2H4·H2O) | -40 | 118.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
| NaN3 | 275 | 300 | 与水互溶,微溶于乙醇,不溶于乙醚 |
(2)实验室模拟工艺流程步骤II、III的实验装置如图。

①步骤II三颈烧瓶中发生反应的化学方程式为
②步骤II开始时的操作为
a.打开K1、K2 b.关闭K1、K2 c.打开K3 d.关闭K3 e.水浴加热 f.通冷凝水
(3)步骤IV对B溶液加热蒸发至溶液体积的三分之一,冷却析出NaN3晶体,减压过滤,晶体用乙醇洗涤2~3次后,再
(4)实验室用滴定法测定产品纯度。测定过程涉及的反应为:
2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑
Ce4++Fe2+=Ce3++Fe3+
称取2.50 g产品配成250 mL溶液,取25.00 mL置于锥形瓶中,加入V1 mLc1 mol·L-1(NH4)2Ce(NO3)6溶液,充分反应后稍作稀释,向溶液中加适量硫酸,滴加2滴邻菲罗啉指示剂,用c2 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗标准溶液V2 mL。
①产品纯度为
②为了提高实验的精确度,该实验还需要
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】络氨铜 受热易分解产生氨气,络氨铜在乙醇—水混合溶剂中溶解度变化曲线如图所示,溶于水产生的
受热易分解产生氨气,络氨铜在乙醇—水混合溶剂中溶解度变化曲线如图所示,溶于水产生的 存在平衡:
存在平衡:

I.制备少量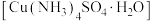 晶体,设计实验方案如下:
晶体,设计实验方案如下:

(1)仪器A的名称为________ ,对比铜和浓硫酸加热制备硫酸铜,该方案的优点是________ (答一条即可)。
(2)悬浊液B为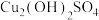 ,补全下列离子方程式:
,补全下列离子方程式:_________ 。
(3)某同学认为上述方案中的溶液C中一定含 ,设计如下方案证明其存在:加热深蓝色溶液并检验逸出气体为氨气。你认为此方案
,设计如下方案证明其存在:加热深蓝色溶液并检验逸出气体为氨气。你认为此方案____________ (填“可行”或“不可行”),理由是_______ 。
(4)取溶液C于试管中,加入____________ (填试剂),并用玻璃棒摩擦试管壁,即可得到产物晶体。
Ⅱ.探究浓氨水和 溶液反应
溶液反应
(5)某同学阅读教材中浓氨水和 溶液反应实验步骤:“取
溶液反应实验步骤:“取 的
的 溶液于试管中,滴加几滴
溶液于试管中,滴加几滴 的氨水,立即产生浅蓝色沉淀,继续滴加氨水并振荡试管,沉淀溶解,得到深蓝色透明溶液”,设计如下方案探究浓氨水和
的氨水,立即产生浅蓝色沉淀,继续滴加氨水并振荡试管,沉淀溶解,得到深蓝色透明溶液”,设计如下方案探究浓氨水和 溶液反应产物的影响因素。
溶液反应产物的影响因素。

①利用平衡移动原理对实验b的现象进行解释________________________ 。
②某同学测得
 溶液的
溶液的 ,于是设计实验c的试剂为
,于是设计实验c的试剂为 ,
, 硫酸和硫酸钠混合液,其目的是
硫酸和硫酸钠混合液,其目的是_______________ 。
 受热易分解产生氨气,络氨铜在乙醇—水混合溶剂中溶解度变化曲线如图所示,溶于水产生的
受热易分解产生氨气,络氨铜在乙醇—水混合溶剂中溶解度变化曲线如图所示,溶于水产生的 存在平衡:
存在平衡:

I.制备少量
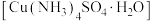 晶体,设计实验方案如下:
晶体,设计实验方案如下:
(1)仪器A的名称为
(2)悬浊液B为
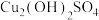 ,补全下列离子方程式:
,补全下列离子方程式:
(3)某同学认为上述方案中的溶液C中一定含
 ,设计如下方案证明其存在:加热深蓝色溶液并检验逸出气体为氨气。你认为此方案
,设计如下方案证明其存在:加热深蓝色溶液并检验逸出气体为氨气。你认为此方案(4)取溶液C于试管中,加入
Ⅱ.探究浓氨水和
 溶液反应
溶液反应(5)某同学阅读教材中浓氨水和
 溶液反应实验步骤:“取
溶液反应实验步骤:“取 的
的 溶液于试管中,滴加几滴
溶液于试管中,滴加几滴 的氨水,立即产生浅蓝色沉淀,继续滴加氨水并振荡试管,沉淀溶解,得到深蓝色透明溶液”,设计如下方案探究浓氨水和
的氨水,立即产生浅蓝色沉淀,继续滴加氨水并振荡试管,沉淀溶解,得到深蓝色透明溶液”,设计如下方案探究浓氨水和 溶液反应产物的影响因素。
溶液反应产物的影响因素。
①利用平衡移动原理对实验b的现象进行解释
②某同学测得

 溶液的
溶液的 ,于是设计实验c的试剂为
,于是设计实验c的试剂为 ,
, 硫酸和硫酸钠混合液,其目的是
硫酸和硫酸钠混合液,其目的是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】亚硝酰氯NOCl常用于合成洗涤剂、触媒及用作中间体,其熔点为-64.5℃,沸点-5.5℃,遇水易水解为两种酸。某学习小组在实验室用 与NO制备NOCl并测定其纯度,进行如下实验(部分夹持装置已略去)。
与NO制备NOCl并测定其纯度,进行如下实验(部分夹持装置已略去)。
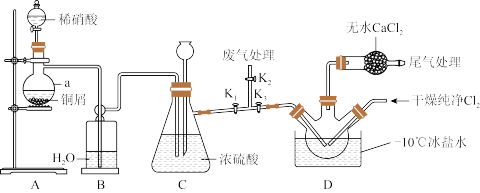
(1)实验室用 制取
制取 的离子方程式为
的离子方程式为_______ 。
(2)装置A中仪器a的名称为_______ ,装置C中长颈漏斗的作用是_______ 。
(3)若不用装置D中的干燥管,对实验有何影响_______ (用化学方程式表示)。
(4)N、O、Cl的简单离子中半径最小的是_______ (填离子符号),简单氢化物的熔沸点由高到低的顺序是_______ (用化学式表示)。
(5)通过以下实验测定NOCl样品的纯度。取D中所得液体10g溶于适量的NaOH溶液中,配制成250mL溶液;取出25.00mL于锥形瓶中,用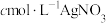 。标准溶液滴定,滴定终点时(只生成AgCl沉淀)消耗标准溶液的体积为20.00mL。则亚硝酰氯(NOCL)样品的纯度为
。标准溶液滴定,滴定终点时(只生成AgCl沉淀)消耗标准溶液的体积为20.00mL。则亚硝酰氯(NOCL)样品的纯度为_______ 。
 与NO制备NOCl并测定其纯度,进行如下实验(部分夹持装置已略去)。
与NO制备NOCl并测定其纯度,进行如下实验(部分夹持装置已略去)。
(1)实验室用
 制取
制取 的离子方程式为
的离子方程式为(2)装置A中仪器a的名称为
(3)若不用装置D中的干燥管,对实验有何影响
(4)N、O、Cl的简单离子中半径最小的是
(5)通过以下实验测定NOCl样品的纯度。取D中所得液体10g溶于适量的NaOH溶液中,配制成250mL溶液;取出25.00mL于锥形瓶中,用
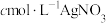 。标准溶液滴定,滴定终点时(只生成AgCl沉淀)消耗标准溶液的体积为20.00mL。则亚硝酰氯(NOCL)样品的纯度为
。标准溶液滴定,滴定终点时(只生成AgCl沉淀)消耗标准溶液的体积为20.00mL。则亚硝酰氯(NOCL)样品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀。为了确定沉淀的组成,某研究性学习小组进行了以下实验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀;
假设三:________________________________________ ;
(二)【理论探究】
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
KSP〔CuCO3〕=1.4×10-10KSP〔Cu(OH)2〕=5.6×10-20
若只由此数据结合适当计算来判断,假设______________ 是正确的。
(三)【实验探究】
步骤一:将CuSO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤 ,②______ ,③干燥。
步骤三:利用下图所示装置,进行定量分析:

① A装置中玻璃仪器的名称是______________ 。
② 仪器组装好后首先要进行的实验操作是_________________ 。
③ 实验结束时通入过量的空气的作用是_________________ 。
④ 数据记录:
(四)【实验结论】
利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,在沉淀中二者的物质的量之比为____________________ 。若所得沉淀是纯净物而不是混合物,请写出该物质的化学式_________________________________ 。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀;
假设三:
(二)【理论探究】
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
KSP〔CuCO3〕=1.4×10-10KSP〔Cu(OH)2〕=5.6×10-20
若只由此数据结合适当计算来判断,假设
(三)【实验探究】
步骤一:将CuSO4溶液倒入等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来,其操作方法为:①过滤 ,②
步骤三:利用下图所示装置,进行定量分析:

① A装置中玻璃仪器的名称是
② 仪器组装好后首先要进行的实验操作是
③ 实验结束时通入过量的空气的作用是
④ 数据记录:
| B装置的质量(g) | C装置的质量(g) | D装置的质量(g) | |
| 实验前 | 15.4 | 262.1 | 223.8 |
| 实验后 | 6.1 | 264.8 | 230.4 |
(四)【实验结论】
利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,在沉淀中二者的物质的量之比为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】如图所示的实验装置可用来测定含两种元素的某种气体 X 的分子式。
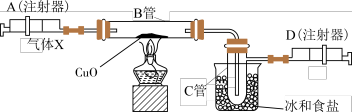
在注射器A中装有240mL气体 X 慢慢通过不含空气并装有红热的氧化铜的玻璃 管B,使之完全反应,得到下面的实验结果:
实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集的气体是氮气。试回答下列问题:
(1)X气体是由______ (填元素符号)元素组成的。
(2)若240mLX气体完全反应后,收集到的氮气质量是0.28g。根据实验时温度和压强计算 1molX气体的体积是24000mL,则X的摩尔质量是______ 。
(3)通过计算确定X的分子式为________ 。
(4)写出B中发生反应的化学方程式__________ 。(X在该条件下不发生分解反应)

在注射器A中装有240mL气体 X 慢慢通过不含空气并装有红热的氧化铜的玻璃 管B,使之完全反应,得到下面的实验结果:
实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集的气体是氮气。试回答下列问题:
(1)X气体是由
(2)若240mLX气体完全反应后,收集到的氮气质量是0.28g。根据实验时温度和压强计算 1molX气体的体积是24000mL,则X的摩尔质量是
(3)通过计算确定X的分子式为
(4)写出B中发生反应的化学方程式
您最近一年使用:0次