Ⅰ.分别取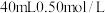 盐酸与
盐酸与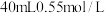 氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热
氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热 。请回答下列问题:
。请回答下列问题:
(1)本实验除烧杯、量筒、温度计外还缺少的玻璃仪器名称为___________ 。
(2)若某同学通过该实验测定出中和热 偏大,请分析可能的原因是
偏大,请分析可能的原因是___________ (填序号)。
A.用量筒量取盐酸时仰视读数
B.分多次将 溶液倒入盛有盐酸的小烧杯中
溶液倒入盛有盐酸的小烧杯中
C.将盐酸错取为等浓度的醋酸
Ⅱ.某化学小组为了探究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】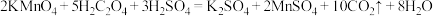
【实验内容及记录】
回答下列问题:
(3)根据上表中的实验数据,可以得到的结论是___________ 。
(4)利用实验3中数据计算,此条件下的反应速率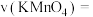
___________  。
。
(5)该小组同学根据经验绘制了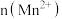 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中
随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中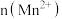 随时间变化的趋势应如图2所示。
随时间变化的趋势应如图2所示。
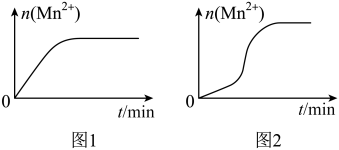
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设:生成的 对该反应有催化作用。
对该反应有催化作用。
②请你帮助该小组同学完成实验方案,并填写表中空白。
③现象及结论:依据现象___________ ,得出该小组同学提出的假设成立。
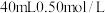 盐酸与
盐酸与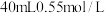 氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热
氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热 。请回答下列问题:
。请回答下列问题:(1)本实验除烧杯、量筒、温度计外还缺少的玻璃仪器名称为
(2)若某同学通过该实验测定出中和热
 偏大,请分析可能的原因是
偏大,请分析可能的原因是A.用量筒量取盐酸时仰视读数
B.分多次将
 溶液倒入盛有盐酸的小烧杯中
溶液倒入盛有盐酸的小烧杯中C.将盐酸错取为等浓度的醋酸
Ⅱ.某化学小组为了探究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】
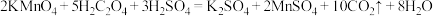
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量 | 室温下溶液褪色所需时间 | |||
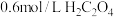 |  | 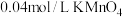 | 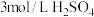 | ||
| 1 | 1.0 | 4.0 | 3.0 | 2.0 | 6.4 |
| 2 | 2.0 | 3.0 | 3.0 | 2.0 | 5.2 |
| 3 | 3.0 | 2.0 | 3.0 | 2.0 | 2.0 |
(3)根据上表中的实验数据,可以得到的结论是
(4)利用实验3中数据计算,此条件下的反应速率
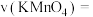
 。
。(5)该小组同学根据经验绘制了
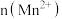 随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中
随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中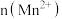 随时间变化的趋势应如图2所示。
随时间变化的趋势应如图2所示。
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设:生成的
 对该反应有催化作用。
对该反应有催化作用。②请你帮助该小组同学完成实验方案,并填写表中空白。
| 实验编号 | 室温下,试管中所加试剂及其用量 | 再向试管中加入少量固体 | 室温下溶液褪色所需时间 | |||
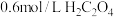 |  | 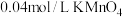 | 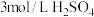 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | (填化学式) | t |
更新时间:2023-12-13 21:07:21
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】某实验小组用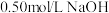 溶液和
溶液和 盐酸进行中和反应反应热的测定。
盐酸进行中和反应反应热的测定。
取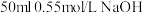 溶液和
溶液和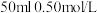 盐酸进行实验,实验数据如下表。测定稀盐酸和稀氢氧化钠溶液中和反应反应热的实验装置如图所示:
盐酸进行实验,实验数据如下表。测定稀盐酸和稀氢氧化钠溶液中和反应反应热的实验装置如图所示:
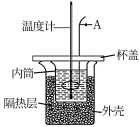
(1)仪器A的名称为___________ 。
(2)假设盐酸和氢氧化钠溶液的密度都是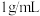 ,又知中和反应后生成溶液的比热容
,又知中和反应后生成溶液的比热容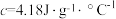 。为了计算中和热(稀溶液中,酸和碱发生中和反应生成
。为了计算中和热(稀溶液中,酸和碱发生中和反应生成 液态水放出的热量),某学生实验记录数据如下,请填写下表中的空白:
液态水放出的热量),某学生实验记录数据如下,请填写下表中的空白:
(3)依据该学生的实验数据计算,写出该反应的中和热的化学方程式:___________ (结果保留一位小数)。
(4)已知强酸强碱的稀溶液反应生成 液态
液态 时反应放出的热量为57.3kJ,上述实验产生偏差的原因可能是:___________(填字母)。
时反应放出的热量为57.3kJ,上述实验产生偏差的原因可能是:___________(填字母)。
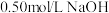 溶液和
溶液和 盐酸进行中和反应反应热的测定。
盐酸进行中和反应反应热的测定。取
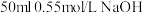 溶液和
溶液和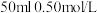 盐酸进行实验,实验数据如下表。测定稀盐酸和稀氢氧化钠溶液中和反应反应热的实验装置如图所示:
盐酸进行实验,实验数据如下表。测定稀盐酸和稀氢氧化钠溶液中和反应反应热的实验装置如图所示:
(1)仪器A的名称为
(2)假设盐酸和氢氧化钠溶液的密度都是
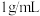 ,又知中和反应后生成溶液的比热容
,又知中和反应后生成溶液的比热容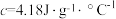 。为了计算中和热(稀溶液中,酸和碱发生中和反应生成
。为了计算中和热(稀溶液中,酸和碱发生中和反应生成 液态水放出的热量),某学生实验记录数据如下,请填写下表中的空白:
液态水放出的热量),某学生实验记录数据如下,请填写下表中的空白:| 实验次数 | 起始温度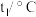 | 终止温度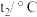 | 温度差平均值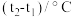 | ||
 |  | 平均值 | |||
| 1 | 21.2 | 21.0 | 21.1 | 23.5 | |
| 2 | 21.0 | 21.4 | 21.2 | 24.4 | |
| 3 | 21.3 | 21.5 | 21.4 | 24.8 | |
| 4 | 21.4 | 21.2 | 21.3 | 24.6 | |
(3)依据该学生的实验数据计算,写出该反应的中和热的化学方程式:
(4)已知强酸强碱的稀溶液反应生成
 液态
液态 时反应放出的热量为57.3kJ,上述实验产生偏差的原因可能是:___________(填字母)。
时反应放出的热量为57.3kJ,上述实验产生偏差的原因可能是:___________(填字母)。| A.实验装置保温、隔热效果差 |
B.量取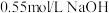 溶液的体积时仰视读数 溶液的体积时仰视读数 |
C.分多次把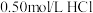 溶液倒入盛有 溶液倒入盛有 溶液的小烧杯中 溶液的小烧杯中 |
D.用温度计测定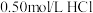 溶液起始温度后直接测定 溶液起始温度后直接测定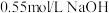 溶液的温度 溶液的温度 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。

回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________ 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值______ (填“偏大、 偏小、无影响”)
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热_____________ 填相等或不相等)。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会________ (填“偏大”、“偏小”、“无影响”)。
(5)已知一定条件下,CO(g)+H2O(g)=CO2(g)+H2(g)反应过程能量变化如图所示,该反应为________ (填“吸热”或“放热”)反应,反应的热化学方程式为________________ 。

(6)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ/mol;
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ/mol。
写出肼与二氧化氮反应的热化学方程式:___________________________ 。

回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)大烧杯上如不盖硬纸板,求得的中和热数值
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所求中和热
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会
(5)已知一定条件下,CO(g)+H2O(g)=CO2(g)+H2(g)反应过程能量变化如图所示,该反应为

(6)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ/mol;
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ/mol。
写出肼与二氧化氮反应的热化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】醋酸(用HAc表示)是常见的有机弱酸,某小组借助传感器探究醋酸的电离。
资料1:某温度下,按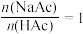 配制的溶液,
配制的溶液, 的值等于HAc的Ka;
的值等于HAc的Ka;
资料2:稀溶液中,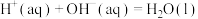 ΔH=-57.300kJ/mol。
ΔH=-57.300kJ/mol。
(1)配制0.10mol/L HAc溶液:
①配制250mL 0.10mol/L的HAc溶液,需要量取5.0mol/L HAc溶液的体积为___________ mL。
②配制250mL 0.10mol/L HAc溶液时,下列仪器中必须要用到的是___________ (填仪器名称)。
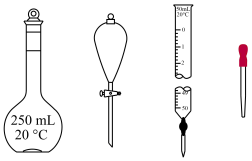
(2)探究电离程度:量取20.00mL所配HAc溶液于锥形瓶中,加入指示剂,用0.1000mol/L NaOH溶液滴定,恰好完全反应时消耗NaOH溶液21.20mL,用pH传感器测滴定过程的pH(部分数据如表所示)。
①指示剂适宜选用___________ (填“酚酞”或“甲基橙”)。
②根据表格数据,得出该温度下HAc的
___________ 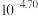 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
③下列测量操作中,会使醋酸的浓度偏大的是___________ 。
A.滴定的锥形瓶水洗后用待测液进行了润洗
B.滴定前仰视,滴定后俯视读数
C.量取待测液的酸式滴定管水洗后未润洗
D.配制标准0.1000mol/L NaOH溶液时,趁热定容配制
(3)探究电离过程热效应:取上述HAc和NaOH溶液各100mL于量热装置中反应,测得反应前后体系的温度值变化ΔT,重复操作3次,记录实验数据如表所示:
则平均每次HAc和NaOH溶液反应放出的热量为___________ J。
(已知:水的比热和密度分别为4.18J/(g·℃)、1.0g/mL,且忽略水以外各物质吸收的热量)
资料1:某温度下,按
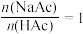 配制的溶液,
配制的溶液, 的值等于HAc的Ka;
的值等于HAc的Ka;资料2:稀溶液中,
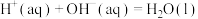 ΔH=-57.300kJ/mol。
ΔH=-57.300kJ/mol。(1)配制0.10mol/L HAc溶液:
①配制250mL 0.10mol/L的HAc溶液,需要量取5.0mol/L HAc溶液的体积为
②配制250mL 0.10mol/L HAc溶液时,下列仪器中必须要用到的是

(2)探究电离程度:量取20.00mL所配HAc溶液于锥形瓶中,加入指示剂,用0.1000mol/L NaOH溶液滴定,恰好完全反应时消耗NaOH溶液21.20mL,用pH传感器测滴定过程的pH(部分数据如表所示)。
| V(NaOH)/mL | 0.00 | 10.00 | 15.00 | 19.00 | 20.00 |
| pH | 2.87 | 4.70 | 5.12 | 5.70 | 6.02 |
②根据表格数据,得出该温度下HAc的

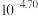 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。③下列测量操作中,会使醋酸的浓度偏大的是
A.滴定的锥形瓶水洗后用待测液进行了润洗
B.滴定前仰视,滴定后俯视读数
C.量取待测液的酸式滴定管水洗后未润洗
D.配制标准0.1000mol/L NaOH溶液时,趁热定容配制
(3)探究电离过程热效应:取上述HAc和NaOH溶液各100mL于量热装置中反应,测得反应前后体系的温度值变化ΔT,重复操作3次,记录实验数据如表所示:
| 实验 | Ⅰ | Ⅱ | Ⅲ |
| ΔT/℃ | 0.59 | 0.61 | 0.60 |
(已知:水的比热和密度分别为4.18J/(g·℃)、1.0g/mL,且忽略水以外各物质吸收的热量)
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】Shoichi研究了467℃、489℃时水煤气变换[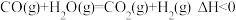 ]中
]中 和
和 分压随时间变化关系(如图所示),催化剂为氧化铁,实验初始时体系中的
分压随时间变化关系(如图所示),催化剂为氧化铁,实验初始时体系中的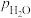 和
和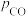 相等、
相等、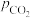 和
和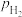 相等。
相等。
计算曲线a的反应在 内的平均速率
内的平均速率
________  。467℃时
。467℃时 和
和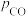 随时间变化关系的曲线分别是
随时间变化关系的曲线分别是________ 、________ 。489℃时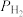 和
和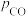 随时间变化关系的曲线分别是
随时间变化关系的曲线分别是_______ 、_______ 。
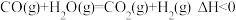 ]中
]中 和
和 分压随时间变化关系(如图所示),催化剂为氧化铁,实验初始时体系中的
分压随时间变化关系(如图所示),催化剂为氧化铁,实验初始时体系中的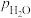 和
和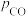 相等、
相等、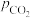 和
和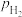 相等。
相等。
计算曲线a的反应在
 内的平均速率
内的平均速率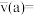
 。467℃时
。467℃时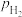 和
和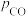 随时间变化关系的曲线分别是
随时间变化关系的曲线分别是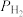 和
和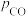 随时间变化关系的曲线分别是
随时间变化关系的曲线分别是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
(1)用D表示2 min内的平均反应速率为________ ,A的转化率为________ 。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度________ (填“增大”、“减
少”或“不变”)。
(3)若开始时只加C和D各4/3 mol,要使平衡时各物质的质量分数与原平衡相等,则还应加
入______ mol B物质。
(4)若向原平衡体系中再投入1 mol A和1 mol B,平衡________ (填“右移”、“左移”或“不
移动”)。
Ⅱ.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则:
①每消耗1 mol CH4可以向外电路提供____ mol e-;
②负极电极反应式为__________________________________________ ;
③电池放电后,溶液的pH不断________ 。
 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。(1)用D表示2 min内的平均反应速率为
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度
少”或“不变”)。
(3)若开始时只加C和D各4/3 mol,要使平衡时各物质的质量分数与原平衡相等,则还应加
入
(4)若向原平衡体系中再投入1 mol A和1 mol B,平衡
移动”)。
Ⅱ.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则:
①每消耗1 mol CH4可以向外电路提供
②负极电极反应式为
③电池放电后,溶液的pH不断
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】氮和碳的化合物在生产生活中应用广泛。
(1)①氯胺(NH2Cl)的电子式为_______________ 。
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为__________________ 。
(2)用焦炭还原NO的反应为:2NO(g)+C(s) N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
①该反应为_______________ (填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=___________ 。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如下图所示:
N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如下图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_____ Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是__________ (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=________ (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为:2CH3CHO+H2O CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如下图所示:
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如下图所示:
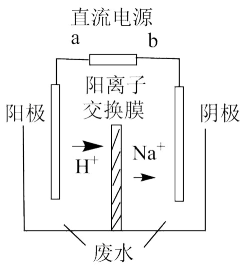
①试写出电解过程中,阴极的电极反应式:_________________________ 。
②在实际处理过程中,当电路中I=50A时,10min处理乙醛8.8g,则电流效率为__ (计算结果保留3位有效数字,每个电子的电量为1.6×10-19C,电流效率=实际反应所需电量/电路中通过电量×100%)。
(1)①氯胺(NH2Cl)的电子式为
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为
(2)用焦炭还原NO的反应为:2NO(g)+C(s)
 N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s)
 N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如下图所示:
N2(g)+2CO2(g),在恒温条件下,1mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如下图所示:
①A、B两点的浓度平衡常数关系:Kc(A)
②A、B、C三点中NO2的转化率最高的是
③计算C点时该反应的压强平衡常数Kp(C)=
(4)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,总反应为:2CH3CHO+H2O
 CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如下图所示:
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如下图所示:
①试写出电解过程中,阴极的电极反应式:
②在实际处理过程中,当电路中I=50A时,10min处理乙醛8.8g,则电流效率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某实验小组为确定过氧化氢分解的最佳催化条件,用如图实验装置进行实验,反应物用量和反应停止的时间数据如下:

分析表中数据回答下列问题:
(1)相同浓度的过氧化氢的分解速率随着二氧化锰用量的增加而________ 。
(2)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________ g的二氧化锰为较佳选择。
(3)该小组的某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________ ,理由是__________________________________ 。
(4)为加快过氧化氢的分解速率,除了使用MnO2作催化剂和改变过氧化氢的质量分数之外,还可以采取的加快反应速率的措施有_____ 。(回答任意两个合理的措施)

分析表中数据回答下列问题:
MnO2 时间 H2O2 | 0.1g | 0.3g | 0.8g |
10mL1.5% | 223s | 67s | 56s |
10mL3.0% | 308s | 109s | 98s |
10mL4.5% | 395s | 149s | 116s |
(2)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入
(3)该小组的某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确
(4)为加快过氧化氢的分解速率,除了使用MnO2作催化剂和改变过氧化氢的质量分数之外,还可以采取的加快反应速率的措施有
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】三氧化二砷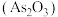 可用作玻璃工业的澄清脱色、生产高纯砷等,采用硫化砷渣(含
可用作玻璃工业的澄清脱色、生产高纯砷等,采用硫化砷渣(含 等)制备
等)制备 的工艺流程如下:
的工艺流程如下:
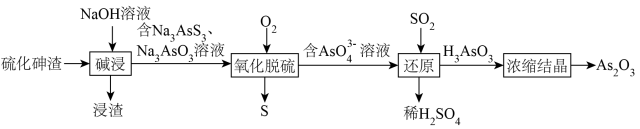
回答下列问题:
(1)“浸渣”的主要成分为_______ 、 等。
等。
(2)“碱浸”时, 反应的化学方程式为
反应的化学方程式为_______ ;为提高砷的浸出率可采取的措施是_______ (列举2条)。
(3)“氧化脱硫”时,被氧化的元素为_______ (填元素符号);已知溶液中 与
与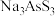 物质的量之比为
物质的量之比为 ,若恰好完全反应时生成
,若恰好完全反应时生成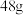 黄色固体,则消耗
黄色固体,则消耗_______ L(标准状况下) 。
。
(4)“还原”时,反应的离子方程式为_______ ( 为弱酸)。
为弱酸)。
(5)若硫化砷渣中含砷元素的质量分数为 ,上述流程中,砷元素损失率为
,上述流程中,砷元素损失率为 硫化砷渣可制备
硫化砷渣可制备_______ 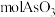 (用含
(用含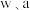 的代数式表示)。
的代数式表示)。
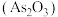 可用作玻璃工业的澄清脱色、生产高纯砷等,采用硫化砷渣(含
可用作玻璃工业的澄清脱色、生产高纯砷等,采用硫化砷渣(含 等)制备
等)制备 的工艺流程如下:
的工艺流程如下:
回答下列问题:
(1)“浸渣”的主要成分为
 等。
等。(2)“碱浸”时,
 反应的化学方程式为
反应的化学方程式为(3)“氧化脱硫”时,被氧化的元素为
 与
与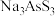 物质的量之比为
物质的量之比为 ,若恰好完全反应时生成
,若恰好完全反应时生成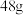 黄色固体,则消耗
黄色固体,则消耗 。
。(4)“还原”时,反应的离子方程式为
 为弱酸)。
为弱酸)。(5)若硫化砷渣中含砷元素的质量分数为
 ,上述流程中,砷元素损失率为
,上述流程中,砷元素损失率为 硫化砷渣可制备
硫化砷渣可制备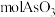 (用含
(用含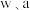 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:(已知H2C2O4是弱酸)
(1)通过实验A、B,可探究出___ 的改变对反应速率的影响,其中V1=___ ,T1=___ ,t2 ___ 8(填“>”、“<”或“=”)。
(2)通过实验____ 可探究出温度变化对化学反应速率的影响。
(3)若t1<8,则由实验A、B可以得出的结论是____ ;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为______ 。
(4)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式________ 。
(5)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是____ 。
| 实验 序号 | 实验 温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
| V(mL) | c(mol/L) | V(mL) | c(mol/L) | V(mL) | t(s) | ||
| A | 293K | 2 | 0.05 | 8 | 0.25 | 0 | t1 |
| B | T1 | 2 | 0.05 | 6 | 0.25 | V1 | 8 |
| C | 313K | 2 | 0.05 | 6 | 0.25 | 2 | t2 |
(2)通过实验
(3)若t1<8,则由实验A、B可以得出的结论是
(4)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式
(5)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】(1)某化学兴趣小组在用稀硫酸与纯锌粒制取氢气时发现反应速率较慢,为了加快该反应速率,他们进行了多项探究,针对他们的探究回答下列问题:
①他们进行的下列探究中不能达到实验目的的是_______ (填选项)
A.升高反应温度 B.适当增加硫酸的浓度 C.加水 D.把锌粒改用锌粉
②他们探究中还发现加入少量硫酸铜溶液也可加快氢气的生成速率。你认为原因是_______ 。
上述实验中除发生反应Zn+H2SO4=ZnSO4+H2↑,还发生了_______ (填离子反应方程式)
③他们分析后认为下列某一物质溶液也有类似硫酸铜的作用,你认为是_______ (填选项)
A.Na2SO4 B.Ag2SO4 C.MgSO4 D.K2SO4
(2)根据你所学的有关实验,填写下列空白。
④在实验室制取乙酸乙酯时,加入碎瓷片的作用是_______ 。
⑤石蜡油高温分解实验中,加入碎瓷片主要起_______ 作用。
⑥在实验室制取乙酸乙酯时,将制得的乙酸乙酯蒸汽导入_______ ,以达到除去杂质和收集产物的目的。
⑦设计一个比较醋酸与碳酸酸性强弱的实验_______ 。(用离子方程式表示)
①他们进行的下列探究中不能达到实验目的的是
A.升高反应温度 B.适当增加硫酸的浓度 C.加水 D.把锌粒改用锌粉
②他们探究中还发现加入少量硫酸铜溶液也可加快氢气的生成速率。你认为原因是
上述实验中除发生反应Zn+H2SO4=ZnSO4+H2↑,还发生了
③他们分析后认为下列某一物质溶液也有类似硫酸铜的作用,你认为是
A.Na2SO4 B.Ag2SO4 C.MgSO4 D.K2SO4
(2)根据你所学的有关实验,填写下列空白。
④在实验室制取乙酸乙酯时,加入碎瓷片的作用是
⑤石蜡油高温分解实验中,加入碎瓷片主要起
⑥在实验室制取乙酸乙酯时,将制得的乙酸乙酯蒸汽导入
⑦设计一个比较醋酸与碳酸酸性强弱的实验
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】含氯消毒剂在生产生活中有着广泛的用途,这些都与氯气息息相关。
Ⅰ.实验室制备和收集氯气的常用装置如图:
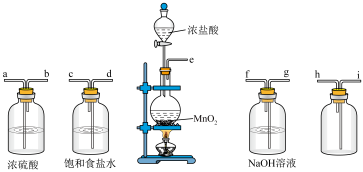
(1)在实验过程中饱和食盐水的作用是_______ 。
(2)实验装置接口的连接顺序为e→_______ →g→f;
(3)工业上常将 通入石灰乳中来制备漂白粉。使用漂白粉时,一般先将其溶于水形成溶液,在空气中放置一段时间后再使用,这样做的原因是(用化学方程式表示)
通入石灰乳中来制备漂白粉。使用漂白粉时,一般先将其溶于水形成溶液,在空气中放置一段时间后再使用,这样做的原因是(用化学方程式表示)_______ 。
Ⅱ.为探究NaCl对 在水中溶解度的影响,某兴趣小组同学进行实验,测定常温下
在水中溶解度的影响,某兴趣小组同学进行实验,测定常温下 在不同浓度NaCl溶液中的溶解度,结果如下表所示:
在不同浓度NaCl溶液中的溶解度,结果如下表所示:
已知: 在常温下水中的溶解度为
在常温下水中的溶解度为 。
。
(4)根据实验数据,当NaCl溶液浓度大于_______  时,NaCl溶液浓度增加对
时,NaCl溶液浓度增加对 在水中溶解度无明显影响;
在水中溶解度无明显影响;
(5)为进一步探究食盐水中哪些微粒能降低 在水中的溶解度,该小组同学取三支试管,分别加入一定浓度NaCl溶液、
在水中的溶解度,该小组同学取三支试管,分别加入一定浓度NaCl溶液、 溶液和KCl溶液,通入足量
溶液和KCl溶液,通入足量 后,测其溶解度,结果如下表所示:
后,测其溶解度,结果如下表所示:
请回答下列问题:
① ,b=
,b=_______  ,c=
,c=_______  ;
;
②设置实验2的目的是_______ ;
③对比实验1和实验3可以得到的结论是_______ ;
④实验结论:食盐水中能够降低 在水中溶解度的微粒有
在水中溶解度的微粒有_______ 。
Ⅰ.实验室制备和收集氯气的常用装置如图:

(1)在实验过程中饱和食盐水的作用是
(2)实验装置接口的连接顺序为e→
(3)工业上常将
 通入石灰乳中来制备漂白粉。使用漂白粉时,一般先将其溶于水形成溶液,在空气中放置一段时间后再使用,这样做的原因是(用化学方程式表示)
通入石灰乳中来制备漂白粉。使用漂白粉时,一般先将其溶于水形成溶液,在空气中放置一段时间后再使用,这样做的原因是(用化学方程式表示)Ⅱ.为探究NaCl对
 在水中溶解度的影响,某兴趣小组同学进行实验,测定常温下
在水中溶解度的影响,某兴趣小组同学进行实验,测定常温下 在不同浓度NaCl溶液中的溶解度,结果如下表所示:
在不同浓度NaCl溶液中的溶解度,结果如下表所示: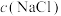 / / | 0.50 | 1.00 | 2.00 | 4.50 | 5.00 |
 溶解度( 溶解度( ) ) | 0.0658 | 0.0580 | 0.0490 | 0.0360 | 0.0360 |
 在常温下水中的溶解度为
在常温下水中的溶解度为 。
。(4)根据实验数据,当NaCl溶液浓度大于
 时,NaCl溶液浓度增加对
时,NaCl溶液浓度增加对 在水中溶解度无明显影响;
在水中溶解度无明显影响;(5)为进一步探究食盐水中哪些微粒能降低
 在水中的溶解度,该小组同学取三支试管,分别加入一定浓度NaCl溶液、
在水中的溶解度,该小组同学取三支试管,分别加入一定浓度NaCl溶液、 溶液和KCl溶液,通入足量
溶液和KCl溶液,通入足量 后,测其溶解度,结果如下表所示:
后,测其溶解度,结果如下表所示:| 实验编号 | 1 | 2 | 3 |
| 实验装置 | 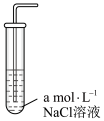 | 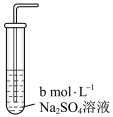 | 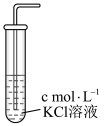 |
 溶解度 溶解度 | 0.0580 | 0.0800 | 0.0665 |
①
 ,b=
,b= ,c=
,c= ;
;②设置实验2的目的是
③对比实验1和实验3可以得到的结论是
④实验结论:食盐水中能够降低
 在水中溶解度的微粒有
在水中溶解度的微粒有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】西安北郊古墓中曾出土一青铜锤(一种酒具),表面附着有绿色固体物质,打开盖子酒香扑鼻,内盛有26 kg青绿色液体,专家认定是2000多年前的“西汉美酒”。这是我国考古界、酿酒界的一个重大发现。
(1)上述报道引发了某校化学兴趣小组同学的关注,他们收集家中铜器表面的绿色固体进行探究。
提出问题:铜器表面附着绿色固体物质是由哪些元素组成的?
猜想:查阅相关资料后,猜想绿色固体物质可能是铜绿。
实验步骤:
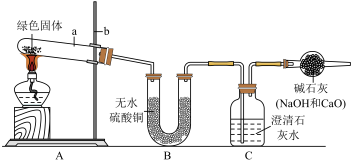
①对试管内的绿色固体进行加热,至完全分解。观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸。观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
④实验结论:绿色固体物质中含有________ 、________ 、________ 、________ 等元素(用元素符号作答)。(提示:装置内的空气因素忽略不计)
(2)表达与交流
①上述实验步骤③中发生反应的离子方程式________________________ 。
②干燥管中的碱石灰作用是什么?_______________________________ 。
若反应结束后,如果先移去酒精灯,可能出现的现象是什么?_________________ 。
③如果将B、C两装置对调行吗?________ 。为什么?_________________________ 。
(1)上述报道引发了某校化学兴趣小组同学的关注,他们收集家中铜器表面的绿色固体进行探究。
提出问题:铜器表面附着绿色固体物质是由哪些元素组成的?
猜想:查阅相关资料后,猜想绿色固体物质可能是铜绿。
实验步骤:

①对试管内的绿色固体进行加热,至完全分解。观察到A装置中绿色固体逐渐变成黑色,B装置中无水硫酸铜变成蓝色,C装置中澄清石灰水变浑浊。
②取少量加热后生成的黑色固体于试管中,加入稀硫酸。观察到黑色固体逐渐溶解,溶液变成蓝色。
③取少量上述蓝色溶液于试管中,浸入一根洁净的铁丝。观察到铁丝表面有红色物质析出。
④实验结论:绿色固体物质中含有
(2)表达与交流
①上述实验步骤③中发生反应的离子方程式
②干燥管中的碱石灰作用是什么?
若反应结束后,如果先移去酒精灯,可能出现的现象是什么?
③如果将B、C两装置对调行吗?
您最近一年使用:0次



