三氧化二砷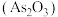 可用作玻璃工业的澄清脱色、生产高纯砷等,采用硫化砷渣(含
可用作玻璃工业的澄清脱色、生产高纯砷等,采用硫化砷渣(含 等)制备
等)制备 的工艺流程如下:
的工艺流程如下:
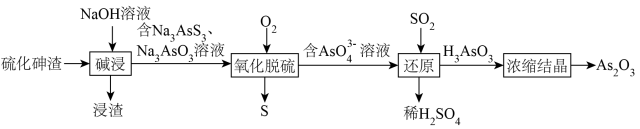
回答下列问题:
(1)“浸渣”的主要成分为_______ 、 等。
等。
(2)“碱浸”时, 反应的化学方程式为
反应的化学方程式为_______ ;为提高砷的浸出率可采取的措施是_______ (列举2条)。
(3)“氧化脱硫”时,被氧化的元素为_______ (填元素符号);已知溶液中 与
与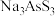 物质的量之比为
物质的量之比为 ,若恰好完全反应时生成
,若恰好完全反应时生成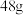 黄色固体,则消耗
黄色固体,则消耗_______ L(标准状况下) 。
。
(4)“还原”时,反应的离子方程式为_______ ( 为弱酸)。
为弱酸)。
(5)若硫化砷渣中含砷元素的质量分数为 ,上述流程中,砷元素损失率为
,上述流程中,砷元素损失率为 硫化砷渣可制备
硫化砷渣可制备_______ 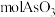 (用含
(用含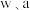 的代数式表示)。
的代数式表示)。
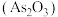 可用作玻璃工业的澄清脱色、生产高纯砷等,采用硫化砷渣(含
可用作玻璃工业的澄清脱色、生产高纯砷等,采用硫化砷渣(含 等)制备
等)制备 的工艺流程如下:
的工艺流程如下:
回答下列问题:
(1)“浸渣”的主要成分为
 等。
等。(2)“碱浸”时,
 反应的化学方程式为
反应的化学方程式为(3)“氧化脱硫”时,被氧化的元素为
 与
与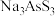 物质的量之比为
物质的量之比为 ,若恰好完全反应时生成
,若恰好完全反应时生成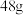 黄色固体,则消耗
黄色固体,则消耗 。
。(4)“还原”时,反应的离子方程式为
 为弱酸)。
为弱酸)。(5)若硫化砷渣中含砷元素的质量分数为
 ,上述流程中,砷元素损失率为
,上述流程中,砷元素损失率为 硫化砷渣可制备
硫化砷渣可制备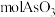 (用含
(用含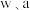 的代数式表示)。
的代数式表示)。
更新时间:2023-07-28 21:00:41
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】通过废旧的钴酸锂电池可以回收金属铝、锂和钴。其生产流程如下所示:

已知:①钴酸锂电池正极材料为LiCoO2、炭黑及铝片;②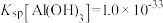 。回答下列问题:
。回答下列问题:
(1)电池“预处理”时需要将电池完全放电,原因是_______ 。
(2)不溶性的LiCoO2在“浸取、还原”过程中发生反应的离子方程式为_______ .
(3)若溶液中离子浓度为 时。认为完全沉淀。则Al 完全沉淀时溶液的pH至少为
时。认为完全沉淀。则Al 完全沉淀时溶液的pH至少为_______ 。
(4)P2O4是磷酸酯类,密度比水小。是该实验的萃取剂。通过“反萃取”,可以循环利用。下列关于“萃取”的说法正确的是_______ (填字母代号)。
a.使用一定量P2O4萃取时应该将萃取剂分多次萃取,萃取效率更高
b.分液漏斗使用前一定要检验是否漏液
c.振荡过程中,需要打开活塞放气
d.萃取后分液时需要先旋开活塞,再打开上端玻璃塞
(5)“反萃取”时不宜加入烧碱溶液的原因是_______ 。反萃取时获取P2O4的操作方法是_______ 。
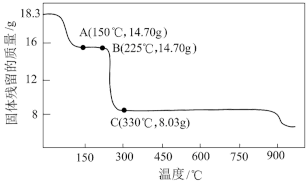
(6)CoC2O4是制备钴的重要原料。取18.3g CoC2O4·2HO在空气中受热的质量变化曲线如图所示。已知曲线中温度高于或等于300℃时所得固体为不同的钴氧化物。写出B→C点发生反应的化学方程式:_______ 。

已知:①钴酸锂电池正极材料为LiCoO2、炭黑及铝片;②
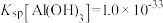 。回答下列问题:
。回答下列问题:(1)电池“预处理”时需要将电池完全放电,原因是
(2)不溶性的LiCoO2在“浸取、还原”过程中发生反应的离子方程式为
(3)若溶液中离子浓度为
 时。认为完全沉淀。则Al 完全沉淀时溶液的pH至少为
时。认为完全沉淀。则Al 完全沉淀时溶液的pH至少为(4)P2O4是磷酸酯类,密度比水小。是该实验的萃取剂。通过“反萃取”,可以循环利用。下列关于“萃取”的说法正确的是
a.使用一定量P2O4萃取时应该将萃取剂分多次萃取,萃取效率更高
b.分液漏斗使用前一定要检验是否漏液
c.振荡过程中,需要打开活塞放气
d.萃取后分液时需要先旋开活塞,再打开上端玻璃塞
(5)“反萃取”时不宜加入烧碱溶液的原因是
(6)CoC2O4是制备钴的重要原料。取18.3g CoC2O4·2HO在空气中受热的质量变化曲线如图所示。已知曲线中温度高于或等于300℃时所得固体为不同的钴氧化物。写出B→C点发生反应的化学方程式:

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】某无色溶液中含有的金属阳离子为Mg2+、Al3+,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的物质的量与加入NaOH的物质的量的关系如图所示。

(1)由此确定原溶液中一定还大量含有某阳离子,它可能是________ 。
(2)若溶质为MgCl2和Al2(SO4)3,则原溶液中铝离子的物质的量为______________ 。
(3)下列图像中,横坐标表示加入试剂或通入气体的物质的量,纵坐标表示产生沉淀的质量,用图像的序号或文字回答下列问题:

Ⅰ.表示向AlCl3溶液中逐渐滴加NaOH溶液的是______ ;
Ⅱ.表示向NaAlO2溶液中逐渐滴加稀盐酸的是________ ;
Ⅲ.表示向NaAlO2溶液中通入CO2的是________ ;
Ⅳ.③图____________ (填“能”或“不能”)代表向含NaOH的澄清石灰水中通入CO2。

(1)由此确定原溶液中一定还大量含有某阳离子,它可能是
(2)若溶质为MgCl2和Al2(SO4)3,则原溶液中铝离子的物质的量为
(3)下列图像中,横坐标表示加入试剂或通入气体的物质的量,纵坐标表示产生沉淀的质量,用图像的序号或文字回答下列问题:

Ⅰ.表示向AlCl3溶液中逐渐滴加NaOH溶液的是
Ⅱ.表示向NaAlO2溶液中逐渐滴加稀盐酸的是
Ⅲ.表示向NaAlO2溶液中通入CO2的是
Ⅳ.③图
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】I. (1)在标准状况下,67.2 L CO2质量为________ g,含有_________ 个CO2分子,其中含有_________ mol氧原子
(2)某气态氧化物化学式为R2O3,在标准状况下,1.52 g该氧化物的体积是448 mL,则R的摩尔质量为_________ 。
(3)仪器 的名称是
的名称是_____ 。
(4)电解2L饱和食盐水的化学反应方程式为2NaCl+2H2O 2NaOH+Cl2↑+H2↑,常温常压下,产生氯气的质量比氢气多103.5g,忽略电解前后溶液体积变化,则电解后所得NaOH溶液的物质的量浓度为
2NaOH+Cl2↑+H2↑,常温常压下,产生氯气的质量比氢气多103.5g,忽略电解前后溶液体积变化,则电解后所得NaOH溶液的物质的量浓度为____________ ,消耗的NaCl的质量是________ 。
II.钠和氯是我们熟悉的典型金属元素与非金属元素,研究它们的性质对于生产、生活、科研具有重要意义。请回答以下问题:
(1)金属钠在空气中燃烧的产物,常用于呼吸面具中的供氧剂,其工作原理是(用化学反应方程式回答)___________________________________________________________ 。
(2)某化学兴趣小组设计以下装置来验证Cl2的性质。

①装置A中的现象是__________ ,出现此现象的原因是____________ 。
②装置B的作用是_____________ 。
③装置C与装置D中的现象是否相同_________ (填“是”或“否” ),根据装置C和D中的现象可以得到的结论是_____________________________________________ 。
④装置E的作用是吸收尾, E中发生反应的化学方程式为_____________________________ 。
(2)某气态氧化物化学式为R2O3,在标准状况下,1.52 g该氧化物的体积是448 mL,则R的摩尔质量为
(3)仪器
 的名称是
的名称是(4)电解2L饱和食盐水的化学反应方程式为2NaCl+2H2O
 2NaOH+Cl2↑+H2↑,常温常压下,产生氯气的质量比氢气多103.5g,忽略电解前后溶液体积变化,则电解后所得NaOH溶液的物质的量浓度为
2NaOH+Cl2↑+H2↑,常温常压下,产生氯气的质量比氢气多103.5g,忽略电解前后溶液体积变化,则电解后所得NaOH溶液的物质的量浓度为II.钠和氯是我们熟悉的典型金属元素与非金属元素,研究它们的性质对于生产、生活、科研具有重要意义。请回答以下问题:
(1)金属钠在空气中燃烧的产物,常用于呼吸面具中的供氧剂,其工作原理是(用化学反应方程式回答)
(2)某化学兴趣小组设计以下装置来验证Cl2的性质。

①装置A中的现象是
②装置B的作用是
③装置C与装置D中的现象是否相同
④装置E的作用是吸收尾, E中发生反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】I.实验室用50 mL 0.50mol/L盐酸、50mL 0.55 mol/LNaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:

完成下列问题:
(1)图中实验装置中尚缺少的玻璃仪器是____________________________ .
(2)在操作正确的前提下,提高中和热测定准确性的关键是________________________ .
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=_________ [盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g·℃)计算].
(4)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将_____ (填“偏大”、“偏小”、“不变”).如改用60 mL0.5mol/L的盐酸与50 mL 0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量______ (填“相等”或“不相等”),所求中和热_____ (填“相等”或“不相等”)。
(5) 上述实验结果数值与57.3相比有偏差,产生偏差的原因可能是(填字母)______ .
A.测量盐酸的温度后,温度计没有用水冲洗干净
B. 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取NaOH溶液时仰视计数
E.大烧杯的盖扳中间小孔太大。
Ⅱ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:

(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) ≥_______ 。
(2)试验编号②和③探究的内容是_____________ 。
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=__________ mol·L-1·min-1。

| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)图中实验装置中尚缺少的玻璃仪器是
(2)在操作正确的前提下,提高中和热测定准确性的关键是
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=
(4)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将
(5) 上述实验结果数值与57.3相比有偏差,产生偏差的原因可能是(填字母)
A.测量盐酸的温度后,温度计没有用水冲洗干净
B. 把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取NaOH溶液时仰视计数
E.大烧杯的盖扳中间小孔太大。
Ⅱ.某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过褪色所需时间来判断反应的快慢。该小组设计了如下方案:

(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4) ≥
(2)试验编号②和③探究的内容是
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一.如图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:
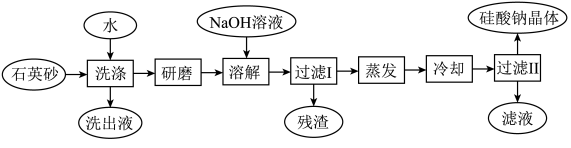
(1)要将上流程图中洗出液中的溶质析出,采用的方法是_____________;
(2)蒸发时用到的硅酸盐仪器有_____________ ;
(3)在以上流程中,要将洗净的石英砂研磨成粉末,目的是_____________;
(4)上流程中加入NaOH溶液,反应的离子方程式是_____________ ;
(5)硅酸钠溶液呈碱性,其原因是(用一离子方程式表示)_____________ ,硅酸钠的用途很广,其中的一种用途是_____________ ;
(6)用上流程中的残渣来焊接铁轨,反应的化学方程式是_____________ 。

(1)要将上流程图中洗出液中的溶质析出,采用的方法是_____________;
| A.蒸发结晶 | B.冷却结晶 | C.先蒸发,再冷却结晶 | D.先冷却,再蒸发结晶 |
(3)在以上流程中,要将洗净的石英砂研磨成粉末,目的是_____________;
| A.增加反应物的浓度,增大化学反应速率,提高生产效率 |
| B.作为催化剂载体,增加反应物与催化剂接触面积,增加反应速率,提高生产效率 |
| C.增加反应物之间的接触面积,增大反应速率,提高生产效率 |
| D.增加正反应速率,减小逆反应速率,使平衡向正反应方向移动,降低生产成本 |
(5)硅酸钠溶液呈碱性,其原因是(用一离子方程式表示)
(6)用上流程中的残渣来焊接铁轨,反应的化学方程式是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某研究小组进行实验探究影响化学反应速率的外界因素。
[实验一] 验证温度、催化剂的比表面积对化学反应速率的影响规律。
已知:一种新型催化剂能使NO和CO发生反应:2NO+2CO⇌2CO2+N2。增大催化剂的比表面积可提高该反应速率。
(1)能验证温度对化学反应速率影响规律的是实验_______ (填实验序号)。
(2)实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线_______ (填“甲”或“乙”)。

[实验二]探究常温下催化剂对过氧化氢分解反应的影响。
(1)实验Ⅰ的作用是_______ 。
(2)根据实验Ⅰ~Ⅲ中现象的不同,可以得出的结论是:
①使用合适的催化剂,可提高双氧水分解的反应速率;
②_______ 。
[实验一] 验证温度、催化剂的比表面积对化学反应速率的影响规律。
已知:一种新型催化剂能使NO和CO发生反应:2NO+2CO⇌2CO2+N2。增大催化剂的比表面积可提高该反应速率。
| 实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.50×10-3 | 3.80×10-3 | 82 |
| Ⅱ | 280 | 1.50×10-3 | 3.80×10-3 | 124 |
| Ⅲ | 350 | 1.50×10-3 | 3.80×10-3 | 82 |
(2)实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线

[实验二]探究常温下催化剂对过氧化氢分解反应的影响。
| Ⅰ | Ⅱ | Ⅲ | |
| 实验操作示意图 |  |  |  |
| 实验现象 | 有极少量气泡产生 | 产生气泡速率略有加快 | 产生气泡速率明显加快 |
(2)根据实验Ⅰ~Ⅲ中现象的不同,可以得出的结论是:
①使用合适的催化剂,可提高双氧水分解的反应速率;
②
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】以FeSO4溶液为主要原料制取废水处理剂FeOOH,其流程如下:
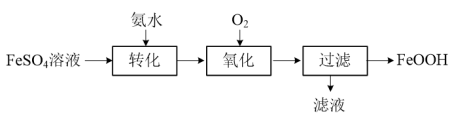
(1)检验FeSO4溶液是否被氧化可选用的试剂是_______ (填化学式)。“转化”时适量氨水将Fe2+部分转化为Fe(OH)2,每生成1 mol Fe(OH)2,理论上参加该反应的NH3·H2O的物质的量为_______ mol。
(2)“氧化”时以一定流速向所得固液混合物中通入O2,反应生成FeOOH。过程中溶液的pH随时间的变化情况如图所示:

已知:pH =-lg c(H+) 。
①0~t1时,Fe(OH)2转化为FeOOH时发生反应的化学方程式为_______ 。
②t1~t2时,FeOOH继续增加,溶液pH减小,原因是_______ (用离子方程式表示)。
(3)通过下列方法测定产品中FeOOH的质量分数:准确称取2.000 g产品,加适量盐酸溶解,再加入适量SnCl2溶液,发生反应2Fe3+ + Sn2+ = 2Fe2+ + Sn4+;除去过量的SnCl2,再向其中加入0.1000 mol·L−1 K2Cr2O7溶液至反应恰好完全,发生反应Cr2O + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,消耗K2Cr2O7溶液36.00 mL。计算该产品中FeOOH的质量分数(写出计算过程)
+ 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,消耗K2Cr2O7溶液36.00 mL。计算该产品中FeOOH的质量分数(写出计算过程) _______ 。

(1)检验FeSO4溶液是否被氧化可选用的试剂是
(2)“氧化”时以一定流速向所得固液混合物中通入O2,反应生成FeOOH。过程中溶液的pH随时间的变化情况如图所示:

已知:pH =-lg c(H+) 。
①0~t1时,Fe(OH)2转化为FeOOH时发生反应的化学方程式为
②t1~t2时,FeOOH继续增加,溶液pH减小,原因是
(3)通过下列方法测定产品中FeOOH的质量分数:准确称取2.000 g产品,加适量盐酸溶解,再加入适量SnCl2溶液,发生反应2Fe3+ + Sn2+ = 2Fe2+ + Sn4+;除去过量的SnCl2,再向其中加入0.1000 mol·L−1 K2Cr2O7溶液至反应恰好完全,发生反应Cr2O
 + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,消耗K2Cr2O7溶液36.00 mL。计算该产品中FeOOH的质量分数(写出计算过程)
+ 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,消耗K2Cr2O7溶液36.00 mL。计算该产品中FeOOH的质量分数(写出计算过程)
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下:

已知部分物质沉淀的 pH 及 CaSO4 的溶解度曲线如下:

(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有_______ (填化学式)。
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围_______ ,检验Fe3+已经除尽的操作是_______ 。
②将浊液加热到80℃,_______ 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式_______ ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是_______ 。
(4)当离子浓度小于或等于1×10-5mol·L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c平(OH-)≥_______ 。[已知:Ksp(Cr(OH)3)=6.3×10-31mol·L-1,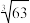 ≈4.0]
≈4.0]

已知部分物质沉淀的 pH 及 CaSO4 的溶解度曲线如下:
Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀 pH | 3.2 | 6.7 | a |

(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围
②将浊液加热到80℃,
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式
(4)当离子浓度小于或等于1×10-5mol·L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c平(OH-)≥
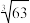 ≈4.0]
≈4.0]
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
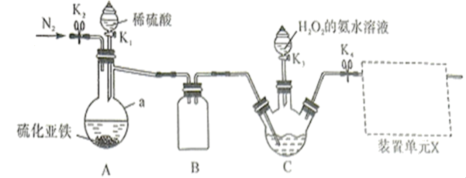
【推荐3】铼(Re)是具有重要军事战略意义的金属。NH4ReO4是制备高纯度Re的原料,实验室用Re2O7制备NH4ReO4的装置如图所示。
已知:I.Re2O7易溶于水,溶于水后生成HReO4;HReO4与H2S反应生成Re2S7。
有关物质的溶解度S见表:
II.2NH4ReO4 2NH3↑+H2O+Re2O7;
2NH3↑+H2O+Re2O7;
NH3+H3BO3=NH3•H3BO3;
NH3•H3BO3+HCl=NH4Cl+H3BO3。
回答下列问题:
(1)仪器a的名称是_______ 。
(2)NH4ReO4的制备
①反应开始前先向装置C中三颈烧瓶内加入一定量的_______ (填化学式)和H2O;
②关闭_______ ,打开______ ,装置C中三颈烧瓶内生成Re2S7;
③关闭K1,打开K2,通入N2一段时间,通入N2的目的是_______ ;
④关闭K2,打开K3,滴入足量H2O2的氨水溶液,生成NH4ReO4,反应的化学方程式为________ ;
⑤反应结束后,将C中溶液经______ 、______ 、过滤、乙醇洗涤、干燥,得到NH4ReO4晶体。
(3)下列装置可用作装置单元X的是_______ (填标号)。
(4)取wgNH4ReO4样品,在加热条件下使其分解,产生的氨气用硼酸(H3BO3)溶液吸收。吸收液用浓度为cmol/L的盐酸滴定,消耗盐酸VmL。NH4ReO4的纯度为_______ (已知:NH4ReO4的相对分子质量为268)。若加热温度过高,NH4ReO4分解产生N2,会导致NH4ReO4纯度测量值______ (填“偏大”“偏小”或“无影响”)。

已知:I.Re2O7易溶于水,溶于水后生成HReO4;HReO4与H2S反应生成Re2S7。
有关物质的溶解度S见表:
| 温度/℃ | S[(NH4)2SO4]/g | S(NH4ReO4)/g |
| 20 | 75.4 | 6.1 |
| 30 | 78.0 | 32.3 |
 2NH3↑+H2O+Re2O7;
2NH3↑+H2O+Re2O7;NH3+H3BO3=NH3•H3BO3;
NH3•H3BO3+HCl=NH4Cl+H3BO3。
回答下列问题:
(1)仪器a的名称是
(2)NH4ReO4的制备
①反应开始前先向装置C中三颈烧瓶内加入一定量的
②关闭
③关闭K1,打开K2,通入N2一段时间,通入N2的目的是
④关闭K2,打开K3,滴入足量H2O2的氨水溶液,生成NH4ReO4,反应的化学方程式为
⑤反应结束后,将C中溶液经
(3)下列装置可用作装置单元X的是
A. | B.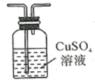 |
C.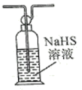 | D.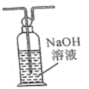 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:

请回答下列问题:
(1)若A为H2O(g),可以得到Fe3O4,写出H2O的电子式:________________ 。
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+生成Fe3+的离子方程式___________________ 。
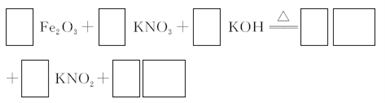
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共熔制得高铁酸钾的化学方程式,并配平:___________
(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00 mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1 00 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00 mL。
已知:2Fe3++2I-===2Fe2++I2 ;I2+2S2O ===2I-+S4O
===2I-+S4O 。
。
①写出滴定选用的指示剂________ ,滴定终点观察到的现象_______________________ 。
②溶液Ⅰ中铁元素的总含量为__________ g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会________ (填“偏高”“偏低”或“不变”)。

请回答下列问题:
(1)若A为H2O(g),可以得到Fe3O4,写出H2O的电子式:
(2)若B为NaClO3与稀硫酸,写出其氧化Fe2+生成Fe3+的离子方程式
(3)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共熔制得高铁酸钾的化学方程式,并配平:

(4)为测定溶液Ⅰ中铁元素的总含量,实验操作如下:准确量取20.00 mL溶液Ⅰ于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用0.1 00 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00 mL。
已知:2Fe3++2I-===2Fe2++I2 ;I2+2S2O
 ===2I-+S4O
===2I-+S4O 。
。①写出滴定选用的指示剂
②溶液Ⅰ中铁元素的总含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】水合肼是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl 据此,某学生设计了下列实验。
【制备NaClO溶液】

实验装置如图甲所示(部分夹持装置已省略)已知:3NaClO 2NaCl+NaClO3
2NaCl+NaClO3
(1)请写出肼的电子式_________________ 。
(2)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有________________ 。
(3)装置I中发生的化学反应方程式是____________________________ ;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的是______________________________ 。
【制取水合肼】
实验装置如图乙所示。
(4)仪器B的名称为_________ ;反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,请写出该反应的化学反应方程式__________ 。
(5)充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。若在蒸馏刚刚开始的时候忘记添加沸石,应该采取的操作是_____________________ 。
【测定肼的含量】
称取馏分0.2500g,加水配成20.00mL溶液,在一定条件下,以淀粉溶液做指示剂,用0.1500 mol·L-1的I2溶液滴定。
已知:N2H4·H2O+2I2==N2↑+4HI+H2O
①滴定终点时的现象为______________________________ 。
②实验测得消耗I2溶液的平均值为20.00 mL,馏分中N2H4.H2O的质量分数为______ 。
【制备NaClO溶液】

实验装置如图甲所示(部分夹持装置已省略)已知:3NaClO
 2NaCl+NaClO3
2NaCl+NaClO3(1)请写出肼的电子式
(2)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有
(3)装置I中发生的化学反应方程式是
【制取水合肼】
实验装置如图乙所示。
(4)仪器B的名称为
(5)充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。若在蒸馏刚刚开始的时候忘记添加沸石,应该采取的操作是
【测定肼的含量】
称取馏分0.2500g,加水配成20.00mL溶液,在一定条件下,以淀粉溶液做指示剂,用0.1500 mol·L-1的I2溶液滴定。
已知:N2H4·H2O+2I2==N2↑+4HI+H2O
①滴定终点时的现象为
②实验测得消耗I2溶液的平均值为20.00 mL,馏分中N2H4.H2O的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】碳酸钠在工业上有广泛的应用,碳酸氢钠是常用的发酵剂的主要成分。回答下列问题:
I.1861年比利时人索尔维以食盐、石灰石和氨为原料制得了碳酸钠,这种方法叫做氨碱法,也叫索尔维制碱法,其工艺流程如图所示。 时,反应的化学方程式为
时,反应的化学方程式为_______ 。
(2)操作III中发生反应的离子方程式为_______ 。
(3)废液中含有的两种主要溶质是_______ (填化学式)。
II.我国化学家侯德榜改革国外的纯碱生产工艺,将氨与纯碱的生产联合起来,称为联合制碱法,生产流程可简要表示为下图所示:_______ ,从母液中提取的副产品为_______ (填化学式)。
(5)为检验产品碳酸钠中是否含有少量的氯化钠杂质,可以采用以下方法:取少量试样溶于水中,_______ (写出操作、现象与结论)。
III.内蒙古高原天然碱湖主要分布在鄂尔多斯盆地北部、二连盆地中部、巴丹吉林沙漠和海拉尔盆地东南部。面积一般为数平方公里至数十平方公里,多被沙丘所环绕。
(6)从碱湖中提取的某物质化学组成为xNa2CO3・yNaHCO3・zH2O(x、y、z为互素的正整数),为了确定其成分,称取天然碱样品7.3g,充分加热后得到水的质量为0.9g,二氧化碳的质量为1.1g。该天然碱的化学式为_______ 。
I.1861年比利时人索尔维以食盐、石灰石和氨为原料制得了碳酸钠,这种方法叫做氨碱法,也叫索尔维制碱法,其工艺流程如图所示。

 时,反应的化学方程式为
时,反应的化学方程式为(2)操作III中发生反应的离子方程式为
(3)废液中含有的两种主要溶质是
II.我国化学家侯德榜改革国外的纯碱生产工艺,将氨与纯碱的生产联合起来,称为联合制碱法,生产流程可简要表示为下图所示:

(5)为检验产品碳酸钠中是否含有少量的氯化钠杂质,可以采用以下方法:取少量试样溶于水中,
III.内蒙古高原天然碱湖主要分布在鄂尔多斯盆地北部、二连盆地中部、巴丹吉林沙漠和海拉尔盆地东南部。面积一般为数平方公里至数十平方公里,多被沙丘所环绕。
(6)从碱湖中提取的某物质化学组成为xNa2CO3・yNaHCO3・zH2O(x、y、z为互素的正整数),为了确定其成分,称取天然碱样品7.3g,充分加热后得到水的质量为0.9g,二氧化碳的质量为1.1g。该天然碱的化学式为
您最近一年使用:0次



