已知A常温常压下为无色液体,A为气体时与R反应生成B和E,M、R是两种常见的金属,M是地壳中含量最多的金属元素的单质,T是淡黄色固体,B. C是无色无味的气体,E是具有磁性的黑色晶体,H是红褐色固体。
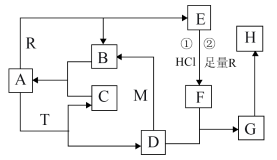
(1)物质T的化学式为___________ 。15.6g T与足量的A反应电子转移数为___________ 个(已知:阿伏伽德罗常数为NA)。
(2)D和M在溶液中反应生成B的离子反应方程式为___________ 。
(3)G在潮湿空气中转化为H的化学方程式为___________ 。
(4)T和F反应只生成C、H和一种盐,其离子反应方程式为_________ 。
(5)若向E和R的混合物中加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,放出448mL(标准状况)气体,向所得溶液中加入KSCN溶液,无血红色出现。若用足量的CO在高温下还原相同质量的上述混合物,得到的固体质量为___________ g。

(1)物质T的化学式为
(2)D和M在溶液中反应生成B的离子反应方程式为
(3)G在潮湿空气中转化为H的化学方程式为
(4)T和F反应只生成C、H和一种盐,其离子反应方程式为
(5)若向E和R的混合物中加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,放出448mL(标准状况)气体,向所得溶液中加入KSCN溶液,无血红色出现。若用足量的CO在高温下还原相同质量的上述混合物,得到的固体质量为
更新时间:2023-12-15 11:07:21
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】化肥厂所产生的废水中,氮元素多以NH 和NH3·H2O的形式存在,直接排入水体中,不仅会引起水体富营养化,还会对人群及生物产生毒害作用。工业上,常用NaNO2来处理含NH
和NH3·H2O的形式存在,直接排入水体中,不仅会引起水体富营养化,还会对人群及生物产生毒害作用。工业上,常用NaNO2来处理含NH 或NH3·H2O的废水,其流程如图所示:
或NH3·H2O的废水,其流程如图所示:
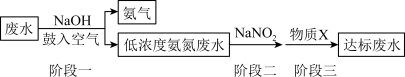
已知:二价硫可表示为S(II);NaNO2易被空气中的氧气氧化,其与稀硫酸反应会生成易分解的亚硝酸。
(1)NaNO2中N的化合价为_______ 价。
(2)NaNO2的外观、味道均与食盐相似,但具有剧毒,被严禁作为食盐食用。误食后,能将血液中的Fe(II)_______ (填“氧化”或“还原”)为Fe(III);服用维生素C能缓解NaNO2中毒,维生素C作_______ (填“氧化剂”或“还原剂”)。
(3)在“阶段一”中,加入NaOH的作用为_______ (用离子方程式表示);鼓入空气的目的是_______ 。
(4)“阶段二”中NH 与NaNO2反应生成无污染的物质,该反应的离子方程式为
与NaNO2反应生成无污染的物质,该反应的离子方程式为_______ 。
(5)某化学兴趣小组设计如下实验探究NaNO2溶液与KI溶液的反应,步骤及现象如下。
①2mL注射器,吸取1mL浓度均为0.2mol·L-1NaNO2和KI的混合溶液,针头朝上排出空气。
②吸入少量稀硫酸并迅速将针头插入橡皮塞,观察到有无色气泡产生,溶液变黑,黑色固体析出附着在壁上,轻轻摇动将黑色固体洗到溶液中。
③摘去橡皮塞,轻轻拉动注射器活塞,吸入少量空气,观察到无色气体变成红棕色。
④将注射器中少量溶液挤入淀粉溶液中,观察到淀粉溶液变为蓝色。
步骤①中排出空气的目的是_______ ;步骤③中红棕色气体的化学式为_______ ;实验中NaNO2溶液与KI溶液发生反应的离子方程式为_______ 。
 和NH3·H2O的形式存在,直接排入水体中,不仅会引起水体富营养化,还会对人群及生物产生毒害作用。工业上,常用NaNO2来处理含NH
和NH3·H2O的形式存在,直接排入水体中,不仅会引起水体富营养化,还会对人群及生物产生毒害作用。工业上,常用NaNO2来处理含NH 或NH3·H2O的废水,其流程如图所示:
或NH3·H2O的废水,其流程如图所示:
已知:二价硫可表示为S(II);NaNO2易被空气中的氧气氧化,其与稀硫酸反应会生成易分解的亚硝酸。
(1)NaNO2中N的化合价为
(2)NaNO2的外观、味道均与食盐相似,但具有剧毒,被严禁作为食盐食用。误食后,能将血液中的Fe(II)
(3)在“阶段一”中,加入NaOH的作用为
(4)“阶段二”中NH
 与NaNO2反应生成无污染的物质,该反应的离子方程式为
与NaNO2反应生成无污染的物质,该反应的离子方程式为(5)某化学兴趣小组设计如下实验探究NaNO2溶液与KI溶液的反应,步骤及现象如下。
①2mL注射器,吸取1mL浓度均为0.2mol·L-1NaNO2和KI的混合溶液,针头朝上排出空气。
②吸入少量稀硫酸并迅速将针头插入橡皮塞,观察到有无色气泡产生,溶液变黑,黑色固体析出附着在壁上,轻轻摇动将黑色固体洗到溶液中。
③摘去橡皮塞,轻轻拉动注射器活塞,吸入少量空气,观察到无色气体变成红棕色。
④将注射器中少量溶液挤入淀粉溶液中,观察到淀粉溶液变为蓝色。
步骤①中排出空气的目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】氯元素可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,并比较其氧化性。
已知:氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO 和Cl-
和Cl-

回答下列问题:
(1)甲中盛放浓盐酸的仪器名称是___________ ,甲中发生的反应的化学方程式是___________ ;
(2)乙中的试剂为___________ ;
(3)丙中发生反应的化学方程式是___________ ;
(4)丁采用冰水浴冷却的目的是___________ ;
(5)戊的作用是尾气吸收,可选用试剂 ___________(填字母)。
(6)反应结束后,取出丙中试管,经冷却结晶、___________ 、洗涤、干燥,得到KClO3晶体。
(7)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显紫色。可知该条件下KClO3的氧化能力___________ NaClO(填“大于”或“小于”)。
已知:氯气与碱溶液反应,在低温和稀碱溶液中主要产物是ClO-和Cl-,在75℃以上和浓碱溶液中主要产物是ClO
 和Cl-
和Cl-
回答下列问题:
(1)甲中盛放浓盐酸的仪器名称是
(2)乙中的试剂为
(3)丙中发生反应的化学方程式是
(4)丁采用冰水浴冷却的目的是
(5)戊的作用是尾气吸收,可选用试剂 ___________(填字母)。
| A.H2SO4 | B.NaOH | C.NaCl | D.Ca(OH)2 |
(6)反应结束后,取出丙中试管,经冷却结晶、
(7)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显紫色。可知该条件下KClO3的氧化能力
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】某含砷(As)的有毒工业废水经下图流醒转化为粗As2O3,已知:亚砷酸钙微溶于水,砷酸钙难溶于水。

(1)砷是氮的同族元素,且比氮多2个电子层,则AsH3的电子式为_____ 。
(2)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的离子方程式为_____ 。
(3)加入试剂1的目的是_____ 。
(4)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
A.Ca(OH)2(s)⇌Ca2+(aq)+2OH﹣(aq)△H<0
B.5Ca2++OH﹣+3AsO43﹣⇌Ca5(AsO4)3OH△H>0
资料表明:“沉砷”的最佳温度是85℃,温度高于85℃,随温度升高沉淀率下降,从平衡移动角度分析其原因是_____ 。

(1)砷是氮的同族元素,且比氮多2个电子层,则AsH3的电子式为
(2)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的离子方程式为
(3)加入试剂1的目的是
(4)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
A.Ca(OH)2(s)⇌Ca2+(aq)+2OH﹣(aq)△H<0
B.5Ca2++OH﹣+3AsO43﹣⇌Ca5(AsO4)3OH△H>0
资料表明:“沉砷”的最佳温度是85℃,温度高于85℃,随温度升高沉淀率下降,从平衡移动角度分析其原因是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】下图中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色实验均为黄色。

(1)写出下列物质的化学式:B________ ;E___________ 。
(2)以上6个反应中属于氧化还原反应的有________ (填写编号)。
(3)写出B→C反应的离子方程式:________________________________________ ;
C→E的化学方程式:____________________________________________ ;
E→D的化学方程式:___________________________________________ ;
(4)加热5.00 g D和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31 g,则原混合物中D的质量为_________ 。

(1)写出下列物质的化学式:B
(2)以上6个反应中属于氧化还原反应的有
(3)写出B→C反应的离子方程式:
C→E的化学方程式:
E→D的化学方程式:
(4)加热5.00 g D和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31 g,则原混合物中D的质量为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体M。

(1)写出下列物质的化学式:A:______ ,D_________ 。
(2)按要求写出下列反应方程式:
①H在潮湿空气中变成M的过程中的化学方程式:_______ 。
②Q+B→N的离子方程式:________ 。
(3)检验W中金属阳离子的一种试剂,能使溶液产生血红色现象,试剂名称为:______ 。

(1)写出下列物质的化学式:A:
(2)按要求写出下列反应方程式:
①H在潮湿空气中变成M的过程中的化学方程式:
②Q+B→N的离子方程式:
(3)检验W中金属阳离子的一种试剂,能使溶液产生血红色现象,试剂名称为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】铁是日常生活中最常见的金属,某班同学在学习铁的知识时,有下列问题:
问题1:铁为何称为黑色金属?
问题2:CuO在高温下可分解为Cu2O和O2,Fe2O3在高温下可分解为FeO和O2吗?
I.对于问题1,同学们上网查找后,认为在铁表面往往有黑色的铁的氧化物,所以叫黑色金属。
(1)某同学设计了下图装置测定a克样品中铁的百分含量(混有铁的氧化物杂质),则在分液漏斗中滴入的试剂可以是_______ ;导管A的作用①使液体顺利滴下;②_______ ;
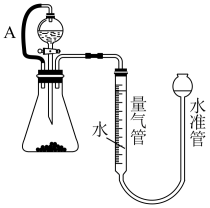
(2)实验结束后,量气管中收集气体体积为VmL(以换算为标准状况下),则样品中铁的质量分数为_____ (用字母表示,无需化简);若读数时水准管的液面高于量气管,则会造成实验结果______ (填“偏大”、“偏小”或无影响)
II.对于问题2,同学们准备实验探究,他们设想了两种方法:
A.将氧化铁高温灼烧,看灼烧前后颜色是否变化
B.将氧化铁高温灼烧,看灼烧前后质量是否变化
(3)实验中应将Fe2O3放在_______ (填仪器名称)中灼烧。
(4)方法A中,如果高温灼烧后颜色由_______ 变为_______ ,说明Fe2O3确实发生了变化。能说明生成的一定为FeO吗?_______ (填“能”或“不能”),理由是_______ 。
(5)方法B中,如果发生了预期的反应,固体高温灼烧前后质量比应为_______ 。但是,实验结果是固体灼烧前后质量比为30:29,则高温灼烧后生成物是_______ 。
问题1:铁为何称为黑色金属?
问题2:CuO在高温下可分解为Cu2O和O2,Fe2O3在高温下可分解为FeO和O2吗?
I.对于问题1,同学们上网查找后,认为在铁表面往往有黑色的铁的氧化物,所以叫黑色金属。
(1)某同学设计了下图装置测定a克样品中铁的百分含量(混有铁的氧化物杂质),则在分液漏斗中滴入的试剂可以是

(2)实验结束后,量气管中收集气体体积为VmL(以换算为标准状况下),则样品中铁的质量分数为
II.对于问题2,同学们准备实验探究,他们设想了两种方法:
A.将氧化铁高温灼烧,看灼烧前后颜色是否变化
B.将氧化铁高温灼烧,看灼烧前后质量是否变化
(3)实验中应将Fe2O3放在
(4)方法A中,如果高温灼烧后颜色由
(5)方法B中,如果发生了预期的反应,固体高温灼烧前后质量比应为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】实验室用下图装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
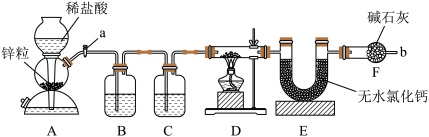
(1)为了安全,在点燃D处的酒精灯之前,在b处必须________________ 。
(2)装置B的作用是_______________ ,装置C中盛装的液体是________________ 。
(3)在硬质双通玻璃管中发生的化学反应方程式是________________________________ 、__________________________ 。
(4)若为FeO和Fe2O3物质的量之比1∶1的固体混合物,反应完全后,U形管的质量增加7.2 g,则混合物中Fe2O3的质量为______________ 。
(5)U形管E右边连接干燥管F的目的是________________ ,若无干燥管F,测得Fe2O3的质量将_____________ (填“偏大”“偏小”或“无影响”)。
(6)铁的化合物的固体或溶液中常常混有需要除去的杂质,试对下列物质(括号内为杂质),使用合适的试剂或分离方法除杂。
①Fe2O3[Fe(OH)3]___________________________________ ;
②FeCl3溶液(FeCl2)___________________________________ ;
③FeCl2溶液(FeCl3)___________________ 。

(1)为了安全,在点燃D处的酒精灯之前,在b处必须
(2)装置B的作用是
(3)在硬质双通玻璃管中发生的化学反应方程式是
(4)若为FeO和Fe2O3物质的量之比1∶1的固体混合物,反应完全后,U形管的质量增加7.2 g,则混合物中Fe2O3的质量为
(5)U形管E右边连接干燥管F的目的是
(6)铁的化合物的固体或溶液中常常混有需要除去的杂质,试对下列物质(括号内为杂质),使用合适的试剂或分离方法除杂。
①Fe2O3[Fe(OH)3]
②FeCl3溶液(FeCl2)
③FeCl2溶液(FeCl3)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】实验室用下面装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。

(1)如何检查装置A的气密性?
__________
(2)装置A发生的反应有时要向其中加入少量CuSO4溶液,以加快反应速率。
(2)为了安全,在点燃D处的酒精灯之前,在b出口处必须____________________ 。
(3)装置B的作用是______________________________ ;装置C中装的液体是__________ 。
(4)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生反应的化学方程式是________________________________________________ 。
(5)若FeO和Fe2O3固体混合物的质量为23.2 g,反应完全后U形管的质量增加7.2 g,则混合物中Fe2O3的质量为________ g。
(6)U形管E右边又连接干燥管F的目的是_____________________________________ ,若无干燥管F,测得Fe2O3的质量将__________ (填“偏大”、“偏小”或“无影响”)。

(1)如何检查装置A的气密性?
(2)装置A发生的反应有时要向其中加入少量CuSO4溶液,以加快反应速率。
(2)为了安全,在点燃D处的酒精灯之前,在b出口处必须
(3)装置B的作用是
(4)在气密性完好,并且进行了必要的安全操作后,点燃D处的酒精灯,在硬质双通玻璃管中发生反应的化学方程式是
(5)若FeO和Fe2O3固体混合物的质量为23.2 g,反应完全后U形管的质量增加7.2 g,则混合物中Fe2O3的质量为
(6)U形管E右边又连接干燥管F的目的是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】常温下D、E、F、I、J为气体,H、I、J都为氧化物;C的焰色反应为黄色;M为红褐色的固体,由G分解得到的H、I、J三者的物质的量相等.下图表示各物质之间的转化关系.
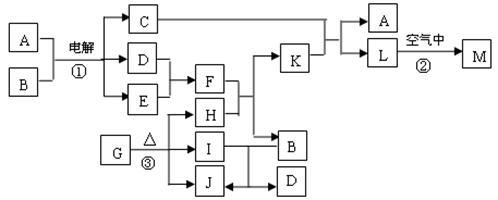
试回答下列问题:
(1)写出L的化学式____________ .
(2)基于反应①原理的化学工业称为______________ .
写出该反应①的离子方程式__________________________________________ .
(3)反应②的现象是__________________________________________ .
(4)写出H与Al在高温下反应的化学方程式___________________________________ .
(5)写出反应③的化学方程式___________________________________ .

试回答下列问题:
(1)写出L的化学式
(2)基于反应①原理的化学工业称为
写出该反应①的离子方程式
(3)反应②的现象是
(4)写出H与Al在高温下反应的化学方程式
(5)写出反应③的化学方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】已知A是一种红棕色金属氧化物,B、D是金属单质,C是两性金属氧化物,J是一种难溶于水的白色化合物,受热后容易发生分解。
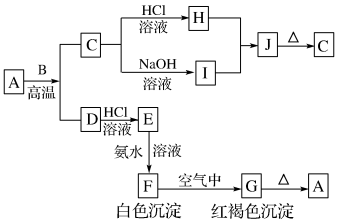
(1)写出下列物质的化学式:J_______ 。
(2)按要求写方程式:
①A+B→C+D的化学方程式:_______
②F→G的化学方程式:_______
③C→I的离子方程式:_______
④B与NaOH溶液反应的离子方程式:_______
(3)同温同压下,相同质量的金属B和D分别与足量的盐酸反应,所生成的气体体积比为_______ 。

(1)写出下列物质的化学式:J
(2)按要求写方程式:
①A+B→C+D的化学方程式:
②F→G的化学方程式:
③C→I的离子方程式:
④B与NaOH溶液反应的离子方程式:
(3)同温同压下,相同质量的金属B和D分别与足量的盐酸反应,所生成的气体体积比为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】I.Na2CO3和NaHCO3是厨房中常见的两种盐。回答下列问题:
(1)与酸反应的差异进行鉴别。甲组进行了如图4组实验。

其中实验_____ 和_____ (填实验序号)可以鉴别Na2CO3和NaHCO3。
(2)利用如图实验比较碳酸钠和碳酸氢钠的热稳定性,则物质甲的化学式为_____ 。
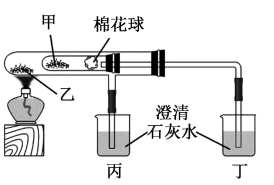
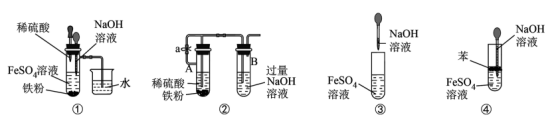
Ⅱ.如图所示,此装置可用来制备Fe(OH)2并验证其还原性,填写下列空白:
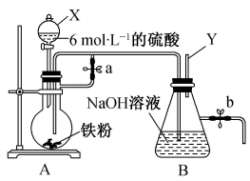
(3)制备Fe(OH)2:
仪器X的名称为______ ,实验开始时先将止水夹“a”打开,滴入H2SO4和铁粉反应。一段时间后关闭止水夹a,使A中溶液流入B中进行反应。在关闭止水夹a之前进行的实验步骤是_____ 。
(4)验证Fe(OH)2还原性:
实验完毕,打开b处止水夹,充入一部分空气,此时B瓶中发生的反应为(写化学方程式)_____ ,现象:_____ 。
(5)下列各图中制备的Fe(OH)2,能较长时间维持白色沉淀的是_____ (填序号)。
(1)与酸反应的差异进行鉴别。甲组进行了如图4组实验。

其中实验
(2)利用如图实验比较碳酸钠和碳酸氢钠的热稳定性,则物质甲的化学式为

Ⅱ.如图所示,此装置可用来制备Fe(OH)2并验证其还原性,填写下列空白:

(3)制备Fe(OH)2:
仪器X的名称为
(4)验证Fe(OH)2还原性:
实验完毕,打开b处止水夹,充入一部分空气,此时B瓶中发生的反应为(写化学方程式)
(5)下列各图中制备的Fe(OH)2,能较长时间维持白色沉淀的是

您最近一年使用:0次




