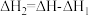下列说法正确的是
| A.升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 |
| B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大 |
| C.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 |
| D.催化剂不影响反应活化能但能增大单位体积内活化分子百分数,从而增大反应速率 |
更新时间:2024-01-10 21:16:10
|
相似题推荐
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】等质量的锌与过量盐酸在不同的实验条件下进行反应,实验数据如表所示。收集相同条件下相同体积的氢气,所需时间最短的一组是
组别 | A | B | C | D |
盐酸浓度/(mol/L) | 2.0 | 2.5 | 2.5 | 2.5 |
温度/℃ | 25 | 30 | 50 | 50 |
锌的状态 | 块状 | 粉末 | 块状 | 粉末 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】在体积一定的密闭容器中1molN2和3molH2发生反应:N2+3H2 2NH3。下列有关说法正确的是( )
2NH3。下列有关说法正确的是( )
 2NH3。下列有关说法正确的是( )
2NH3。下列有关说法正确的是( )| A.降低温度可以加快反应速率 |
| B.向容器中再加入N2可以加快反应速率 |
| C.达到化学反应限度时,生成2molNH3 |
| D.达到化学平衡时N2、H2、NH3的物质的量之比为1:3:2 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐3】下列有关叙述正确的是( )
| A.不需要加热就能发生的反应一定是放热反应 |
| B.根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 |
| C.Na2O2溶于水生成了NaOH,其水溶液才能导电,故Na2O2不是电解质 |
| D.升高温度,可同时提高活化分子百分数和活化分子浓度,使化学反应速率加快 |
您最近一年使用:0次
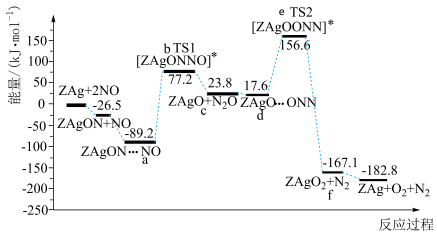
【推荐1】氮氧化物( )是大气的主要污染物,某研究小组利用催化剂
)是大气的主要污染物,某研究小组利用催化剂 对
对 催化转化的反应过程与能量变化的关系如图所示,下列说法正确的是
催化转化的反应过程与能量变化的关系如图所示,下列说法正确的是
 )是大气的主要污染物,某研究小组利用催化剂
)是大气的主要污染物,某研究小组利用催化剂 对
对 催化转化的反应过程与能量变化的关系如图所示,下列说法正确的是
催化转化的反应过程与能量变化的关系如图所示,下列说法正确的是
A.总反应的热化学方程式: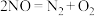 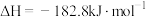 |
B.过渡态的稳定性: |
| C.反应过程的决速步骤为放热反应 |
D.催化剂 降低了反应的活化能,但不能改变反应热 降低了反应的活化能,但不能改变反应热 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】仅改变下列一个条件,通过提高活化分子的百分率来提高反应速率的是
| A.加热 | B.加压 | C.减少生成物浓度 | D.加大反应物浓度 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】甲醇和水蒸气在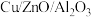 催化剂下发生重整制氢反应:
催化剂下发生重整制氢反应: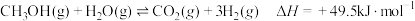 。下列说法正确的是
。下列说法正确的是
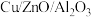 催化剂下发生重整制氢反应:
催化剂下发生重整制氢反应: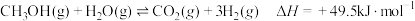 。下列说法正确的是
。下列说法正确的是| A.正反应的活化能比逆反应的活化能低 |
| B.恒压条件下充入Ne,有利于提高甲醇平衡转化率 |
| C.催化剂利于平衡正向移动,使其平衡常数增大 |
| D.当混合体系密度恒定时,反应达到平衡状态 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列关于化学反应速率的说法正确的是
A. 的反应速率一定比 的反应速率一定比 的反应速率大 的反应速率大 |
| B.其他条件不变,增大压强,化学反应速率越快 |
| C.使用催化剂可改变反应速率是因为提高了反应活化能 |
| D.升高温度能使化学反应速率增大,主要原因是增大了反应物分子中活化分子百分数 |
您最近一年使用:0次

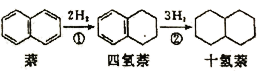 ,该过程中能量变化如图所示,下列说法正确的是
,该过程中能量变化如图所示,下列说法正确的是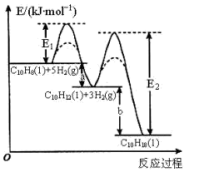
 )的一氯代物有3种
)的一氯代物有3种 、
、
 四氢萘
四氢萘 与
与 能发生反应:
能发生反应:
 。
。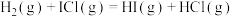

 、
、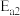 ,且
,且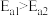
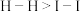 ,可推知键能:
,可推知键能: