已知无水FeCl3在空气中易潮解,加热易升华。实验室利用如图所示实验装置制取无水FeCl3(加热和夹持装置略去)。
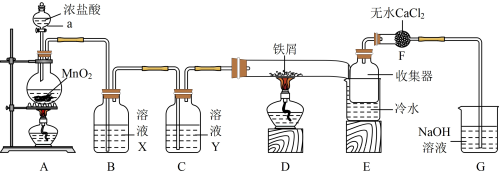
回答下列问题:
(1)装置A发生反应的化学方程式为___________ ,该反应氧化剂还原剂个数比___________ ,电子转移的总数为___________ 。
(2)装置D发生反应的化学方程式为___________ 。
(3)实验结束时,应先熄灭___________ (填“A”或“D”)处酒精灯;E中冷水的作用是___________ 。
(4)装置F的作用是___________ ;装置G发生反应的离子方程式___________ 。

回答下列问题:
(1)装置A发生反应的化学方程式为
(2)装置D发生反应的化学方程式为
(3)实验结束时,应先熄灭
(4)装置F的作用是
更新时间:2024-01-11 08:16:25
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】从化合价的角度认识氯的化合物。
(1)ClO2是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理如下:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl
①该反应中,氧化剂是__________ ,氧化产物是_________ ,氧化剂和还原剂的物质的量之比为__________ ,依据氧化还原反应规律判断,氧化性强弱为NaClO3____ Cl2(填>、<或=)。
②ClO2在杀菌消毒过程中会产生副产物亚氯酸盐( ),需将其转化为Cl-除去,下列试剂中,可将ClO2-转化为Cl-的是
),需将其转化为Cl-除去,下列试剂中,可将ClO2-转化为Cl-的是____________ (填字母序号)。
a.FeSO4 b.O3 c.KMnO4 d.SO2
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。Mathieson方法制备亚氯酸钠的流程如下:
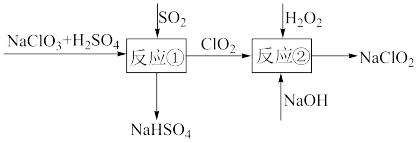
请将流程中发生的两个反应的离子方程式中所缺的物质补充完整:
反应① □ClO3-+□SO2=□ +□
+□________
反应② □ ClO2+□H2O2+□________ =□ +□O2↑+□
+□O2↑+□________
(1)ClO2是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理如下:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl
①该反应中,氧化剂是
②ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(
 ),需将其转化为Cl-除去,下列试剂中,可将ClO2-转化为Cl-的是
),需将其转化为Cl-除去,下列试剂中,可将ClO2-转化为Cl-的是a.FeSO4 b.O3 c.KMnO4 d.SO2
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。Mathieson方法制备亚氯酸钠的流程如下:

请将流程中发生的两个反应的离子方程式中所缺的物质补充完整:
反应① □ClO3-+□SO2=□
 +□
+□反应② □ ClO2+□H2O2+□
 +□O2↑+□
+□O2↑+□
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】金属钨用途极其广泛,可用于制造灯丝、超硬模具和光学仪器等。工业上常以白钨矿(主要成分是 、含有
、含有 、
、 等杂质)为原料制取
等杂质)为原料制取 ,进一步制取
,进一步制取 。工艺流程如图:
。工艺流程如图:
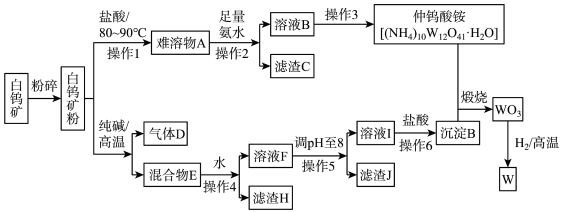
已知:钨酸酸性弱,难溶于水; 、
、 完全沉淀的
完全沉淀的 分别为8、5。
分别为8、5。
回答下列有关问题:
(1)白钨矿粉与盐酸反应过程中,需要不断地搅拌,其原因为___________ 。
(2)滤渣C的成分为___________ (填化学式),主要用途是用来制备___________ 。
(3)“操作3"的具体方法为___________ 、___________ 、过滤、洗涤、干燥;写出从溶液B到仲钨酸铵的反应的化学方程式:___________ 。
(4)写出白钨矿与纯碱反应的主要化学方程式:___________ 。
(5)溶液F调 为8的目的是
为8的目的是___________ 。
(6)黑钨矿也是获取钨的一个重要来源,其主要成分是铁和锰的钨酸盐,化学式常写成 和
和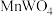 。写出黑钨矿中
。写出黑钨矿中 与纯碱、空气高温熔融生成
与纯碱、空气高温熔融生成 时的反应的化学方程式:
时的反应的化学方程式:___________ 。
 、含有
、含有 、
、 等杂质)为原料制取
等杂质)为原料制取 ,进一步制取
,进一步制取 。工艺流程如图:
。工艺流程如图:
已知:钨酸酸性弱,难溶于水;
 、
、 完全沉淀的
完全沉淀的 分别为8、5。
分别为8、5。回答下列有关问题:
(1)白钨矿粉与盐酸反应过程中,需要不断地搅拌,其原因为
(2)滤渣C的成分为
(3)“操作3"的具体方法为
(4)写出白钨矿与纯碱反应的主要化学方程式:
(5)溶液F调
 为8的目的是
为8的目的是(6)黑钨矿也是获取钨的一个重要来源,其主要成分是铁和锰的钨酸盐,化学式常写成
 和
和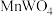 。写出黑钨矿中
。写出黑钨矿中 与纯碱、空气高温熔融生成
与纯碱、空气高温熔融生成 时的反应的化学方程式:
时的反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】 是重要的化工原料。如图为实验室中制取粗
是重要的化工原料。如图为实验室中制取粗 产品的装置,夹持装置略去。
产品的装置,夹持装置略去。
经查阅资料知:红磷与少量 反应生成
反应生成 ,与过量
,与过量 反应生成
反应生成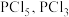 遇水会强烈水解生成
遇水会强烈水解生成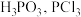 遇
遇 会生成
会生成 的熔沸点见上表。
的熔沸点见上表。
回答下列问题:
(1)仪器F的名称是___________ ,装置G中反应的化学方程式为___________ 。
(2)实验时,检查装置气密性后,先打开 通入
通入 一段时间,再迅速加入红磷。通入
一段时间,再迅速加入红磷。通入 的作用是
的作用是___________ 。
(3)装置C中的反应需要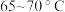 ,温度不宜过高和过低的原因是
,温度不宜过高和过低的原因是___________ ,最适合的加热方式为___________ (填“水浴”或“油浴”)加热。
(4)制得的 粗产品中常含有
粗产品中常含有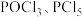 等。加入红磷加热除去
等。加入红磷加热除去 后,通过
后,通过___________ (填实验操作名称),即可得到较纯净的 。
。
(5)通过实验测定粗产品中 的质量分数,实验步骤如下(不考虑杂质的反应):
的质量分数,实验步骤如下(不考虑杂质的反应):
第一步:迅速移取 粗产品,加水完全水解;
粗产品,加水完全水解;
第二步:配成 溶液,移取
溶液,移取 溶液置于锥形瓶中;
溶液置于锥形瓶中;
第三步:加入 碘溶液
碘溶液 ,反应完全;
,反应完全;
第四步:加入几滴淀粉溶液,用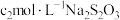 标准溶液滴定,消耗
标准溶液滴定,消耗 标准溶液
标准溶液 。
。
判断滴定达到终点时的现象是___________ ,粗产品中 的质量分数表达式为
的质量分数表达式为___________ 。(已知:①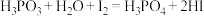 ;②
;② )
)
 是重要的化工原料。如图为实验室中制取粗
是重要的化工原料。如图为实验室中制取粗 产品的装置,夹持装置略去。
产品的装置,夹持装置略去。
| 物质 | 熔点 | 沸点 |
 |  | 75.5 |
 | 2 | 105.3 |
 反应生成
反应生成 ,与过量
,与过量 反应生成
反应生成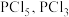 遇水会强烈水解生成
遇水会强烈水解生成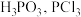 遇
遇 会生成
会生成 的熔沸点见上表。
的熔沸点见上表。回答下列问题:
(1)仪器F的名称是
(2)实验时,检查装置气密性后,先打开
 通入
通入 一段时间,再迅速加入红磷。通入
一段时间,再迅速加入红磷。通入 的作用是
的作用是(3)装置C中的反应需要
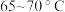 ,温度不宜过高和过低的原因是
,温度不宜过高和过低的原因是(4)制得的
 粗产品中常含有
粗产品中常含有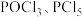 等。加入红磷加热除去
等。加入红磷加热除去 后,通过
后,通过 。
。(5)通过实验测定粗产品中
 的质量分数,实验步骤如下(不考虑杂质的反应):
的质量分数,实验步骤如下(不考虑杂质的反应):第一步:迅速移取
 粗产品,加水完全水解;
粗产品,加水完全水解;第二步:配成
 溶液,移取
溶液,移取 溶液置于锥形瓶中;
溶液置于锥形瓶中;第三步:加入
 碘溶液
碘溶液 ,反应完全;
,反应完全;第四步:加入几滴淀粉溶液,用
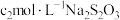 标准溶液滴定,消耗
标准溶液滴定,消耗 标准溶液
标准溶液 。
。判断滴定达到终点时的现象是
 的质量分数表达式为
的质量分数表达式为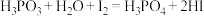 ;②
;② )
)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】氯化铁常用于污水处理等。该化合物是棕红色固体,易潮解,100℃时易升华。实验室可用氯气与金属铁反应制备无水氯化铁,实验装置如下图所示。
(1)写出装置Ⅰ中发生反应的离子方程式___________ 。
(2)装置Ⅱ的作用是___________ 。装置Ⅳ的作用是___________ 。
(3)装置Ⅲ中盛放的试剂为___________ 。
(4)装置Ⅵ中发生反应的离子方程式为___________ 。
(5)装置Ⅴ和装置Ⅵ的位置___________ (填“能”或“不能”)颠倒,原因___________ 。

(1)写出装置Ⅰ中发生反应的离子方程式
(2)装置Ⅱ的作用是
(3)装置Ⅲ中盛放的试剂为
(4)装置Ⅵ中发生反应的离子方程式为
(5)装置Ⅴ和装置Ⅵ的位置
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
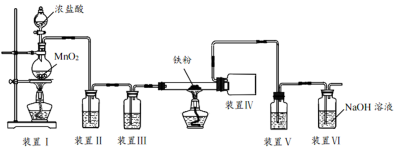
【推荐2】钛在医疗领域的使用非常广泛,如制人造关节、头盖、主动心瓣等。TiCl4是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备TiCl4(夹持装置略去)。
已知:HCl与TiO2不发生反应;装置 中除生成TiCl4外,同时还生成一种有毒气态氧化物和少量CCl4。其它相关信息如下表所示:
中除生成TiCl4外,同时还生成一种有毒气态氧化物和少量CCl4。其它相关信息如下表所示:
请回答下列问题:
(1)装置A中导管a的作用为_______ ,装置B中所盛试剂为_______ ,装置A中发生反应的离子方程式为_______ (反应后Mn元素以Mn2+形式存在)。
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性
d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:____→____→b→____→____→____,____ 。
(3)下列说法不正确 的是_______ 。
A.通入氯气之前,最好先从k处通入氮气,否则实验会失败
B.石棉绒载体是为了增大气体与TiO2、碳粉的接触面积,以加快反应速率
C.装置D中的烧杯中可加入冰水,便于收集到纯的液态TiCl4
D.装置E可防止空气中的水蒸气进入装置D的圆底烧瓶中使TiCl4变质
E.该装置有缺陷,通过装置E后的气体不可直接排放到空气中
(4)TiCl4可制备纳米TiO2:以N2为载体,用TiCl4和水蒸气反应生成Ti(OH)4。再控制温度生成纳米 。测定产物
。测定产物 组成的方法如下:
组成的方法如下:
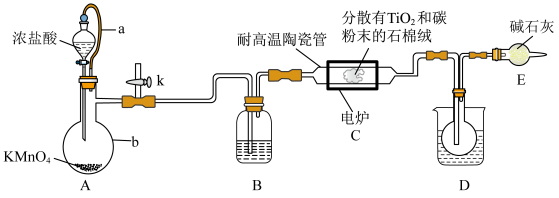
步骤一:取样品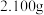 用稀硫酸充分溶解得到
用稀硫酸充分溶解得到 ,再用足量铝将
,再用足量铝将 还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入
还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入 容量瓶,定容得到待测液。
容量瓶,定容得到待测液。
步骤二:取待测液 于锥形瓶中,加几滴KSCN溶液作指示剂,用
于锥形瓶中,加几滴KSCN溶液作指示剂,用 的
的 标准溶液滴定,将Ti3+氧化为
标准溶液滴定,将Ti3+氧化为 ,三次滴定消耗标准溶液的平均值为
,三次滴定消耗标准溶液的平均值为 。
。
①滴定终点的判断方法是_______ 。
②通过分析、计算,该样品的组成为_______ 。

已知:HCl与TiO2不发生反应;装置
 中除生成TiCl4外,同时还生成一种有毒气态氧化物和少量CCl4。其它相关信息如下表所示:
中除生成TiCl4外,同时还生成一种有毒气态氧化物和少量CCl4。其它相关信息如下表所示:| 熔点/℃ | 沸点/℃ | 密度/(g∙cm-3) | 水溶性 | |
| TiCl4 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
| CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
(1)装置A中导管a的作用为
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞 c.检查装置气密性
d.关闭分液漏斗活塞 e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项选择合适操作(不重复使用)并排序:____→____→b→____→____→____,
(3)下列说法
A.通入氯气之前,最好先从k处通入氮气,否则实验会失败
B.石棉绒载体是为了增大气体与TiO2、碳粉的接触面积,以加快反应速率
C.装置D中的烧杯中可加入冰水,便于收集到纯的液态TiCl4
D.装置E可防止空气中的水蒸气进入装置D的圆底烧瓶中使TiCl4变质
E.该装置有缺陷,通过装置E后的气体不可直接排放到空气中
(4)TiCl4可制备纳米TiO2:以N2为载体,用TiCl4和水蒸气反应生成Ti(OH)4。再控制温度生成纳米
 。测定产物
。测定产物 组成的方法如下:
组成的方法如下:步骤一:取样品
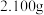 用稀硫酸充分溶解得到
用稀硫酸充分溶解得到 ,再用足量铝将
,再用足量铝将 还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入
还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入 容量瓶,定容得到待测液。
容量瓶,定容得到待测液。步骤二:取待测液
 于锥形瓶中,加几滴KSCN溶液作指示剂,用
于锥形瓶中,加几滴KSCN溶液作指示剂,用 的
的 标准溶液滴定,将Ti3+氧化为
标准溶液滴定,将Ti3+氧化为 ,三次滴定消耗标准溶液的平均值为
,三次滴定消耗标准溶液的平均值为 。
。①滴定终点的判断方法是
②通过分析、计算,该样品的组成为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
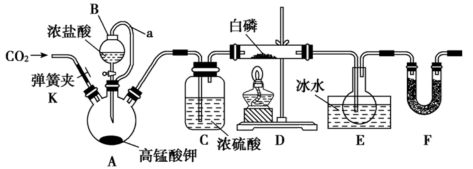
【推荐3】PCl3是一种重要的化工原料,实验室用如图装置制取PCl3。已知PCl3的熔点为-112℃,沸点为75.5℃,极易水解,受热易被氧气氧化。
请回答下列问题:
(1)A中反应的离子方程式为___________________________ ;B仪器的名称是__________ 。
(2)实验开始前的操作依次是:①组装仪器,②__________ ,③加药品,④打开K通一段时间的CO2,然后关闭K,⑤最后点燃酒精灯。
(3)导管a的作用为______________________________ ;装置F中的药品是___________ ,装置F的作用是________________________________________ 。
(4)测定产品纯度,步骤如下:
I.称取5.00 g产品,溶于水配成100 mL溶液(发生反应:PCl3+3H2O=H3PO3+3HCl);
II.取上述溶液25.00 mL,加入20.00 mL 0.4000 mol·L-1碘水,充分氧化H3PO3的化学方程式为__________________________________________________ ;
III.以淀粉溶液为指示剂,用0.5000 mol·L-1 Na2S2O3溶液滴定II中所得溶液,发生的反应为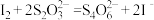 ,消耗Na2S2O3溶液12.00 mL。
,消耗Na2S2O3溶液12.00 mL。
①滴定终点时的颜色变化是__________ 。
②该产品的纯度为__________ 。

请回答下列问题:
(1)A中反应的离子方程式为
(2)实验开始前的操作依次是:①组装仪器,②
(3)导管a的作用为
(4)测定产品纯度,步骤如下:
I.称取5.00 g产品,溶于水配成100 mL溶液(发生反应:PCl3+3H2O=H3PO3+3HCl);
II.取上述溶液25.00 mL,加入20.00 mL 0.4000 mol·L-1碘水,充分氧化H3PO3的化学方程式为
III.以淀粉溶液为指示剂,用0.5000 mol·L-1 Na2S2O3溶液滴定II中所得溶液,发生的反应为
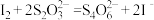 ,消耗Na2S2O3溶液12.00 mL。
,消耗Na2S2O3溶液12.00 mL。①滴定终点时的颜色变化是
②该产品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】四氯化锡(SnCl4)可用作媒染剂、有机合成中氯化的催化剂等。实验室制备四氯化锡所需的有关装置和信息如图:
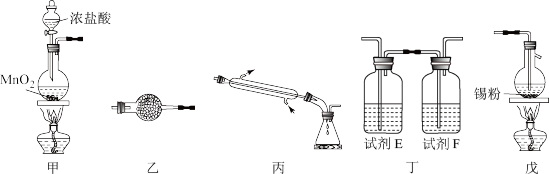
有关信息:
①将金属锡熔融,通入干燥氯气进行反应,生成四氯化锡;
②无水四氯化锡是无色易流动的液体,熔点-33℃,沸点114.1℃;
③四氯化锡易水解。
回答下列问题:
(1)装置甲中发生反应的离子方程式为___ ;装置戊中发生反应的化学方程式为___ 。
(2)试剂E和F分别是___ 、___ 。
(3)上述各装置的连接顺序是甲→___ (填装置标号),实验开始时点燃的酒精灯是___ (填“甲”或“戊”)。
(4)装置乙的作用是___ 。
(5)实验所得SnCl4中因溶解了Cl2而略显黄色,提纯SnCl4的方法是___ (填标号)。
A.用NaOH溶液洗涤 B.升华 C.重结晶 D.蒸馏 E.过滤 F.萃取
(6)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性,原因是___ (用化学方程式表示)。

有关信息:
①将金属锡熔融,通入干燥氯气进行反应,生成四氯化锡;
②无水四氯化锡是无色易流动的液体,熔点-33℃,沸点114.1℃;
③四氯化锡易水解。
回答下列问题:
(1)装置甲中发生反应的离子方程式为
(2)试剂E和F分别是
(3)上述各装置的连接顺序是甲→
(4)装置乙的作用是
(5)实验所得SnCl4中因溶解了Cl2而略显黄色,提纯SnCl4的方法是
A.用NaOH溶液洗涤 B.升华 C.重结晶 D.蒸馏 E.过滤 F.萃取
(6)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性,原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】硼镁泥是一种工业废料,主要成分是MgO( 占40%,还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2 等杂质,以此为原料制取的硫酸镁,可用于印染、选纸、医药等工业。从硼镁泥中提取MgSO4·7H2O 的流程如下:
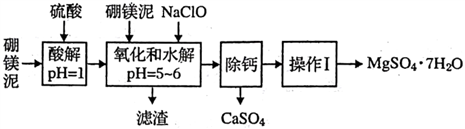
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸800mL,若用18.4mol/L的浓硫酸来配制,量取浓硫酸时,需使用的量筒的规格为______ 。
A.10mL B.20mL C.50mL D.100mL
(2)加入的NaClO可与Mn2+反应:Mn2+ +ClO-+H2O=MnO2 ↓+2H++Cl-,还有一种离子也会被NaClO 氧化,该反应的离子方程式为____________________ 。
(3)滤渣中除含有Fe(OH)3、A(OH)3 外还有_________________ 。
(4)在“除钙”前,需检验滤波中Fe3+是否被除尽,简述检验方法:_________ 。
(5)已知MeSO4、CaSO4的溶解度如下表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4 除去,根据上表数据,简要说明操作步骤:_________ 。“操作I:是将滤液继续蒸发浓缩,冷却结晶,______ ,便得到了MgSO4·7H2O。
(6)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O为172.2 g,则MgSO4·7H2O的产率为_____________________ 。

根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸800mL,若用18.4mol/L的浓硫酸来配制,量取浓硫酸时,需使用的量筒的规格为
A.10mL B.20mL C.50mL D.100mL
(2)加入的NaClO可与Mn2+反应:Mn2+ +ClO-+H2O=MnO2 ↓+2H++Cl-,还有一种离子也会被NaClO 氧化,该反应的离子方程式为
(3)滤渣中除含有Fe(OH)3、A(OH)3 外还有
(4)在“除钙”前,需检验滤波中Fe3+是否被除尽,简述检验方法:
(5)已知MeSO4、CaSO4的溶解度如下表:
| 温度/℃ | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4 除去,根据上表数据,简要说明操作步骤:
(6)实验中提供的硼镁泥共100g,得到的MgSO4·7H2O为172.2 g,则MgSO4·7H2O的产率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】化学在金属矿物的开发利用过程中具有重要的意义和作用.铝是一种重要的金属,如图是从铝土矿(主要成分是Al2O3,还含有少量Fe2O3、SiO2)中制备铝的工艺流程:
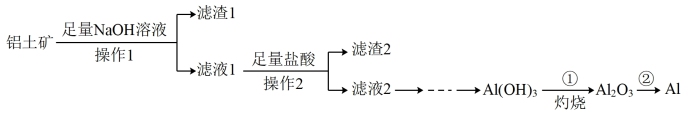
回答下列问题:
(1)铝原子的结构示意图为____ 。
(2)冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,请写出铝与MnO2在高温下反应的化学方程式:____ 。
(3)第①步灼烧,在实验室进行时需要用到下列仪器中的____ (填字母)。
(4)第②步用电解法冶炼Al,化学反应方程式为_____ 。
(5)滤渣1的成分为____ (填化学式),检验其中所含金属元素的化学方法是____ (写出实验操作步骤、现象和结论)。

回答下列问题:
(1)铝原子的结构示意图为
(2)冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,请写出铝与MnO2在高温下反应的化学方程式:
(3)第①步灼烧,在实验室进行时需要用到下列仪器中的
| A.蒸发皿 | B.烧杯 | C.酒精灯 | D.坩埚 |
(5)滤渣1的成分为
您最近一年使用:0次



