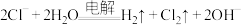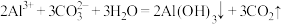下列关于化学反应速率、限度、方向的说法不正确的是
A. 的反应在任何温度下都能自发进行 的反应在任何温度下都能自发进行 |
| B.钠与水反应时,增加水的用量能明显提高化学反应速率 |
| C.升高温度,使反应物分子中活化分子百分数增大 |
| D.用碳酸钠溶液清洗油污时,加热可以增强去污效果 |
更新时间:2024-01-15 10:30:08
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】下列说法正确的是
| A.用含有少量硫酸铜的稀硫酸跟锌粒反应,能加快产生氢气,说明Cu2+具有催化能力 |
| B.增大浓度会加快化学反应速率,是因为增加了反应物单位体积内活化分子的百分数 |
| C.等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA<HB |
| D.碱性锌锰电池是一种常见的二次电池 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】反应 在加入
在加入 后反应进程中的能量变化如图所示,已知反应机理中有
后反应进程中的能量变化如图所示,已知反应机理中有 出现。下列有关说法错误的是
出现。下列有关说法错误的是
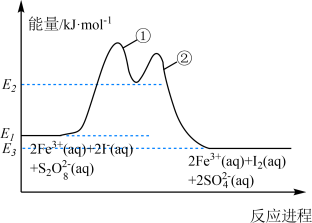
 在加入
在加入 后反应进程中的能量变化如图所示,已知反应机理中有
后反应进程中的能量变化如图所示,已知反应机理中有 出现。下列有关说法错误的是
出现。下列有关说法错误的是
A.升高温度可以更容易检测到 |
B.决速步的离子方程式为 |
C.加入 能提高反应物的活化分子百分数,从而加快反应速率 能提高反应物的活化分子百分数,从而加快反应速率 |
D.其他条件相同,增大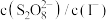 , , 的转化率增大 的转化率增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】四个试管中都装有5mL0.1mol/LNa2SO3溶液,分别在不同温度下加入0.1mol/L硫酸和一定量水,最先出现浑浊的是
| A.20℃,4 mL硫酸,6 mL水 | B.20℃,5 mL硫酸,5 mL水 |
| C.30℃,5 mL硫酸,5 mL水 | D.30℃,4 mL硫酸,6 mL水 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】 和
和 都是汽车尾气中的有害气体,它们在催化转化器中能反应生成氮气和
都是汽车尾气中的有害气体,它们在催化转化器中能反应生成氮气和 ,对此反应,下列说法中错误的是
,对此反应,下列说法中错误的是
 和
和 都是汽车尾气中的有害气体,它们在催化转化器中能反应生成氮气和
都是汽车尾气中的有害气体,它们在催化转化器中能反应生成氮气和 ,对此反应,下列说法中错误的是
,对此反应,下列说法中错误的是| A.改变压强不可以改变反应速率 |
| B.使用催化剂能同时增大正、逆反应的速率 |
| C.缩小体积能增大反应速率 |
| D.升高温度能增大吸热方向的反应速率 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】近年来,科学家发现彗星上存在氨,或许可以揭示彗星与地球生命起源的关系。下列有关氨的说法正确的是
| A.NH3属于弱电解质 |
| B.液氨汽化时,放出热量 |
C.N2(g)+3H2(g) 2NH3(g)在高温下可自发进行,则该反应的△H>0 2NH3(g)在高温下可自发进行,则该反应的△H>0 |
D.氨水显碱性,是由于发生:NH3+H2O NH3•H2O NH3•H2O  +OH- +OH- |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列说法正确的是
| A.3C(s)+CaO(s)=CaC2(s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 |
B.0.1mol/L氨水加水稀释后,溶液中 的值减小 的值减小 |
| C.常温常压下,22.4L Cl2中含有的分子数为6.02×1023个 |
| D.合成氨时,其他条件不变,升高温度,氢气的反应速率和平衡转化率均增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】氯化铁是一种重要的盐,下列说法不正确的是
| A.铁元素位于d区 | B.氯化铁溶液呈酸性 |
| C.氯化铁可用于净水 | D.铁离子价层电子排布图为3d5 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列说法中正确的是
A. 溶液和 溶液和 溶液分别加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 溶液分别加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同 |
B.实验室配制 溶液时,往往在 溶液时,往往在 溶液中加入少量的硫酸 溶液中加入少量的硫酸 |
C.向 溶液中加入 溶液中加入 ,调节 ,调节 可除去溶液中混有的 可除去溶液中混有的 |
D.用 和 和 两种溶液可作泡沫灭火剂 两种溶液可作泡沫灭火剂 |
您最近一年使用:0次

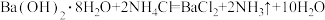 即可自发进行的主要原因是该反应为熵增的过程
即可自发进行的主要原因是该反应为熵增的过程 的反应在高温下均可自发进行
的反应在高温下均可自发进行 且
且 的反应在较低温度下可自发进行
的反应在较低温度下可自发进行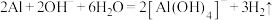

 溶液:
溶液: