立德粉(主要成分为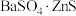 )常用作颜料。以粗氧化锌(主要成分为
)常用作颜料。以粗氧化锌(主要成分为 ,还含少量
,还含少量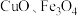 等杂质)和
等杂质)和 为原料制备立德粉的流程如图所示:
为原料制备立德粉的流程如图所示:
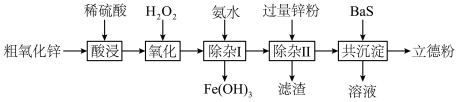
(1)写出“酸浸”过程中 发生反应的化学方程式:
发生反应的化学方程式:___________ 。
(2)加入 的作用是
的作用是___________ ,发生反应的离子方程式为___________ 。
(3)分离出 的实验操作名称为
的实验操作名称为___________ 。
(4)“除杂Ⅱ”中加入过量的锌粉主要除去___________ (填离子符号),该反应的反应类型为___________ 。
(5)“滤渣”的成分是___________ 。
(6)“共沉淀”时,若 与
与 恰好转化为
恰好转化为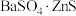 。所得溶液中除少量
。所得溶液中除少量 外,还含有的阳离子有
外,还含有的阳离子有___________ (填离子符号)。
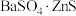 )常用作颜料。以粗氧化锌(主要成分为
)常用作颜料。以粗氧化锌(主要成分为 ,还含少量
,还含少量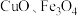 等杂质)和
等杂质)和 为原料制备立德粉的流程如图所示:
为原料制备立德粉的流程如图所示:
(1)写出“酸浸”过程中
 发生反应的化学方程式:
发生反应的化学方程式:(2)加入
 的作用是
的作用是(3)分离出
 的实验操作名称为
的实验操作名称为(4)“除杂Ⅱ”中加入过量的锌粉主要除去
(5)“滤渣”的成分是
(6)“共沉淀”时,若
 与
与 恰好转化为
恰好转化为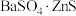 。所得溶液中除少量
。所得溶液中除少量 外,还含有的阳离子有
外,还含有的阳离子有
更新时间:2024-01-22 21:47:41
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】硝酸铈(Ⅳ)铵的化学式为(NH4)2Ce(NO3)6,易溶于水和乙醇,几乎不溶于浓硝酸,主要用作分析试剂和氧化剂。实验室设计如下实验步骤进行制备。
步骤一:先制备NH4HCO3溶液,再与CeCl3溶液反应制备难溶于水的Ce2(CO3)3,制备装置图如下:
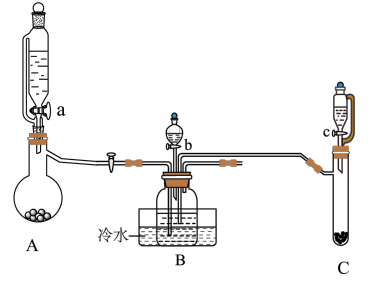
(1)装置A、C中相同仪器的名称为______ ,装置B中分液漏斗盛装的试剂是______ ,冷水浴的作用是______ 。
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为______ 。装置B中发生反应的离子方程式有______ 、______ 。
(3)该实验装置存在的一处缺陷为______ 。
步骤二:取用制取的Ce2(CO3)3固体,先加硝酸溶解,再加入氨水调节溶液的pH生成氢氧化铈(Ⅳ)沉淀,过滤后在滤渣中加入浓硝酸和硝酸铵,就析出硝酸铈(Ⅳ)铵晶体。
(4)沉淀氢氧化铈(Ⅳ)的总反应离子方程式为______ 。
(5)硝酸铈(Ⅳ)铵晶体洗涤后要采取自然干燥的原因为______ 。
步骤一:先制备NH4HCO3溶液,再与CeCl3溶液反应制备难溶于水的Ce2(CO3)3,制备装置图如下:

(1)装置A、C中相同仪器的名称为
(2)实验时,“a”、“b”、“c”三个旋塞的打开顺序为
(3)该实验装置存在的一处缺陷为
步骤二:取用制取的Ce2(CO3)3固体,先加硝酸溶解,再加入氨水调节溶液的pH生成氢氧化铈(Ⅳ)沉淀,过滤后在滤渣中加入浓硝酸和硝酸铵,就析出硝酸铈(Ⅳ)铵晶体。
(4)沉淀氢氧化铈(Ⅳ)的总反应离子方程式为
(5)硝酸铈(Ⅳ)铵晶体洗涤后要采取自然干燥的原因为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)HClO有强氧化性可用作消毒剂,HClO结构式是_______ ;通常,由新制的HgO和 反应来制备HClO的酸酐
反应来制备HClO的酸酐 (一种淡黄色气体)以更加稳定使用,该反应氧化剂和还原剂为同一物质,则该制备化学方程式为
(一种淡黄色气体)以更加稳定使用,该反应氧化剂和还原剂为同一物质,则该制备化学方程式为_______ 。
(2)“84消毒液”有效成分为次氯酸钠,测定其pH值_______ 7(填“>”、“<”或“=”)为增强其消毒杀菌效果可向其溶液中加(通)入_______ (任写一种物质)
(3)工业上用氯气通入石灰乳中制取漂白粉,反应的化学方程式为_______ 。
(4) 常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。等质量
常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。等质量 的杀菌能力是
的杀菌能力是 的
的_______ 倍(相同条件下得电子能力可衡量杀菌能力,保留小数点后一位)。
(1)HClO有强氧化性可用作消毒剂,HClO结构式是
 反应来制备HClO的酸酐
反应来制备HClO的酸酐 (一种淡黄色气体)以更加稳定使用,该反应氧化剂和还原剂为同一物质,则该制备化学方程式为
(一种淡黄色气体)以更加稳定使用,该反应氧化剂和还原剂为同一物质,则该制备化学方程式为(2)“84消毒液”有效成分为次氯酸钠,测定其pH值
(3)工业上用氯气通入石灰乳中制取漂白粉,反应的化学方程式为
(4)
 常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。等质量
常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。等质量 的杀菌能力是
的杀菌能力是 的
的
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
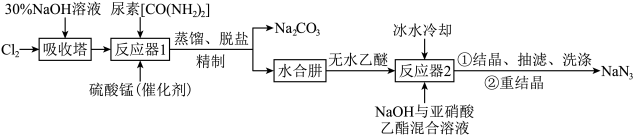
【推荐3】叠氮化钠( )不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(
)不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(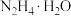 )并利用其进一步反应制取
)并利用其进一步反应制取 的流程如下:
的流程如下:
已知:①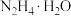 易溶于水,具有强还原性,易被氧化成N2;
易溶于水,具有强还原性,易被氧化成N2;
②一定条件下,碱性NaClO溶液与尿素溶液反应生成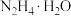
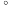
(1)写出反应器1中生成水合肼的化学方程式:___________ 。
(2)反应器2中加入无水乙醚的作用是___________ 。
(3)已知亚硝酸乙酯的结构简式为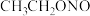 。写出反应器2中生成NaN3和
。写出反应器2中生成NaN3和 的化学方程式:
的化学方程式:________ 。若生成39gNaN3,则该反应中转移电子的物质的量为_______ 。
(4)反应器1要控制 NaClO溶液的用量,其主要目的是___________ 。
(5)某实验室设计了如图所示装置制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成OH-和H+并可分别通过阴、阳膜定向移动。
解离成OH-和H+并可分别通过阴、阳膜定向移动。
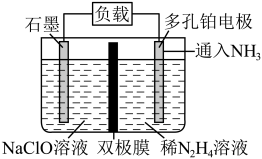
①双极膜中产生的___________ (填“H⁺”或“OH-”)移向多孔铂电极。
②石墨电极反应式为___________ 。
(6)对于反应中生成的碳酸钠,可以通过以下过程转化为亚硫酸钠。

 常用作还原性漂白剂。在测定某液体葡萄糖中
常用作还原性漂白剂。在测定某液体葡萄糖中 残留量时,取50.0mL样品,先通入足量 Cl2,再加入足量盐酸酸化的氯化钡溶液,充分反应,过滤,洗涤,干燥,称量固体质量为0.11g。通入足量Cl2发生反应的离子方程式为
残留量时,取50.0mL样品,先通入足量 Cl2,再加入足量盐酸酸化的氯化钡溶液,充分反应,过滤,洗涤,干燥,称量固体质量为0.11g。通入足量Cl2发生反应的离子方程式为___________ ,该样品中 残留量为
残留量为___________ g·L−1。(以SO2计,结果保留1位小数)
 )不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(
)不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(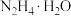 )并利用其进一步反应制取
)并利用其进一步反应制取 的流程如下:
的流程如下:
已知:①
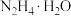 易溶于水,具有强还原性,易被氧化成N2;
易溶于水,具有强还原性,易被氧化成N2;②一定条件下,碱性NaClO溶液与尿素溶液反应生成
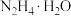
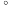
(1)写出反应器1中生成水合肼的化学方程式:
(2)反应器2中加入无水乙醚的作用是
(3)已知亚硝酸乙酯的结构简式为
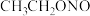 。写出反应器2中生成NaN3和
。写出反应器2中生成NaN3和 的化学方程式:
的化学方程式:(4)反应器1要控制 NaClO溶液的用量,其主要目的是
(5)某实验室设计了如图所示装置制备
 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成OH-和H+并可分别通过阴、阳膜定向移动。
解离成OH-和H+并可分别通过阴、阳膜定向移动。
①双极膜中产生的
②石墨电极反应式为
(6)对于反应中生成的碳酸钠,可以通过以下过程转化为亚硫酸钠。

 常用作还原性漂白剂。在测定某液体葡萄糖中
常用作还原性漂白剂。在测定某液体葡萄糖中 残留量时,取50.0mL样品,先通入足量 Cl2,再加入足量盐酸酸化的氯化钡溶液,充分反应,过滤,洗涤,干燥,称量固体质量为0.11g。通入足量Cl2发生反应的离子方程式为
残留量时,取50.0mL样品,先通入足量 Cl2,再加入足量盐酸酸化的氯化钡溶液,充分反应,过滤,洗涤,干燥,称量固体质量为0.11g。通入足量Cl2发生反应的离子方程式为 残留量为
残留量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】NH3和HNO3是重要的工业产品,下图是合成氨和氨氧化制硝酸的工艺流程。
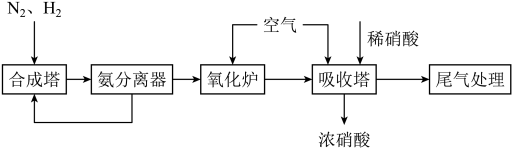
(1)合成塔中发生反应的化学方程式是_______________________ 。
(2)氨分离器中压强约为15MPa,温度约为-20℃,分离氨应用了氨_________ 的性质,从氨分离器中又回到合成塔中的物质是___________ 。
(3)氧化炉中反生反应的化学方程式是___________________ 。
(4)尾气中的少量NO、NO2可以用NH3来处理,在催化剂作用下生成无污染的气体,写出NO2和NH3反应的化学方程式__________ 。当有5.6LNO2被还原时,转移电子的物质的量为__________ mol。
(5)氧化炉中出来的气体,先降温再进入吸收塔,吸收塔中通入空气的作用是_______________ 。若进入吸收塔的气体的体积分数为NO210.0%,NO 1.32%,其余为N2、水蒸气等。当进入氧化炉中气体为10m3时,最少需要空气的体积为_________ m3。

(1)合成塔中发生反应的化学方程式是
(2)氨分离器中压强约为15MPa,温度约为-20℃,分离氨应用了氨
(3)氧化炉中反生反应的化学方程式是
(4)尾气中的少量NO、NO2可以用NH3来处理,在催化剂作用下生成无污染的气体,写出NO2和NH3反应的化学方程式
(5)氧化炉中出来的气体,先降温再进入吸收塔,吸收塔中通入空气的作用是
您最近一年使用:0次
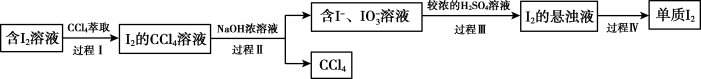
【推荐2】海带中含有碘元素,从海带中提取碘的实验过程如下图所示。
(2)海带灰悬浊液含有 。步骤④的试剂选用
。步骤④的试剂选用 、稀硫酸,离子方程式是
、稀硫酸,离子方程式是_______ 。
(3)检验步骤④产生了 的方法是
的方法是_______ 。
(4)步骤⑤“提取”包含以下四个过程。 体积明显小于含
体积明显小于含 溶液,即可使
溶液,即可使 几乎完全地转移至
几乎完全地转移至 中,推测
中,推测 在
在_______ (填“ ”或“
”或“ ”)中的溶解度更大。
”)中的溶解度更大。
b. 与
与 浓溶液反应的离子方程式是
浓溶液反应的离子方程式是_______ 。
c.过程Ⅰ→过程Ⅲ的目的是_______ 。
d.过程Ⅳ的操作是_______ 。

| A.酒精灯 | B.漏斗 | C.坩埚 | D.泥三角 |
 。步骤④的试剂选用
。步骤④的试剂选用 、稀硫酸,离子方程式是
、稀硫酸,离子方程式是(3)检验步骤④产生了
 的方法是
的方法是(4)步骤⑤“提取”包含以下四个过程。
 体积明显小于含
体积明显小于含 溶液,即可使
溶液,即可使 几乎完全地转移至
几乎完全地转移至 中,推测
中,推测 在
在 ”或“
”或“ ”)中的溶解度更大。
”)中的溶解度更大。b.
 与
与 浓溶液反应的离子方程式是
浓溶液反应的离子方程式是c.过程Ⅰ→过程Ⅲ的目的是
d.过程Ⅳ的操作是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】钛白粉(TiO2)是重要的白色颜料,LiFePO4是锂离子电池的正极材料。一种利用钛铁矿(主要成分为 FeTiO3和少量 Fe2O3、CaO、SiO2)进行钛白粉和 LiFePO4的联合生产工艺如图所示:

回答下列问题:
(1)LiFePO4中铁的化合价是___________ 。
(2)“酸浸”中主要反应的化学方程式为___________ ,“滤渣 1”的主要成分有___________ 。
(3)操作 I 加入过量 A 的目的是___________ ;硫酸亚铁晶体的溶解度如表所示,其中绿矾(FeSO4 •7H2O)容易被氧化,则“操作 II”包括真空加热浓缩、___________ 、___________ 、洗涤、干燥。
(4)“转化”利用的是 TiO2+的水解过程,则其在 90℃水解的离子方程式为___________ ,“转化后的滤液”可返回到___________ 工序循环利用。
(5)由“沉铁”到制备 LiFePO4的过程中,所需 17% H2O2溶液与草酸(H2C2O4)的质量比是___________ 。

回答下列问题:
(1)LiFePO4中铁的化合价是
(2)“酸浸”中主要反应的化学方程式为
(3)操作 I 加入过量 A 的目的是
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27 |
| 析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||
(4)“转化”利用的是 TiO2+的水解过程,则其在 90℃水解的离子方程式为
(5)由“沉铁”到制备 LiFePO4的过程中,所需 17% H2O2溶液与草酸(H2C2O4)的质量比是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】无水MgBr2 可广泛用于有机反应催化剂、污水处理剂等。实验室可用镁屑与液溴为原料,采用下图装置制备无水MgBr2,请回答:
(1)识别下图中仪器。A的名称是______ ,B是_______
(2)实验时,可向装置C中缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。干燥的氮气能将液溴吹出,因为液溴具有________ 的性质;实验中不能用干燥空气代替干燥N2,原因是:___________________________________________________________

(3)已知:Mg和Br2反应剧烈放热;乙醚(C2H5OC2H5)极易挥发。MgBr2和乙醚能发生如下反应:MgBr2+3C2H5OC2H5 MgBr2·3C2H5OC2H5+Q(Q>0);反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0°C,析出晶体,再过滤得三乙醚合溴化镁粗品。第一次过滤除去的物质是
MgBr2·3C2H5OC2H5+Q(Q>0);反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0°C,析出晶体,再过滤得三乙醚合溴化镁粗品。第一次过滤除去的物质是_______ 。过滤必须用到的玻璃仪器是:_______ 。
(4)试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水MgBr2产品的原因:______________________________
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Mg2++Y4-====Mg Y2-
①滴定前润洗滴定管的操作方法是____________________________
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol/L的EDTA 标准溶液滴定至终点,消耗EDTA 标准溶液26.50mL,则测得无水MgBr2产品的纯度是___________ (以质量分数表示)。
(1)识别下图中仪器。A的名称是
(2)实验时,可向装置C中缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。干燥的氮气能将液溴吹出,因为液溴具有

(3)已知:Mg和Br2反应剧烈放热;乙醚(C2H5OC2H5)极易挥发。MgBr2和乙醚能发生如下反应:MgBr2+3C2H5OC2H5
 MgBr2·3C2H5OC2H5+Q(Q>0);反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0°C,析出晶体,再过滤得三乙醚合溴化镁粗品。第一次过滤除去的物质是
MgBr2·3C2H5OC2H5+Q(Q>0);反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0°C,析出晶体,再过滤得三乙醚合溴化镁粗品。第一次过滤除去的物质是(4)试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水MgBr2产品的原因:
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Mg2++Y4-====Mg Y2-
①滴定前润洗滴定管的操作方法是
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol/L的EDTA 标准溶液滴定至终点,消耗EDTA 标准溶液26.50mL,则测得无水MgBr2产品的纯度是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】实验室以NaClO3、H2SO4、SO2、H2O2和NaOH为原料,制备NaClO2和无水Na2SO4,其主要流程如下:
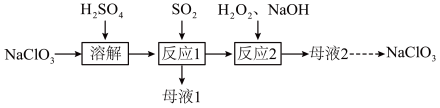
(1)反应1:SO2与溶解后的混合液反应,制得ClO2气体同时生成 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(2)ClO2是一种广谱型的消毒剂。已知在常温常压下,ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室应选用装置___________ 收集ClO2。

(3)在下图所示装置中发生反应2,生成NaClO2,反应过程中放出大量的热。
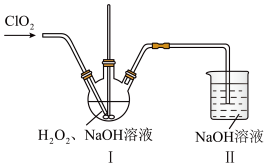
①装置Ⅰ中的反应为: ,其中ClO2表现了
,其中ClO2表现了___________ 性。用单线桥 法分析该反应,并标明电子转移数。___________ 若反应中转移4mol电子,则消耗ClO2的体积为___________ (折算为标准状况下)。装置Ⅰ应置于30℃左右的水浴中,其目的一方面保持适当的化学反应速率,另一方面防止温度过高,造成___________ 。
②装置Ⅱ中的反应为: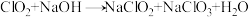 (未配平),其中氧化产物与还原产物的物质的量之比为
(未配平),其中氧化产物与还原产物的物质的量之比为___________ 。装置Ⅱ的作用是___________ 。
(4)已知温度高于60℃时,NaClO2分解,反应为: ,其中X的化学式为
,其中X的化学式为___________ 。
(5)用“单位质量的漂白剂得到的电子数目”来衡量氧化性漂白剂的漂白能力,则NaClO2的漂白能力是Cl2的___________ 倍。

(1)反应1:SO2与溶解后的混合液反应,制得ClO2气体同时生成
 ,该反应的化学方程式为
,该反应的化学方程式为(2)ClO2是一种广谱型的消毒剂。已知在常温常压下,ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室应选用装置

(3)在下图所示装置中发生反应2,生成NaClO2,反应过程中放出大量的热。

①装置Ⅰ中的反应为:
 ,其中ClO2表现了
,其中ClO2表现了②装置Ⅱ中的反应为:
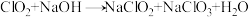 (未配平),其中氧化产物与还原产物的物质的量之比为
(未配平),其中氧化产物与还原产物的物质的量之比为(4)已知温度高于60℃时,NaClO2分解,反应为:
 ,其中X的化学式为
,其中X的化学式为(5)用“单位质量的漂白剂得到的电子数目”来衡量氧化性漂白剂的漂白能力,则NaClO2的漂白能力是Cl2的
您最近一年使用:0次
【推荐3】从某矿渣【成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等】中回收NiSO4的工艺流程如图:

已知:(NH4)2SO4在350℃分解生成NH3和H2SO4;NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。
回答下列问题:
(1)“研磨”的目的是___ 。
(2)矿渣中部分FeO在空气焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为____ 。
(3)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为___ 。“浸渣”的成分除Fe2O3、FeO(OH)、CaSO4外还含有___ (填化学式)。
(4)向“浸取液”中加入NaF以除去溶液中Ca2+,溶液中c(F-)至少为___ mol·L-1时,可使钙离子沉淀完全。[已知Ca2+浓度小于1.0×10-5mol·L-1时沉淀完全;Ksp(CaF2)=4.0×10-11]
(5)萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相) FeR2(有机相)+2H+(水相)。萃取剂与溶液的体积比(
FeR2(有机相)+2H+(水相)。萃取剂与溶液的体积比(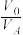 )对溶液中Ni2+、Fe2+的萃取率影响如图所示,
)对溶液中Ni2+、Fe2+的萃取率影响如图所示,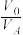 的最佳值为
的最佳值为___ 。在___ (填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。

(6)若将流程图中浸泡步骤改为如图步骤(前后步骤不变)。依据下表数据判断,调pH范围为___ 。


已知:(NH4)2SO4在350℃分解生成NH3和H2SO4;NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。
回答下列问题:
(1)“研磨”的目的是
(2)矿渣中部分FeO在空气焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为
(3)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为
(4)向“浸取液”中加入NaF以除去溶液中Ca2+,溶液中c(F-)至少为
(5)萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相)
 FeR2(有机相)+2H+(水相)。萃取剂与溶液的体积比(
FeR2(有机相)+2H+(水相)。萃取剂与溶液的体积比(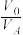 )对溶液中Ni2+、Fe2+的萃取率影响如图所示,
)对溶液中Ni2+、Fe2+的萃取率影响如图所示,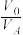 的最佳值为
的最佳值为
(6)若将流程图中浸泡步骤改为如图步骤(前后步骤不变)。依据下表数据判断,调pH范围为

有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Ni(OH)2 | Fe(OH)2 | Fe(OH)3 | Ca(OH)2 |
开始沉淀的pH | 7.1 | 6.5 | 1.5 | 12.3 |
沉淀完全的pH | 9.1 | 9.7 | 3.7 | 14.2 |
您最近一年使用:0次



