氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的关键环节。
Ⅰ.C60可用作储存氢气的材料,结构如下图所示。

(1)继C60后,科学家合成了Si60、N60三者结构相似。下列说法正确的是______(填序号)
Ⅱ.最近科学家对一种新型储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如下图所示)、每个平面小上下最多可吸附10个H2分子。

(2)C16S8与H2间以______ (填微粒间作用力类型)结合。
(3)C16S8中C-S键的共用电子对偏向于S,举出一个事实,说明硫的非金属性比碳强(用化学方程式表示):______ 。
Ⅲ.LiBH4是储氢材料,已知其由Li+和 构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
(4)锂位于元素周期表的位置______ 。
(5)由元素周期律能得到______。(填序号)
(6)LiBH4中不存在的作用力有______(填序号)。
(7)氢化锂(LiH)是离子化合物。写出其电子式______ ,LiH中负离子半径大于正离子半径,其原因是______ 。
(8)若该反应中释放67.2LH2(标况下),则转移的电子数为______ 个。
Ⅰ.C60可用作储存氢气的材料,结构如下图所示。

(1)继C60后,科学家合成了Si60、N60三者结构相似。下列说法正确的是______(填序号)
| A.C60、Si60、N60分子内部的作用力是共价键 |
| B.C60、Si60、N60分子内共用电子对数目相同 |
| C.由于N-N键能小于N≡N,故N60的稳定性弱于N2 |
| D.由于C-C键长小于Si-Si键,所以C60熔沸点低于Si60 |
Ⅱ.最近科学家对一种新型储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如下图所示)、每个平面小上下最多可吸附10个H2分子。

(2)C16S8与H2间以
(3)C16S8中C-S键的共用电子对偏向于S,举出一个事实,说明硫的非金属性比碳强(用化学方程式表示):
Ⅲ.LiBH4是储氢材料,已知其由Li+和
 构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。
构成,LiBH4释放氢气的原理为2LiBH4→2LiH+2B+3H2↑。(4)锂位于元素周期表的位置
(5)由元素周期律能得到______。(填序号)
| A.碱性:LiOH<NaOH | B.与水反应的剧烈程度:Li<Na |
| C.沸点:H2O大于HF | D.酸性:HCl大于H2SO3 |
(6)LiBH4中不存在的作用力有______(填序号)。
| A.离子键 | B.共价键 | C.金属键 | D.分子间作用力 |
(7)氢化锂(LiH)是离子化合物。写出其电子式
(8)若该反应中释放67.2LH2(标况下),则转移的电子数为
更新时间:2024-01-15 10:56:14
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】2019年的化学诺贝尔奖颁给了为锂电池研究作出贡献的三位科学家,其研究的是两种常见锂电池:一种是采用镍钴锰酸锂Li(NiCoMn)O2或镍钴铝酸锂为正极的“三元材料锂电池”;另一种是采用磷酸铁锂(LiFePO4)为正极的电池。请回答下列问题:
(1)利用FeSO4、(NH4)2HPO4、LiOH为原料以物质的量之比1∶1∶1反应生成LiFePO4,该化学反应方程式为________________ 。
(2)Mn位于元素周期表的_____ 区(填“s”或“p”或“d”或“ds”或“f”),基态钴原子的未成对电子数为______ ,1mol [CoCl (NH3)5] Cl2 中含σ键数目为__ NA。
(3)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是_____ 。PO43-的空间构型是___ ,中心原子的杂化方式是______ 。
(4)PH3是_____ 分子(填“极性”或“非极性”),其在水中的溶解性比NH3小,原因是______ 。
(5)硫化锂Li2S(摩尔质量Mg∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是_______ nm。(用含a、M、NA的计算式表示)

(1)利用FeSO4、(NH4)2HPO4、LiOH为原料以物质的量之比1∶1∶1反应生成LiFePO4,该化学反应方程式为
(2)Mn位于元素周期表的
(3)磷元素可以形成多种含氧酸H3PO4、H3PO2、H3PO3、HPO3,这四种酸中酸性最强的是
(4)PH3是
(5)硫化锂Li2S(摩尔质量Mg∙mol-1)的纳米晶体是开发先进锂电池的关键材料,硫化锂的晶体为反萤石结构,其晶胞结构如图。若硫化锂晶体的密度为ag·cm-3,则距离最近的两个S2-的距离是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】短周期p区元素多为非金属元素
(1)基态磷原子的价层电子排布图是__________ ,第三周期元素中,第一电离能最大的前三种元素是__________________ 。
(2)BF3、NF3、PCl3、SCl2四种分子中,属于平面三角形的是____________ ,中心原子杂化类型为sp3的是_______________ 。
(3)已知H2O的沸点比H2O2低58℃但比H2S高160℃,导致这种差异的原因是________________ 。

(4)金属铝的晶胞结构如图,若晶胞参数r pm,则单质的密度为(用NA表示阿伏加 德罗常数)_______________ g·cm-3(列出计算式即可)。
(1)基态磷原子的价层电子排布图是
(2)BF3、NF3、PCl3、SCl2四种分子中,属于平面三角形的是
(3)已知H2O的沸点比H2O2低58℃但比H2S高160℃,导致这种差异的原因是

(4)金属铝的晶胞结构如图,若晶胞参数r pm,则单质的密度为(用NA表示阿伏加 德罗常数)
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】A、B、C、D、E为前四周期元素,原子序数依次增大,A为短周期中离子半径最小的金属元素,B为短周期中金属性最强的元素,C元素的单质是一种淡黄色固体,D元素的基态原子在前四周期中未成对电子数最多。E位于元素周期表中第八列。
回答下列问题:
(1)B在焰色反应中发出黄光是一种______ (填字母)。
A.发射光谱 B.吸收光谱
(2)D元素在元素周期表中的位置为______ ,在同周期中,与D元素基态原子具有相同最外层电子数的元素为______ (填元素符号)。
(3)在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,这种相似性被称为对角线规则。请写出A元素与B元素最高价氧化物的水化物反应的离子方程式______ ,已知A元素与Cl元素的电负性分别为1.5和3.0,则它们所形成的化合物为______ (填“离子化合物”或“共价化合物”)。
(4)某同学画出C元素基态原子的价层电子轨道表示式为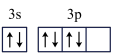 ,该同学所画的轨道表示式违背了
,该同学所画的轨道表示式违背了______ 。C原子能量最高的电子其电子云形状是______ 。
(5)写出E元素基态原子的电子排布式______ ,其两种简单离子中,更加稳定的是______ (填离子符号),理由是______ 。
回答下列问题:
(1)B在焰色反应中发出黄光是一种
A.发射光谱 B.吸收光谱
(2)D元素在元素周期表中的位置为
(3)在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,这种相似性被称为对角线规则。请写出A元素与B元素最高价氧化物的水化物反应的离子方程式
(4)某同学画出C元素基态原子的价层电子轨道表示式为
 ,该同学所画的轨道表示式违背了
,该同学所画的轨道表示式违背了(5)写出E元素基态原子的电子排布式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】短周期元素W、X、Y和Z在周期表中的相对位置如下表所示,这四种元素原子的最外层电子数之和为21。请用化学用语 回答下列问题:
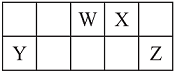
(1)写出W含有8个中子的核素的化学符号_____________ 。
(2)元素Z的最高价氧化物对应的水化物的化学式为_____________ 。
(3)在X、Y、Z三种元素中,其离子半径按由大到小的排列顺序为________________ 。
(4)X、Z的气态氢化物沸点较高是________ ,原因是____________________ 。
(5)化合物Y2X3中含有的化学键类型是________ 。工业上冶炼Y单质的方法是________ (填字母)。
A.重力沉降法 B.热分解法 C.热还原法 D.电解法
(6)水中锰含量超标,容易使洁具和衣物染色、使水产生异味。ZX2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,同时测得消耗13.50g ZX2时,共转移了1mol电子,则反应的离子方程式是___________________________________ 。

(1)写出W含有8个中子的核素的化学符号
(2)元素Z的最高价氧化物对应的水化物的化学式为
(3)在X、Y、Z三种元素中,其离子半径按由大到小的排列顺序为
(4)X、Z的气态氢化物沸点较高是
(5)化合物Y2X3中含有的化学键类型是
A.重力沉降法 B.热分解法 C.热还原法 D.电解法
(6)水中锰含量超标,容易使洁具和衣物染色、使水产生异味。ZX2可以用来除去水中超标的Mn2+,生成一种黑色沉淀,同时测得消耗13.50g ZX2时,共转移了1mol电子,则反应的离子方程式是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】表中是元素周期表的一部分,请参照元素①~⑤在表中的位置,回答下列问题:
(1)①的原子结构示意图是_____ 。
(2)②、③、④、⑤四种元素的离子半径最小的是_____ (写离子符号)。
(3)②和⑤可形成离子化合物,用电子式表示其形成过程_____ 。
(4)②和④各自的最高价氧化物的水化物发生反应的离子方程式为_____ 。
(5)下列事实能判断②和③的金属性强弱的是_____ (填字母,下同)。
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
(6)硒(Se)位于第四周期,与①同主族。下列推断正确的是_____ 。
a.SeO2只具有还原性
b.Se的最低负化合价是-2价
c.Se的气态氢化物的稳定性比①的强
室温下向SeO2固体表面吹入NH3,得到两种单质和H2O,该反应的化学方程式为_____ 。
| 族 周期 | IA | 0 | ||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ | ||||
(1)①的原子结构示意图是
(2)②、③、④、⑤四种元素的离子半径最小的是
(3)②和⑤可形成离子化合物,用电子式表示其形成过程
(4)②和④各自的最高价氧化物的水化物发生反应的离子方程式为
(5)下列事实能判断②和③的金属性强弱的是
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
(6)硒(Se)位于第四周期,与①同主族。下列推断正确的是
a.SeO2只具有还原性
b.Se的最低负化合价是-2价
c.Se的气态氢化物的稳定性比①的强
室温下向SeO2固体表面吹入NH3,得到两种单质和H2O,该反应的化学方程式为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】合成氨是人类科学技术发展史上的一项重大成就,在很大程度上解决了地球上因粮食不足而导致的饥饿问题,是化学和技术对社会发展与进步的巨大贡献。
(1)自然界中的氨元素主要以分子的形式存在于空气中,是人工固氮的主要来源。基态氮原子核外电子最高能级的电子云轮廓图为_______ 形。
(2) 是
是____ (填“极性”或“非极性”)分子, 的键角
的键角_____ (填“>”或“<”)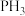 的键角。
的键角。
(3)纯叠氮酸 在常温下是一种液体,沸点较高,为
在常温下是一种液体,沸点较高,为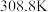 ,主要原因是
,主要原因是_______
(4)我国科研人员研制出了“ ”催化剂,将合成氨的温度、压强分别降到了
”催化剂,将合成氨的温度、压强分别降到了 、
、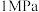 ,这是近年来合成氨反应研究中的重要突破。
,这是近年来合成氨反应研究中的重要突破。
①比较 与
与 的半径大小关系:
的半径大小关系: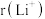
_______  (填“>”或“<”)。
(填“>”或“<”)。
② 的化合物
的化合物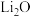 是离子化合物,下图是其
是离子化合物,下图是其 循环,表示其形成过程
循环,表示其形成过程
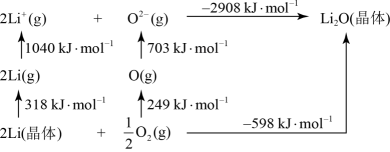
可知, 原子的第一电离能为
原子的第一电离能为_______  ,O=O键键能为
,O=O键键能为_______ 
(1)自然界中的氨元素主要以分子的形式存在于空气中,是人工固氮的主要来源。基态氮原子核外电子最高能级的电子云轮廓图为
(2)
 是
是 的键角
的键角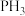 的键角。
的键角。(3)纯叠氮酸
 在常温下是一种液体,沸点较高,为
在常温下是一种液体,沸点较高,为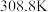 ,主要原因是
,主要原因是(4)我国科研人员研制出了“
 ”催化剂,将合成氨的温度、压强分别降到了
”催化剂,将合成氨的温度、压强分别降到了 、
、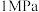 ,这是近年来合成氨反应研究中的重要突破。
,这是近年来合成氨反应研究中的重要突破。①比较
 与
与 的半径大小关系:
的半径大小关系: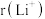
 (填“>”或“<”)。
(填“>”或“<”)。②
 的化合物
的化合物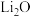 是离子化合物,下图是其
是离子化合物,下图是其 循环,表示其形成过程
循环,表示其形成过程
可知,
 原子的第一电离能为
原子的第一电离能为 ,O=O键键能为
,O=O键键能为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】已知:A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B的最高价氧化物对应水化物的化学式为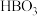 ;C元素原子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物
;C元素原子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物 ;C、E同主族。
;C、E同主族。
(1)B的原子结构示意图为_______ 。
(2)E元素形成的最高价氧化物对应水化物的化学式为_______ 。
(3)元素C、D、E的原子半径大小关系是_______ (用元素符号表示)。
(4)C、D可形成化合物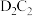 ,
,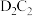 中含有的化学键是
中含有的化学键是_______ 。
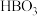 ;C元素原子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物
;C元素原子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物 ;C、E同主族。
;C、E同主族。(1)B的原子结构示意图为
(2)E元素形成的最高价氧化物对应水化物的化学式为
(3)元素C、D、E的原子半径大小关系是
(4)C、D可形成化合物
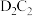 ,
,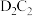 中含有的化学键是
中含有的化学键是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
(除特别注明外,其它一律用化学式表示)
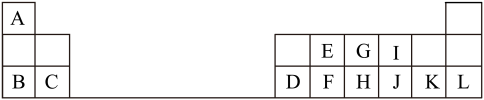
(1)由E形成的物质中硬度最大的是___ (填名称),属于___ (填“晶体类型”)。
(2)最高价氧化物水化物中碱性最强的化合物的电子式是___ ,该碱溶液与D的最高价氧化物反应的离子方程式___ 。
(3)常用作光导纤维的是___ 。
(4)G、H、I形成的气态氢化物稳定性由强到弱的顺序___ 。
(5)H、J、K的最高价氧化物对应水化物的酸性由强到弱的顺序___ 。
(6)I、J、K三种元素形成的离子,离子半径由大到小的顺序是___ 。
(7)元素I的氢化物的结构式为___ ;该氢化物常温下和元素K的单质反应的化学方程式为___ 。
(除特别注明外,其它一律用化学式表示)

(1)由E形成的物质中硬度最大的是
(2)最高价氧化物水化物中碱性最强的化合物的电子式是
(3)常用作光导纤维的是
(4)G、H、I形成的气态氢化物稳定性由强到弱的顺序
(5)H、J、K的最高价氧化物对应水化物的酸性由强到弱的顺序
(6)I、J、K三种元素形成的离子,离子半径由大到小的顺序是
(7)元素I的氢化物的结构式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】几种主族元素在周期表中的位置如下
根据上表回答下列问题:
(1)⑨元素的简单氢化物的化学式是___________ 。
(2)写出元素①最高价氧化物对应水化物的电子式:___________
(3)⑥元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有___________ ;(填字母,a离子键、b极性共价键、c非极性共价键)
(4)①②③三种元素最高价氧化物对应的水化物碱性最强的是___________ (填化学式),写出③的单质与①的最高价氧化物对应水化物反应的离子方程式___________ 。
(5)⑦的非金属性强于⑧。下列表述中能证明这一事实的是___________ (填字母)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应水化物的酸性强于⑧最高价氧化物对应水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦的氢化物酸性比⑧的氢化物酸性弱
e.简单阴离子的还原性:⑦>⑧
族 周期 | ⅠA | 0 | ||||||
| 1 | ④ | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ⑨ | ⑦ | ||||
| 4 | ② | ⑧ | ||||||
(1)⑨元素的简单氢化物的化学式是
(2)写出元素①最高价氧化物对应水化物的电子式:
(3)⑥元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有
(4)①②③三种元素最高价氧化物对应的水化物碱性最强的是
(5)⑦的非金属性强于⑧。下列表述中能证明这一事实的是
a.⑦的氢化物比⑧的氢化物稳定
b.⑦最高价氧化物对应水化物的酸性强于⑧最高价氧化物对应水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦的氢化物酸性比⑧的氢化物酸性弱
e.简单阴离子的还原性:⑦>⑧
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】化学物质结构与性质按要求回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________形象化描述;在基态14C原子中,核外存在___________对自旋相反的电子。
(2)在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接___________个六元环,六元环中最多有___________个C原子在同一平面,一个金刚石晶胞平均占有碳原子个数为___________。
(3)与N2互为等电子体的分子是___________,该分子的电子式为___________。
(4)已知C60分子结构如图所示:该笼状分子是由多个正六边形和正五边形组成的,面体的顶点数V、面数F及棱数E间关系为:V+F-E=2,则此分子中共有___________个正五边形。
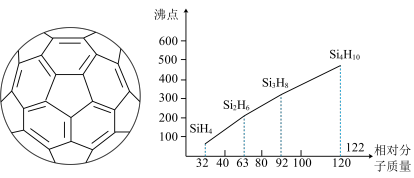
(5)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是___________。

(6) NiO晶体结构与NaCl晶体类似,其晶胞的棱长为a cm,则该晶体中距离最近的两个阳离子核间的距离为___________ cm(用含有a的代数式表示),在一定温度下NiO晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为___________g(氧离子的半径为1.40×10-10m )。
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用___________形象化描述;在基态14C原子中,核外存在___________对自旋相反的电子。
(2)在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接___________个六元环,六元环中最多有___________个C原子在同一平面,一个金刚石晶胞平均占有碳原子个数为___________。
(3)与N2互为等电子体的分子是___________,该分子的电子式为___________。
(4)已知C60分子结构如图所示:该笼状分子是由多个正六边形和正五边形组成的,面体的顶点数V、面数F及棱数E间关系为:V+F-E=2,则此分子中共有___________个正五边形。
(5)硅烷(SinH2n+2)的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是___________。


(6) NiO晶体结构与NaCl晶体类似,其晶胞的棱长为a cm,则该晶体中距离最近的两个阳离子核间的距离为___________ cm(用含有a的代数式表示),在一定温度下NiO晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为___________g(氧离子的半径为1.40×10-10m )。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】(1)把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)  nZ(g)+6W(g)。2 min末生成0.3 mol W,若测知以Z的浓度变化表示的平均反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为
nZ(g)+6W(g)。2 min末生成0.3 mol W,若测知以Z的浓度变化表示的平均反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为____________________ ;2 min末时Y的浓度为______________ ;化学方程式中n的值是________ 。
(2)1 mol N2(g)和1 mol O2(g)在一定条件下反应生成2 mol NO(g),吸收180 kJ的热量,已知断裂1 mol N2(g)中的N≡N和1 mol O2(g)中的氧氧键分别需要吸收946 kJ和498 kJ的能量,则1 mol NO分子中的化学键形成时可释放________ kJ的能量。
(3)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。根据你所学的知识回答下列问题:
①碳元素在周期表中的位置是______________ ,甲烷与水相比较稳定的是__________ ;
已知1g甲烷完全燃烧生成液态水时放热55.6kJ,写出该反应的热化学方程式:____ 。
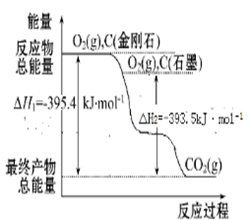
②碳有多种同素异形体,C60所属的晶体类型为__________ ,熔化时克服的作用力为 ____ ;金刚石属于____ 晶体,熔化时破坏的作用力是_________ ; 金刚石、石墨的能量关系如图所示,则金刚石和石墨相比,________ 更稳定。
 nZ(g)+6W(g)。2 min末生成0.3 mol W,若测知以Z的浓度变化表示的平均反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为
nZ(g)+6W(g)。2 min末生成0.3 mol W,若测知以Z的浓度变化表示的平均反应速率为0.05 mol·(L·min)-1。试计算:前2 min内用X的浓度变化表示的平均反应速率为(2)1 mol N2(g)和1 mol O2(g)在一定条件下反应生成2 mol NO(g),吸收180 kJ的热量,已知断裂1 mol N2(g)中的N≡N和1 mol O2(g)中的氧氧键分别需要吸收946 kJ和498 kJ的能量,则1 mol NO分子中的化学键形成时可释放
(3)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体。根据你所学的知识回答下列问题:
①碳元素在周期表中的位置是
已知1g甲烷完全燃烧生成液态水时放热55.6kJ,写出该反应的热化学方程式:
②碳有多种同素异形体,C60所属的晶体类型为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】硅烷 可用于制造高纯硅。采用硅化镁法制备
可用于制造高纯硅。采用硅化镁法制备 的化学方程式如下:
的化学方程式如下:
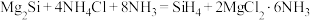
(1)硅在元素周期表中的位置是___________ ,基态硅原子占据的最高能级的符号是___________ 。
(2)O、N、H的电负性由大到小的顺序是___________ 。
(3)下列状态的氮中,电离最外层一个电子所需能量最小的是___________ (填序号)。
a.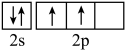 b.
b.  c.
c.
(4)① 的沸点比
的沸点比 的
的___________ (填“高”或“低”),原因是___________ 。
② 中H—Si—H的键角
中H—Si—H的键角___________  中H—N—H的键角(填“>”“<”或“=”),其键角差异的原因是
中H—N—H的键角(填“>”“<”或“=”),其键角差异的原因是___________ 。
(5) 可由Mg和
可由Mg和 反应制得。一种
反应制得。一种 晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是
晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是___________ 。

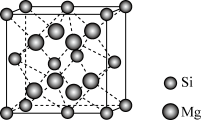
(6) 晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有
晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有___________ 个紧邻的Mg原子。已知 的晶胞边长为
的晶胞边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为___________  。
。
 可用于制造高纯硅。采用硅化镁法制备
可用于制造高纯硅。采用硅化镁法制备 的化学方程式如下:
的化学方程式如下: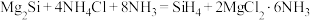
(1)硅在元素周期表中的位置是
(2)O、N、H的电负性由大到小的顺序是
(3)下列状态的氮中,电离最外层一个电子所需能量最小的是
a.
 b.
b.  c.
c.
(4)①
 的沸点比
的沸点比 的
的②
 中H—Si—H的键角
中H—Si—H的键角 中H—N—H的键角(填“>”“<”或“=”),其键角差异的原因是
中H—N—H的键角(填“>”“<”或“=”),其键角差异的原因是(5)
 可由Mg和
可由Mg和 反应制得。一种
反应制得。一种 晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是
晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是
(6)
 晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有
晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有 的晶胞边长为
的晶胞边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为 。
。
您最近一年使用:0次



