A、B、C、D、E为前四周期元素,原子序数依次增大,A为短周期中离子半径最小的金属元素,B为短周期中金属性最强的元素,C元素的单质是一种淡黄色固体,D元素的基态原子在前四周期中未成对电子数最多。E位于元素周期表中第八列。
回答下列问题:
(1)B在焰色反应中发出黄光是一种______ (填字母)。
A.发射光谱 B.吸收光谱
(2)D元素在元素周期表中的位置为______ ,在同周期中,与D元素基态原子具有相同最外层电子数的元素为______ (填元素符号)。
(3)在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,这种相似性被称为对角线规则。请写出A元素与B元素最高价氧化物的水化物反应的离子方程式______ ,已知A元素与Cl元素的电负性分别为1.5和3.0,则它们所形成的化合物为______ (填“离子化合物”或“共价化合物”)。
(4)某同学画出C元素基态原子的价层电子轨道表示式为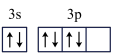 ,该同学所画的轨道表示式违背了
,该同学所画的轨道表示式违背了______ 。C原子能量最高的电子其电子云形状是______ 。
(5)写出E元素基态原子的电子排布式______ ,其两种简单离子中,更加稳定的是______ (填离子符号),理由是______ 。
回答下列问题:
(1)B在焰色反应中发出黄光是一种
A.发射光谱 B.吸收光谱
(2)D元素在元素周期表中的位置为
(3)在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,这种相似性被称为对角线规则。请写出A元素与B元素最高价氧化物的水化物反应的离子方程式
(4)某同学画出C元素基态原子的价层电子轨道表示式为
 ,该同学所画的轨道表示式违背了
,该同学所画的轨道表示式违背了(5)写出E元素基态原子的电子排布式
更新时间:2023-02-06 19:02:10
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】铁、钴、镍并称铁系元素,性质具有相似性。
(1)基态钴原子的核外电子排布式为___________ ,Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是___________ 。
(2)铁氰化钾K3[Fe(CN)6]溶液可以检验Fe2+。1 mol CN-中含有π键的数目为___________ ,与CN-互为等电子体(化学通式相同且价电子总数相等)的分子有___________ ,铁氰化钾晶体中各种微粒间的相互作用不包括___________ 。
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
(3)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化。甲醛分子的空间结构为___________ ,碳原子的杂化类型为___________ 。
(4)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO___________ FeO(填“<”或“>”),判断依据是___________ 。
(5)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是___________ ,该化合物的化学式为___________ 。

(1)基态钴原子的核外电子排布式为
(2)铁氰化钾K3[Fe(CN)6]溶液可以检验Fe2+。1 mol CN-中含有π键的数目为
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.范德华力
(3)纳米结构氧化钴可在室温下将甲醛(HCHO)完全催化氧化。甲醛分子的空间结构为
(4)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO
(5)Si与P形成的某化合物晶体的晶胞如图。该晶体类型是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】I下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)k的基态原子核外有___________ 个未成对电子。
(2)c、d、e三元素形成的X、Y两种物质的分子结构和部分物理性质如下表,两者熔沸点差异的主要原因是___________ 。
(3)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。原因是___________ 。
II铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(4)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是___________ 。FeSO4常作补铁剂, 的立体构型是
的立体构型是___________ 。
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含___________ molσ键,与CO互为等电子体的离子是___________ (填化学式,写一种)。
(6)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为___________ 。

(7)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为___________ ;Fe2+与O2-最短核间距为___________ pm。(列出计算式即可)。
 。
。

试回答下列问题:
(1)k的基态原子核外有
(2)c、d、e三元素形成的X、Y两种物质的分子结构和部分物理性质如下表,两者熔沸点差异的主要原因是
| 代号 | 结构简式 | 水中溶解度/g(25℃) | 熔点/℃ | 沸点/℃ |
| X |  | 0.2 | 45 | 100 |
| Y |  | 1.7 | 114 | 295 |
| 元素 | o | p | |
| 电离能/(kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
II铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(4)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是
 的立体构型是
的立体构型是(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含
(6)氮化铁晶体的晶胞结构如图所示。该晶体中铁、氮的微粒个数之比为

(7)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为
 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】 在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物。
在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物。
(1)合成氨是人类科学技术上的一项重大突破,工业合成氨生产中常用铁触媒作催化剂,请写出Fe元素的基态原子的价电子排布图:_______ 。
(2)可以利用反应 生产尿素,在
生产尿素,在 和
和 分子中的三个N原子,杂化方式为
分子中的三个N原子,杂化方式为 有
有_______ 个,其中C、N、O三种元素的电负性由小到大的顺序为_______ , 中含有
中含有 键的数目为
键的数目为_______ 。
(3)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的 晶体,与该物质中的配体互为等电子体的阴离子的化学式为
晶体,与该物质中的配体互为等电子体的阴离子的化学式为_______ (写一个),加入乙醇,析出蓝色晶体的原因是_______ 。
(4)写出将过量氨水逐滴加入硫酸铜溶液中发生反应的离子方程式:_______ 、_______ 。
 在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物。
在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物。(1)合成氨是人类科学技术上的一项重大突破,工业合成氨生产中常用铁触媒作催化剂,请写出Fe元素的基态原子的价电子排布图:
(2)可以利用反应
 生产尿素,在
生产尿素,在 和
和 分子中的三个N原子,杂化方式为
分子中的三个N原子,杂化方式为 有
有 中含有
中含有 键的数目为
键的数目为(3)向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的
 晶体,与该物质中的配体互为等电子体的阴离子的化学式为
晶体,与该物质中的配体互为等电子体的阴离子的化学式为(4)写出将过量氨水逐滴加入硫酸铜溶液中发生反应的离子方程式:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)X能形成多种常见单质,在硬度最大的单质中,原子的杂化方式为_______ 。
(2)Z位于元素周期表的位置是___ ,Y的氢化物空间构型是_____ 。
(3)在H-Y、H-Z两种共价键中,键的极性较强的是______ ,X所在周期元素中氢化物最稳定的是______ (用具体元素符号表示)。
(4)下列有关X2H4的说法正确的是_____ 。
A.分子中所有原子都满足8电子稳定结构
B.每个分子中σ键和π键数目之比为4:1
C.它是由极性键和非极性键构成的非极性分子
D.分子的空间构型为直线形
(5)向含有 W2+的溶液中逐滴加入氨水至过量,期间出现的现象是________ ,写出最后所得配离子的结构式,要求标出配位键____ 。
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积,其氧化物是形成酸雨的重要原因 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)Z位于元素周期表的位置是
(3)在H-Y、H-Z两种共价键中,键的极性较强的是
(4)下列有关X2H4的说法正确的是
A.分子中所有原子都满足8电子稳定结构
B.每个分子中σ键和π键数目之比为4:1
C.它是由极性键和非极性键构成的非极性分子
D.分子的空间构型为直线形
(5)向含有 W2+的溶液中逐滴加入氨水至过量,期间出现的现象是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D、E、F是原子序数依次递增的前四周期元素。A是宇宙中含量最丰富的元素;D与E同主族,且E的原子序数是D的两倍;B与D组成的化合物是一种温室气体;C元素原子最外层p能级比s能级多1个电子;F原子的最外层电子数与A相同,其余各层均充满。据此回答下列问题。
(1)F元素形成的高价基态离子的价电子排布图为_______ 。
(2)E的一种具有强还原性的氧化物分子的VSEPR模型为_______ 。
(3)C、D、E元素的第一电离能由大到小顺序是_______ (用元素符号表示)。
(4)A和D形成的18电子化合物难溶于BE2,其理由是_______ ,此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为_______ 。
(5)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L甲气体与0.5 L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是_______ 。
(6)F与C形成化合物的晶胞如图所示,该化合物的化学式为_______ ,C离子的配位数是_______ 。F离子在水溶液中形成的离子中共价键共_______ 。

(1)F元素形成的高价基态离子的价电子排布图为
(2)E的一种具有强还原性的氧化物分子的VSEPR模型为
(3)C、D、E元素的第一电离能由大到小顺序是
(4)A和D形成的18电子化合物难溶于BE2,其理由是
(5)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L甲气体与0.5 L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是
(6)F与C形成化合物的晶胞如图所示,该化合物的化学式为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中:C元素的原子最外层电子数是次外层电子数的三倍;A与D、C与F同主族;D是所在周期原子半径最大的主族元素,又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素D在周期表中的位置________________ 。
(2)写出B单质的电子式________________ 。
(3)C、D、F三种元素形成的简单离子的半径由大到小的顺序是________ (用离子符号表示)。
(4)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有_________________________ 。
(5)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:________________________________________________ ;若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:______________________________________________ 。
(6)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式_________________________________________________________ 。
(1)元素D在周期表中的位置
(2)写出B单质的电子式
(3)C、D、F三种元素形成的简单离子的半径由大到小的顺序是
(4)由A、B、C三种元素以原子个数比4∶2∶3形成化合物X,X中所含化学键类型有
(5)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:
(6)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方程式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。元素W是元素周期表中第29号元素。
(1)X在元素周期表中的位置为____ ,其价电子排布式为____ 。
(2)Y形成气态氢化物的电子式为____ ,氢化物分子中,Y原子轨道的杂化类型是____ 。
(3)在乙醇中的溶解度,Z的氢化物____ Y的氢化物(填“>”、“<”或“=”),其原因是:____ 。
(4)Y与Z可形成YZ ,该离子空间构型为
,该离子空间构型为____ (用文字描述)。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有配位键为____ mol。
(6)W的单质与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是:_____ ,反应的离子方程式为____ 。
(7)第一电离能:I1(X)____ I1(W)(填“>”、“<”或“=”),原因是:____ 。
(1)X在元素周期表中的位置为
(2)Y形成气态氢化物的电子式为
(3)在乙醇中的溶解度,Z的氢化物
(4)Y与Z可形成YZ
 ,该离子空间构型为
,该离子空间构型为(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有配位键为
(6)W的单质与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是:
(7)第一电离能:I1(X)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】有A、B、C、D、E五种元素。其相关信息如下:
请回答下列问题:
(1)写出E元素原子基态时的电子排布式_______ 。
(2)C元素的第一电离能比氧元素的第一电离能_____ (填“大”或“小”)。
(3)CA3分子中C原子的杂化轨道类型是______ ,CA3分子的空间构型是_____ 。
(5)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有________ (填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
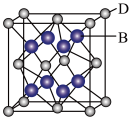
(5)B与D可形成离子化合物,其晶胞结构如图所示。其中D离子的配位数为_______ 。
| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2p轨道中有三个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有两个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式
(2)C元素的第一电离能比氧元素的第一电离能
(3)CA3分子中C原子的杂化轨道类型是
(5)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
(5)B与D可形成离子化合物,其晶胞结构如图所示。其中D离子的配位数为

您最近一年使用:0次
【推荐3】W、X、Y、Z、M、Q是原子序数依次增大的前四周期元素,其元素性质或原子结构如表所示。
(1)W、Z、Q的元素符号分别为_______ 、_______ 、_______ 。
(2)X的基态原子有_______ 种空间运动状态不同的电子,其中能量最高的电子所占据的原子轨道呈_______ 形。
(3)与Y处于同一周期的所有元素中,第一电离能比Y大的元素有_______ 种。[XW4]+的电子式为_______ 。
(4)M位于元素周期表的_______ 区,M3+简化的电子排布式为_______ 。
(5)Q在元素周期表中的位置为_______ ,其价层电子轨道表达式为_______ 。
(6)基态某原子的价层电子排布式为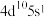 ,推断该元素位于
,推断该元素位于_______ 区。
(7)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成 。
。 与
与 的离子半径大小关系为
的离子半径大小关系为
_______ (填“大于”、“小于”或“等于”) ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是_______ 。
(8)下列各组多电子原子的能级能量比较不正确的是_______ (填序号)。
① ②
② ③
③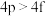 ④
④
| 元素 | 元素性质或原子结构 | ||||||||||||||||||
| W | 电子只有一种自旋取向 | ||||||||||||||||||
| X | 最外层电子排布式为nsnnpn+1 | ||||||||||||||||||
| Y | 非金属元素,且s能级上的电子总数与p能级上的电子总数相等 | ||||||||||||||||||
| Z |
| ||||||||||||||||||
| M | 前四周期元素中原子核外未成对电子数最多 | ||||||||||||||||||
| Q | 基态原子M能层全充满,N层没有成对电子 | ||||||||||||||||||
(2)X的基态原子有
(3)与Y处于同一周期的所有元素中,第一电离能比Y大的元素有
(4)M位于元素周期表的
(5)Q在元素周期表中的位置为
(6)基态某原子的价层电子排布式为
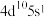 ,推断该元素位于
,推断该元素位于(7)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成
 。
。 与
与 的离子半径大小关系为
的离子半径大小关系为
 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是(8)下列各组多电子原子的能级能量比较不正确的是
①
 ②
② ③
③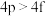 ④
④
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】目前半导体生产正在进行一场“铜芯片”革命:在硅芯片上用铜代替铝布线。古老的金属铜在现代科技应用上取得了突破。用黄铜矿(主要成分为CuFeS2)生产粗铜,其反应原理如图:

(1)基态铜原子的价电子排布式为______ ,硫、氧元素相比,第一电离能较大的元素是_____ (填元素符号)。
(2)反应①、②中均有SO2气体生成,SO2分子的中心原子杂化类型是____ ,其立体结构是____ 。
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液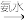 蓝色沉淀
蓝色沉淀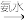 沉淀溶解,得到深蓝色透明溶液。生成蓝色沉淀溶于氨水的离子方程式为
沉淀溶解,得到深蓝色透明溶液。生成蓝色沉淀溶于氨水的离子方程式为____ ;
(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。铜晶体中铜原子堆积方式为________ ;铜的某种氧化物晶胞结构如图所示,若该晶体的密度为dg/cm3,阿伏加 德罗常数的值为NA,则该晶胞中铜原子与氧原子之间的最近距离为________ pm。(用含d和NA的式子表示)


(1)基态铜原子的价电子排布式为
(2)反应①、②中均有SO2气体生成,SO2分子的中心原子杂化类型是
(3)某学生用硫酸铜溶液与氨水做了一组实验:CuSO4溶液
 蓝色沉淀
蓝色沉淀 沉淀溶解,得到深蓝色透明溶液。生成蓝色沉淀溶于氨水的离子方程式为
沉淀溶解,得到深蓝色透明溶液。生成蓝色沉淀溶于氨水的离子方程式为(4)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。铜晶体中铜原子堆积方式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】钒(V)固氮酶种类众多,其中种结构如图所示:
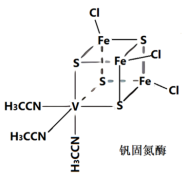
(1)基态钒原子的核外电子排布式为____ ,该元素位于元素周期表的第___ 族。
(2)配体CH3CN中所含σ键与π键数目之比为_______ 。
(3)钒固氮酶中钒的配位原子有_____ (写元素符号)。
(4)CO2、SiO2、SO2三种氧化物组成相似,但键角不同,键角由大到小的顺序为__ ;其中某一氧化物键角最大,原因是__ 。
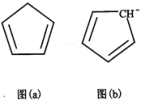
(5)环戊二烯(C5H6)结构如图( a ),可用于制二茂铁。分子中的大π键可用符号 表示,其 m 代表参与形成大π键的原子数,n 代表参与形成大π键的电子数,环戊二烯负离子(C5H
表示,其 m 代表参与形成大π键的原子数,n 代表参与形成大π键的电子数,环戊二烯负离子(C5H )结构如图(b),其中的大π键可以表示为
)结构如图(b),其中的大π键可以表示为 ____ 。

(1)基态钒原子的核外电子排布式为
(2)配体CH3CN中所含σ键与π键数目之比为
(3)钒固氮酶中钒的配位原子有
(4)CO2、SiO2、SO2三种氧化物组成相似,但键角不同,键角由大到小的顺序为
(5)环戊二烯(C5H6)结构如图( a ),可用于制二茂铁。分子中的大π键可用符号
 表示,其 m 代表参与形成大π键的原子数,n 代表参与形成大π键的电子数,环戊二烯负离子(C5H
表示,其 m 代表参与形成大π键的原子数,n 代表参与形成大π键的电子数,环戊二烯负离子(C5H )结构如图(b),其中的大π键可以表示为
)结构如图(b),其中的大π键可以表示为 
您最近一年使用:0次
【推荐3】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________ ,有________ 个未成对电子。
(2)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________ 。
(3)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为________________________ ,微粒之间存在的作用力是________________ 。
(4)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为________ 。
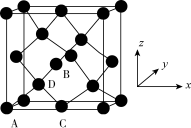
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为________ g·cm-3(列出计算式即可)。
(1)基态Ge原子的核外电子排布式为[Ar]
(2)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是
(3)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(4)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为
您最近一年使用:0次



