钒(V)固氮酶种类众多,其中种结构如图所示:
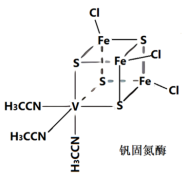
(1)基态钒原子的核外电子排布式为____ ,该元素位于元素周期表的第___ 族。
(2)配体CH3CN中所含σ键与π键数目之比为_______ 。
(3)钒固氮酶中钒的配位原子有_____ (写元素符号)。
(4)CO2、SiO2、SO2三种氧化物组成相似,但键角不同,键角由大到小的顺序为__ ;其中某一氧化物键角最大,原因是__ 。
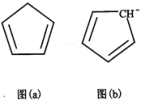
(5)环戊二烯(C5H6)结构如图( a ),可用于制二茂铁。分子中的大π键可用符号 表示,其 m 代表参与形成大π键的原子数,n 代表参与形成大π键的电子数,环戊二烯负离子(C5H
表示,其 m 代表参与形成大π键的原子数,n 代表参与形成大π键的电子数,环戊二烯负离子(C5H )结构如图(b),其中的大π键可以表示为
)结构如图(b),其中的大π键可以表示为 ____ 。

(1)基态钒原子的核外电子排布式为
(2)配体CH3CN中所含σ键与π键数目之比为
(3)钒固氮酶中钒的配位原子有
(4)CO2、SiO2、SO2三种氧化物组成相似,但键角不同,键角由大到小的顺序为
(5)环戊二烯(C5H6)结构如图( a ),可用于制二茂铁。分子中的大π键可用符号
 表示,其 m 代表参与形成大π键的原子数,n 代表参与形成大π键的电子数,环戊二烯负离子(C5H
表示,其 m 代表参与形成大π键的原子数,n 代表参与形成大π键的电子数,环戊二烯负离子(C5H )结构如图(b),其中的大π键可以表示为
)结构如图(b),其中的大π键可以表示为 
更新时间:2021-04-23 16:29:26
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)B元素基态原子中能量最高的电子的电子云在空间有_______ 个伸展方向,原子轨道呈_______ 形。
(2)E位于第_______ 族_______ 区,该元素原子的核外电子排布式为_______ 。
(3)已知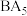 为离子化合物,写出其电子式:
为离子化合物,写出其电子式:_______ 。
(4)检验D元素的方法是_______ ,请用原子结构的知识解释产生此现象的原因:_______ 。
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
C元素的第一至第四电离能如下: 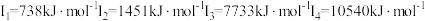 |
| D是前四周期中电负性最小的元素 |
| E在周期表的第七列 |
(2)E位于第
(3)已知
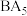 为离子化合物,写出其电子式:
为离子化合物,写出其电子式:(4)检验D元素的方法是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】早在1914年就有人发现,引入有机基团可降低离子化合物的熔点,如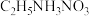 的熔点只有12℃,比
的熔点只有12℃,比 的熔点170℃低了很多。到20世纪90年代,人们把室温或稍高于室温时呈液态的离子化合物定义为离子液体。大多数离子液体含有体积很大的阴、阳离子(如下图所示)。
的熔点170℃低了很多。到20世纪90年代,人们把室温或稍高于室温时呈液态的离子化合物定义为离子液体。大多数离子液体含有体积很大的阴、阳离子(如下图所示)。
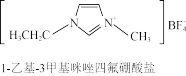
(1)1-乙基-3甲基咪唑四氟硼酸盐中涉及的元素除氢元素外,其余元素均位于元素周期表的___________ 区,基态F原子核外电子的运动状态有___________ 种。
(2) 极易溶于水且水溶液呈碱性的原因与氢键有关,用“…”表示氢键,结合
极易溶于水且水溶液呈碱性的原因与氢键有关,用“…”表示氢键,结合 的电离推测
的电离推测 可能的结构式为
可能的结构式为___________ 。
(3)硅元素与碳元素同主族,硅元素和卤素单质反应可以得到 。
。
 的熔沸点如下表所示
的熔沸点如下表所示
20℃时, 、
、 、
、 、
、 呈液态的是
呈液态的是___________ (填化学式),熔沸点依次升高的原因是___________ 。
(4)下列有关该离子液体说法正确的是___________。
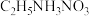 的熔点只有12℃,比
的熔点只有12℃,比 的熔点170℃低了很多。到20世纪90年代,人们把室温或稍高于室温时呈液态的离子化合物定义为离子液体。大多数离子液体含有体积很大的阴、阳离子(如下图所示)。
的熔点170℃低了很多。到20世纪90年代,人们把室温或稍高于室温时呈液态的离子化合物定义为离子液体。大多数离子液体含有体积很大的阴、阳离子(如下图所示)。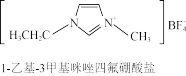
(1)1-乙基-3甲基咪唑四氟硼酸盐中涉及的元素除氢元素外,其余元素均位于元素周期表的
(2)
 极易溶于水且水溶液呈碱性的原因与氢键有关,用“…”表示氢键,结合
极易溶于水且水溶液呈碱性的原因与氢键有关,用“…”表示氢键,结合 的电离推测
的电离推测 可能的结构式为
可能的结构式为(3)硅元素与碳元素同主族,硅元素和卤素单质反应可以得到
 。
。 的熔沸点如下表所示
的熔沸点如下表所示 |  |  |  | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
 、
、 、
、 、
、 呈液态的是
呈液态的是(4)下列有关该离子液体说法正确的是___________。
A.该离子液体的阳离子中C原子和N原子的杂化轨道类型均为 、 、 |
B.离子液体中C、N、H三种元素的电负性由大到小的顺序为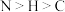 |
| C.该离子液体的熔沸点低于氯化钠晶体,是因为阴阳离子体积较大,使得阴阳离子间距离较大,离子键较弱 |
| D.离子液体中微粒间作用力较大,一般比有机溶剂难挥发,是很好的“绿色”溶剂 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】W、X、Y、Z、Q是原子序数依次增大的五种短周期元素,相关描述如下:
回答下列问题。
(1)写出W、Y的元素符号:W___________ 、Y___________ 。
(2)X元素位于周期表的___________ 区,Q元素的基态原子核外电子排布式是___________ 。
(3)X、Y、Z的电负性由大到小的顺序是___________ (填元素符号)。
(4)W的简单氢化物中心原子的杂化轨道类型为___________ ,分子的空间结构为___________ ,其中的键属于___________ 键(填“σ”或“π”)。
(5)W和X的氢化物相比,键长:W-H___________ X-H(填“>”或“<”);键能:W-H___________ X-H(填“>”或“<”)。
(6)由W、X、Y组成的化合物溶于水后,滴加酚酞呈红色,用化学用语解释原因___________ 。
(7)从电子排布的角度解释元素Z的第一电离能高于同周期相邻元素的原因___________ 。
| 元素 | 元素性质或原子结构 |
| W | 其价电子中,在不同形状的原子轨道中运动的电子数相等 |
| X | 原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能低于同周期相邻元素 |
| Y | 在同周期元素中,原子半径最大、第一电离能最小 |
| Z | 电离能/(kJ/mol)数据: ; ;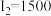 ; ; ; ;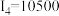 …… …… |
| Q | 最高能级有两对成对电子 |
(1)写出W、Y的元素符号:W
(2)X元素位于周期表的
(3)X、Y、Z的电负性由大到小的顺序是
(4)W的简单氢化物中心原子的杂化轨道类型为
(5)W和X的氢化物相比,键长:W-H
(6)由W、X、Y组成的化合物溶于水后,滴加酚酞呈红色,用化学用语解释原因
(7)从电子排布的角度解释元素Z的第一电离能高于同周期相邻元素的原因
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】物质的组成与结构决定了物质的性质与变化。请回答下列问题:
(1)C、H、N、O四种元素中电负性最大的是____ (填元素符号),写出Fe2+的最外层电子排布式_____ 。
(2)N、H两元素按原子数目比l∶3和2∶4构成分子A和B,A的中心原子的杂化方式是________ ,A的电子式为____________ ,B的结构式为____________ 。
(3)NO3-的空间构型为________ ;写出与NO3-互为等电子体的一种分子的化学式______ 。
(4)根据等电子原理,写出CN-的电子式______ ,HCN中心原子的杂化方式为________ 。
(5)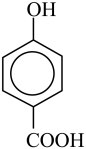 的沸点比
的沸点比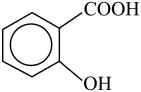
_______ (填“高”或“低”);原因是_____ 。
(1)C、H、N、O四种元素中电负性最大的是
(2)N、H两元素按原子数目比l∶3和2∶4构成分子A和B,A的中心原子的杂化方式是
(3)NO3-的空间构型为
(4)根据等电子原理,写出CN-的电子式
(5)
 的沸点比
的沸点比
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】A B C D E是前四周期元素,且原子序数依次增大。A的原子核中只有一个质子;B原子外围电子排布nSn nPn ;D原子核外有2个电子层,S轨道电子总数和P轨道电子总数相等;E2+ 的M能层上各能级的电子数之比为1:3:3 请回答下列问题:
(1)E原子基态电子排布式_______________________
(2)这五种元素中电负性最大的是________________ (填元素符号,下同)第一电离能最小的是__________________
(3)化合物EBC2中阴离子是BC22-,和BC2 2- 互为等电子体的分子有C2D和____________ ,由此可知BC2 2- 的空间构型是___________ 。
(4)由A C两元素形成一种10电子分子X,写出X的电子式_________
X可与多种金属离子形成配合物。钴有两种化学式均为Co(X)5BrSO4的配合物,且配位数均为6,则它们分别溶于水时电离出的阳离子的化学式可能是_______________ 和______________ ;
(5)A C两元素还能形成一种离子化合物,写出该化合物化学式__________ ;你认为该化合物中除了离子键外还存在化学键是__________________ ;该化合物溶于水有气体产生,写出反应化学方程式________________________
(1)E原子基态电子排布式
(2)这五种元素中电负性最大的是
(3)化合物EBC2中阴离子是BC22-,和BC2 2- 互为等电子体的分子有C2D和
(4)由A C两元素形成一种10电子分子X,写出X的电子式
X可与多种金属离子形成配合物。钴有两种化学式均为Co(X)5BrSO4的配合物,且配位数均为6,则它们分别溶于水时电离出的阳离子的化学式可能是
(5)A C两元素还能形成一种离子化合物,写出该化合物化学式
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】可以由下列反应合成三聚氰胺:CaO+3C CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2 CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[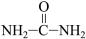 ],尿素合成三聚氰胺。
],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:____________________________ ;CaCN2中阴离子为CN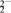 ,与CN22-互为等电子体的分子有CO2和
,与CN22-互为等电子体的分子有CO2和________ (填化学式),由此可以推知CN22-的空间构型为_______ 。
(2)尿素分子中C原子采取________ 杂化。
(3)三聚氰胺(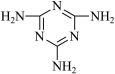 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (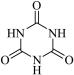 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过__________ 结合,在肾脏内易形成结石。
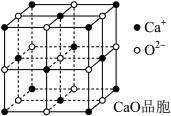
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为________ ,Ca2+采取的堆积方式为____________________________ ,每个Ca2+周围距离最近且相等的Ca2+有________ 个。
(5)CaO晶体和MgO晶体的晶格能分别为:CaO 3401 kJ·mol-1、MgO 3916 kJ·mol-1。导致两者晶格能差异的主要原因是___________________________________ 。
(6)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n=______________
 CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2 CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[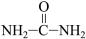 ],尿素合成三聚氰胺。
],尿素合成三聚氰胺。(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:
 ,与CN22-互为等电子体的分子有CO2和
,与CN22-互为等电子体的分子有CO2和(2)尿素分子中C原子采取
(3)三聚氰胺(
 )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 ( )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为

(5)CaO晶体和MgO晶体的晶格能分别为:CaO 3401 kJ·mol-1、MgO 3916 kJ·mol-1。导致两者晶格能差异的主要原因是
(6)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】我国科学家团队采用自激发缺陷诱导的方法获得白光,合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2[Sn(OH)6][B(OH)4]2。
(1)基态50Sn原子的价电子排布式为______ 。Ba、Sn、O三种元素的电负性由大到小的顺序为______ 。
(2)Na2[B4O5(OH)4]·8H2O(硼砂)的阴离子的结构式如图所示。则硼原子的杂化方式为______ ;硼砂中存在的作用力有______ (填标号)。
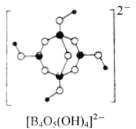
a.氢键 b.离子键 c.共价键 d.配位键
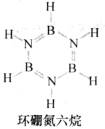
(3)环硼氮六烷(结构如图)在热水中比冷水中溶解度显著增大的主要原因是______ 。
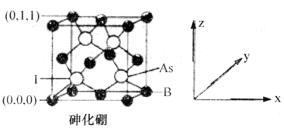
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为______ 。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为______ g·cm-3。(列出含a、NA的计算式即可)。
(1)基态50Sn原子的价电子排布式为
(2)Na2[B4O5(OH)4]·8H2O(硼砂)的阴离子的结构式如图所示。则硼原子的杂化方式为

a.氢键 b.离子键 c.共价键 d.配位键
(3)环硼氮六烷(结构如图)在热水中比冷水中溶解度显著增大的主要原因是

(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】硼及其化合物广泛应用于开发新型储氢材料、超导材料、复合材料等高新材料领域。回答下列问题:
(1)硼单质有晶体硼和无定形硼两种,区分二者最可靠的方法为___ 。
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),结构式如图1。氨硼烷分子含元素中电负性最小的元素是____ (填元素符号,下同)。
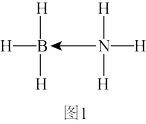
(3)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。
①1molNH4BF4含有___ mol配位键。
②NH4BF4中BF 的空间构型为
的空间构型为___ 。
(4)硼酸(H3BO3)是一种结构为片层状的白色晶体。层内的H3BO3分子间通过氢键相连(如图2),H3BO3分子中B的杂化轨道类型为___ ,0.6molH3BO3晶体中有___ mol氢键。硼酸晶体在冷水中溶解度很小,但在热水中溶解度很大原因是___ 。
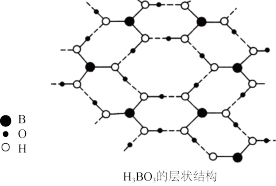
图2
(5)硼氢化钠是一种常用的还原剂,其晶胞结构如图3。
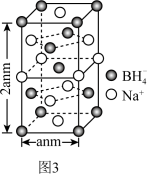
①该晶体中BH 的配位数为
的配位数为___ 。
②设NA为阿伏加德罗常数的值,则硼氢化钠晶体的密度ρ=___ (用含a、NA的最简式表示)g·cm-3。
(1)硼单质有晶体硼和无定形硼两种,区分二者最可靠的方法为
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),结构式如图1。氨硼烷分子含元素中电负性最小的元素是

(3)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。
①1molNH4BF4含有
②NH4BF4中BF
 的空间构型为
的空间构型为(4)硼酸(H3BO3)是一种结构为片层状的白色晶体。层内的H3BO3分子间通过氢键相连(如图2),H3BO3分子中B的杂化轨道类型为

图2
(5)硼氢化钠是一种常用的还原剂,其晶胞结构如图3。

①该晶体中BH
 的配位数为
的配位数为②设NA为阿伏加德罗常数的值,则硼氢化钠晶体的密度ρ=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】环烷酸金属(Cu、Ni、Co、Sn、Zn)盐常作为合成聚氨酯过程中的有效催化剂。回答下列问题:
(1) 与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验
与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验 。
。
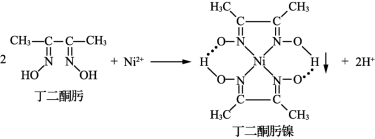
①基态 价电子排布式为
价电子排布式为_______ 。
②丁二酮肟镍分子中所含元素的电负性由大到小的顺序为_______ (填元素符号)。
③丁二酮肟镍分子内存在的化学键有_______ (填序号)。
A.离子键 B.配位键 C.氢键 D.范德华力
(2)镍能形成多种配合物,如 、
、 等。
等。
① 晶体中含有的σ键与π键数目之比为
晶体中含有的σ键与π键数目之比为_______ 。
② 中键角∠H‒N‒H
中键角∠H‒N‒H_______  分子中键角∠H‒N‒H(填“>”、“<”“=”)
分子中键角∠H‒N‒H(填“>”、“<”“=”)
(3)锡元素可形成白锡、灰锡、脆锡三种单质。其中灰锡晶体与金刚石结构相似,但灰锡不如金刚石稳定,试解释原因_______ 。
(4)硒化锌晶胞结构如图所示,其晶胞参数为a pm。
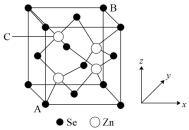
①相邻的 与
与 之间的距离为
之间的距离为_______ pm。
②已知原子坐标:A点为 ,B点为
,B点为 ,则C点的原子坐标
,则C点的原子坐标_______ 。
③若硒化锌晶体的密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
_______ (用含a、ρ的计算式表示)。
(1)
 与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验
与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验 。
。
①基态
 价电子排布式为
价电子排布式为②丁二酮肟镍分子中所含元素的电负性由大到小的顺序为
③丁二酮肟镍分子内存在的化学键有
A.离子键 B.配位键 C.氢键 D.范德华力
(2)镍能形成多种配合物,如
 、
、 等。
等。①
 晶体中含有的σ键与π键数目之比为
晶体中含有的σ键与π键数目之比为②
 中键角∠H‒N‒H
中键角∠H‒N‒H 分子中键角∠H‒N‒H(填“>”、“<”“=”)
分子中键角∠H‒N‒H(填“>”、“<”“=”)(3)锡元素可形成白锡、灰锡、脆锡三种单质。其中灰锡晶体与金刚石结构相似,但灰锡不如金刚石稳定,试解释原因
(4)硒化锌晶胞结构如图所示,其晶胞参数为a pm。

①相邻的
 与
与 之间的距离为
之间的距离为②已知原子坐标:A点为
 ,B点为
,B点为 ,则C点的原子坐标
,则C点的原子坐标③若硒化锌晶体的密度为
 ,则阿伏加德罗常数
,则阿伏加德罗常数
您最近一年使用:0次



