硅烷 可用于制造高纯硅。采用硅化镁法制备
可用于制造高纯硅。采用硅化镁法制备 的化学方程式如下:
的化学方程式如下:
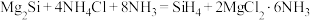
(1)硅在元素周期表中的位置是___________ ,基态硅原子占据的最高能级的符号是___________ 。
(2)O、N、H的电负性由大到小的顺序是___________ 。
(3)下列状态的氮中,电离最外层一个电子所需能量最小的是___________ (填序号)。
a.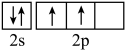 b.
b.  c.
c.
(4)① 的沸点比
的沸点比 的
的___________ (填“高”或“低”),原因是___________ 。
② 中H—Si—H的键角
中H—Si—H的键角___________  中H—N—H的键角(填“>”“<”或“=”),其键角差异的原因是
中H—N—H的键角(填“>”“<”或“=”),其键角差异的原因是___________ 。
(5) 可由Mg和
可由Mg和 反应制得。一种
反应制得。一种 晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是
晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是___________ 。

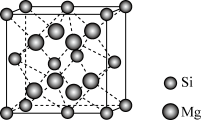
(6) 晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有
晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有___________ 个紧邻的Mg原子。已知 的晶胞边长为
的晶胞边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为___________  。
。
 可用于制造高纯硅。采用硅化镁法制备
可用于制造高纯硅。采用硅化镁法制备 的化学方程式如下:
的化学方程式如下: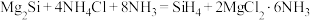
(1)硅在元素周期表中的位置是
(2)O、N、H的电负性由大到小的顺序是
(3)下列状态的氮中,电离最外层一个电子所需能量最小的是
a.
 b.
b.  c.
c.
(4)①
 的沸点比
的沸点比 的
的②
 中H—Si—H的键角
中H—Si—H的键角 中H—N—H的键角(填“>”“<”或“=”),其键角差异的原因是
中H—N—H的键角(填“>”“<”或“=”),其键角差异的原因是(5)
 可由Mg和
可由Mg和 反应制得。一种
反应制得。一种 晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是
晶体的结构中有顶角相连的硅氧四面体形成螺旋上升的长链(如下图)。其中Si原子的杂化轨道类型是
(6)
 晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有
晶体的晶胞示意图如下。每个Mg原子位于Si原子组成的四面体的中心。则1个Si原子周围有 的晶胞边长为
的晶胞边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为 。
。
更新时间:2024-03-02 19:18:27
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制。
(1)基态硫原子价层电子的轨道表达式(电子排布图)为________ ;Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为________
(2)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱____ >______
(3)H2S的键角_______ (填“大于”“小于”“等于”)H2O的键角,请从电负性的角度说明理由_____
(4)Cu3N的晶胞结构如图,N3-的配位数为______ ,Cu+半径为apm,N3-半径为bpm,阴阳离子看成刚性小球,并彼此相切,则Cu3N的密度为_____ g·cm-3。(阿伏加德罗常数用NA表示,列出表达式即可)

(1)基态硫原子价层电子的轨道表达式(电子排布图)为
(2)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱
(3)H2S的键角
(4)Cu3N的晶胞结构如图,N3-的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】铝、硅、磷三种元素的单质及其化合物在生产生活中有广泛应用。
(1)基态硅原子的价电子的轨道表达式_______ ;第三周期元素中第一电离能介于铝和磷元素之间的有_______ (填元素符号)。
(2)比较铝、磷元素的简单离子半径_______ (用相关化学符号表示)。
(3)下列关于三种元素的化合物的叙述正确的是_______ 。
①三种元素的最高价氧化物均能与水直接化合
②三种元素的最高价氧化物均存在晶体形式,且晶体类型不同
③ 、
、 均既能与酸又能与碱反应,均属于两性氧化物
均既能与酸又能与碱反应,均属于两性氧化物
(4) 与
与 比较,沸点较高的是
比较,沸点较高的是_______ ,两种分子中键角较大的是_______ ,其中 的分子构型为
的分子构型为_______ 。
(5)三种单质的晶胞结构如下
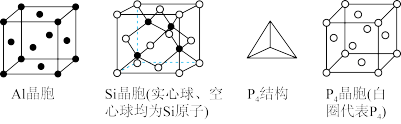
这三种晶胞中的原子的个数比为_______ 。
(6)①工业由粗硅制高纯硅的化学方程式_______ 。
②利用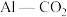 电池(工作原理如下图所示)能有效地将
电池(工作原理如下图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝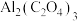 ,根据图示,下列表述正确的是
,根据图示,下列表述正确的是_______ 。

A.该电池的使用可有效利用
B.电池工作时,电流从铝电极流向多孔碳电极
C. 在整个反应过程中的作用是催化剂
在整个反应过程中的作用是催化剂
D.含 的离子液体是熔融态的
的离子液体是熔融态的
(1)基态硅原子的价电子的轨道表达式
(2)比较铝、磷元素的简单离子半径
(3)下列关于三种元素的化合物的叙述正确的是
①三种元素的最高价氧化物均能与水直接化合
②三种元素的最高价氧化物均存在晶体形式,且晶体类型不同
③
 、
、 均既能与酸又能与碱反应,均属于两性氧化物
均既能与酸又能与碱反应,均属于两性氧化物(4)
 与
与 比较,沸点较高的是
比较,沸点较高的是 的分子构型为
的分子构型为(5)三种单质的晶胞结构如下

这三种晶胞中的原子的个数比为
(6)①工业由粗硅制高纯硅的化学方程式
②利用
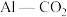 电池(工作原理如下图所示)能有效地将
电池(工作原理如下图所示)能有效地将 转化成化工原料草酸铝
转化成化工原料草酸铝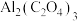 ,根据图示,下列表述正确的是
,根据图示,下列表述正确的是
A.该电池的使用可有效利用

B.电池工作时,电流从铝电极流向多孔碳电极
C.
 在整个反应过程中的作用是催化剂
在整个反应过程中的作用是催化剂D.含
 的离子液体是熔融态的
的离子液体是熔融态的
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】根据要求回答问题。
(1)基态锰原子的价电子排布式为___________ ,第四周期元素的基态原子核外单电子数与基态钴原子相同的是___________ (填元素符号)。
(2)Cu、Fe的第二电离能: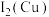
___________ 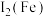 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
(3)氧和硫同族,但是它们简单氢化物的键角不同,原因是___________ 。
(4)氧和同族元素能形成多种化合物,如 、
、 ,二者分子中S和Se的价层电子对数分别为
,二者分子中S和Se的价层电子对数分别为___________ 、___________ 。
(5)基态Mo原子的价电子排布为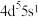 ,其位于元素周期表
,其位于元素周期表___________ 区,最高化合价为___________ 。
(1)基态锰原子的价电子排布式为
(2)Cu、Fe的第二电离能:
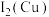
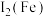 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。(3)氧和硫同族,但是它们简单氢化物的键角不同,原因是
(4)氧和同族元素能形成多种化合物,如
 、
、 ,二者分子中S和Se的价层电子对数分别为
,二者分子中S和Se的价层电子对数分别为(5)基态Mo原子的价电子排布为
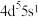 ,其位于元素周期表
,其位于元素周期表
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】H、C、N、O、F、Se 是六种重要的非金属元素。请根据所学的物质结构与性质的相关知识回答下列问题:
(1)基态氮原子最高能级上电子的自旋方向有________ 种,基态硒原子的价层电子排布式为________ ,N元素第一电离能大于O元素第一电离能的原因为____________ 。
(2)某高效低毒的新型农药的结构简式为 ,则该物质中氮原子的杂化轨道类型为
,则该物质中氮原子的杂化轨道类型为________ ,其分子之间________ (填“ 能”或“不能” )形成氢键。
(3)SeO2、SeO2两种分子中,属于非极性分子的是________ ,SeO2的空间构型为________ ,与SeO3互为等电子体的分子和离子为________ 。(各写一种)
(4)氮化硼(BN)晶体有多种结构,六方相氮化硼(晶体结构如图1)是通常存在的稳定相,可作高温润滑剂,立方相氮化硼(晶体结构如图2)是超硬材料,有优异的耐磨性。

①下列关于这两种晶体的说法正确的是________ (填字母)。
a.两种晶体存在的作用力相同 b.立方氮化硼晶体可用于生产金属切割刀片
c.六方相氮化硼层间作用力小,所以质地软 d.立方相氮化硼含有σ键和π键,所以硬度大
②若图2中晶胞的边长为anm,密度为ρg·cm -3,则阿伏伽德罗常数的值为________ 。
(1)基态氮原子最高能级上电子的自旋方向有
(2)某高效低毒的新型农药的结构简式为
 ,则该物质中氮原子的杂化轨道类型为
,则该物质中氮原子的杂化轨道类型为(3)SeO2、SeO2两种分子中,属于非极性分子的是
(4)氮化硼(BN)晶体有多种结构,六方相氮化硼(晶体结构如图1)是通常存在的稳定相,可作高温润滑剂,立方相氮化硼(晶体结构如图2)是超硬材料,有优异的耐磨性。

①下列关于这两种晶体的说法正确的是
a.两种晶体存在的作用力相同 b.立方氮化硼晶体可用于生产金属切割刀片
c.六方相氮化硼层间作用力小,所以质地软 d.立方相氮化硼含有σ键和π键,所以硬度大
②若图2中晶胞的边长为anm,密度为ρg·cm -3,则阿伏伽德罗常数的值为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】由IIA元素与VA元素所形成的化合物种类繁多,它们是探测器、激光器、微波器的重要材料。回答下列问题:
(1)氧原子价电子层上的电子可以进行重排以便提供一个空轨道与氮原子形成配位键,该氧原子重排后的价电子排布图为_______ ,电子重排后的氧原子能量有所升高,原因是不符合_______ (填“泡利原理”或“洪特规则”)。
(2)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据下表数据分析其原因是_______ 。
(3)比较大小:键角CH4_______ (填“>”或“<”)NH3
(4)如图为四硼酸根离子球棍模型,该离子符号为_______ ,其中硼原子轨道的杂化类型有_______ 。
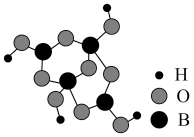
(5)叠氮酸铵(NH4N3)是一种具有爆炸性的无色晶体。叠氮酸根(N )的空间结构为
)的空间结构为_______ ;叠氮酸铵的晶胞如图所示,其晶胞参数为a nm和0.5a nm,阿伏加德罗常数的值为NA,NH4N3的密度为_______ g·cm-3。
(1)氧原子价电子层上的电子可以进行重排以便提供一个空轨道与氮原子形成配位键,该氧原子重排后的价电子排布图为
(2)自然界中不存在单质硼,硼的氢化物也很少,主要存在的是硼的含氧化合物,根据下表数据分析其原因是
| 化学键 | B-H | B-O | B-B |
| 键能(kJ∙mol-1) | 389 | 561 | 293 |
(3)比较大小:键角CH4
(4)如图为四硼酸根离子球棍模型,该离子符号为

(5)叠氮酸铵(NH4N3)是一种具有爆炸性的无色晶体。叠氮酸根(N
 )的空间结构为
)的空间结构为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
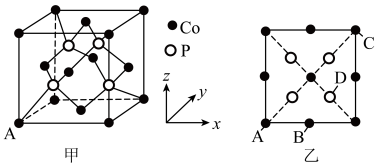
【推荐3】江西矿产资源丰富,其中铁、锰、钛、钒、铜、锌、金、银等储量居全国前3位,有亚洲最大的铜矿和中国最大的铜冶炼基地。回答下列问题:
(1)Ni元素在元素周期表中位置___________ 。
(2)[Cu(NH3)4]Cl2是一种常见农药,能防治真菌、细菌和霉菌引起的多种病害。
①1mol[Cu(NH3)4]Cl2中含有的σ键数目为___________ NA;NH3分子与Cu2+形成配合物后H-N-H键角___________ (填“变大”“变小”或“不变”)。
②已知[Cu(NH3)4]2+呈平面正方形,则Cu2+的杂化方式可能为___________ (填标号)。
A.sp3 B.dsp2 C.sp2 D.sp
(3)Cu与Fe的第二电离能分别为I2(Cu)=1958kJ•mol﹣1、I2(Fe)=1561kJ•mol﹣1,I2(Cu)大于I2(Fe)的主要原因是___________ 。
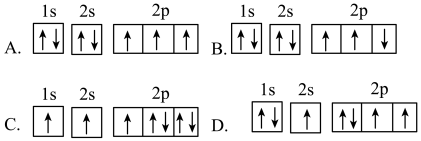
(4)在第二周期中,第一电离能比N高的元素是___________ 。氮原子的电子排布图表示的状态中,能量由低到高的顺序是___________ (填序号)。 ,0,
,0, ),则D点坐标为
),则D点坐标为___________ 。
②已知该晶体的密度为ρg•cm-3,设NA表示阿伏加德罗常数的值,则该晶胞中距离最近的Co原子之间的距离为___________ nm(用含ρ、NA的计算式表示)。
(1)Ni元素在元素周期表中位置
(2)[Cu(NH3)4]Cl2是一种常见农药,能防治真菌、细菌和霉菌引起的多种病害。
①1mol[Cu(NH3)4]Cl2中含有的σ键数目为
②已知[Cu(NH3)4]2+呈平面正方形,则Cu2+的杂化方式可能为
A.sp3 B.dsp2 C.sp2 D.sp
(3)Cu与Fe的第二电离能分别为I2(Cu)=1958kJ•mol﹣1、I2(Fe)=1561kJ•mol﹣1,I2(Cu)大于I2(Fe)的主要原因是
(4)在第二周期中,第一电离能比N高的元素是
 ,0,
,0, ),则D点坐标为
),则D点坐标为②已知该晶体的密度为ρg•cm-3,设NA表示阿伏加德罗常数的值,则该晶胞中距离最近的Co原子之间的距离为
您最近一年使用:0次
【推荐1】氢能被视为21世纪最具发展潜力的清洁能源。
(1)水是制取H2的常见原料,下列有关水的说法正确的是______ .
a.水分子是一种极性分子,水分子空间结构呈直线型
b.1个H2O分子中有2个由s轨道与sp3杂化轨道形成的σ键
c.水分子间通过H﹣O键形成冰晶体
d.冰晶胞中水分子的空间排列方式与干冰晶胞类似
(2)氢气的安全贮存和运输是氢能应用的关键。
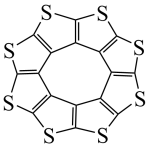
①最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(如图1所示),每个平面上下两侧最多可存10个H2分子.分子中C原子的杂化轨道类型为______ ,C16S8中σ键与π键之比为______ ,C16S8与H2微粒间的作用力是______ 。
②氨硼烷化合物(NH3BH3)是最近密切关注的一种新型化学氢化物储氢材料.请画出含有配位键(用“→”表示)的氨硼烷的结构式_____ ;与氨硼烷互为等电子体的有机小分子是___ (写结构简式)。
③某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(晶胞结构如图)的结构相似,该晶体储氢后Cu:Au:H为______ 。
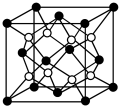
④MgH2是金属氢化物储氢材料,其晶胞如图所示,已知该晶体的密度ag·cm-3,则晶胞的体积为______________ cm3(用含a、NA的代数式表示,NA表示阿伏加 德罗常数)。

(1)水是制取H2的常见原料,下列有关水的说法正确的是
a.水分子是一种极性分子,水分子空间结构呈直线型
b.1个H2O分子中有2个由s轨道与sp3杂化轨道形成的σ键
c.水分子间通过H﹣O键形成冰晶体
d.冰晶胞中水分子的空间排列方式与干冰晶胞类似
(2)氢气的安全贮存和运输是氢能应用的关键。
①最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(如图1所示),每个平面上下两侧最多可存10个H2分子.分子中C原子的杂化轨道类型为

②氨硼烷化合物(NH3BH3)是最近密切关注的一种新型化学氢化物储氢材料.请画出含有配位键(用“→”表示)的氨硼烷的结构式
③某种具有储氢功能的铜合金晶体具有立方最密堆积的结构,晶胞中Cu原子处于面心,Au原子处于顶点位置,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(晶胞结构如图)的结构相似,该晶体储氢后Cu:Au:H为

④MgH2是金属氢化物储氢材料,其晶胞如图所示,已知该晶体的密度ag·cm-3,则晶胞的体积为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等领域。回答下列问题:
(1)基态Ti原子的核外电子排布式为___________ 。
(2)钛与卤素形成的化合物TiX4熔点如下表:
解释TiX4熔点差异的原因___________ 。
(3) TiCl4能与甲胺(CH3NH2)形成稳定的配合物[TiCl4(CH3NH2)2]。
①甲胺中N原子的杂化方式为___________ 。
②CH3NH2中H-N-H键角比[TiCl4(CH3NH2)2]中H-N-H键角小,从结构角度解释原因___________ 。
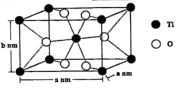
(4)TiO2的化学性质非常稳定,广泛用于涂料、橡胶和造纸等工业。
①向TiCl4中加入大量的水,可制得TiO2∙xH2O,该反应的化学方程式为___________ ,所得TiO2∙xH2O经焙烧得到TiO2。
②金红石型TiO2的晶胞为长方体,晶胞参数如图所示。TiO2的摩尔质量为80 g∙mol-1,阿伏加德罗常数为NA,该晶体的密度为___________ g∙cm-3。
(5)Ti(SO4)2是有机合成中常见的催化剂。测定Ti(SO4)2溶液物质的量浓度的方法为:
ⅰ.取5mL待测液于烧杯中,加入足量铝粉,充分反应;
ⅱ.将所得混合物过滤、洗涤,将滤液和洗涤液合并,转移到锥形瓶中,加水稀释到25mL;
ⅲ.向锥形瓶中滴加2滴KSCN溶液;
ⅳ.用cmol/LFe2(SO4)3溶液滴定,滴定终点时消耗Fe2(SO4)3溶液VmL。
已知: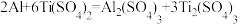
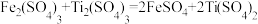
①滴定终点时的现象为___________ 。
②待测液中Ti(SO4)2的浓度为___________  。
。
(1)基态Ti原子的核外电子排布式为
(2)钛与卤素形成的化合物TiX4熔点如下表:
| TiX4 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24 | 38.3 | 153 |
(3) TiCl4能与甲胺(CH3NH2)形成稳定的配合物[TiCl4(CH3NH2)2]。
①甲胺中N原子的杂化方式为
②CH3NH2中H-N-H键角比[TiCl4(CH3NH2)2]中H-N-H键角小,从结构角度解释原因
(4)TiO2的化学性质非常稳定,广泛用于涂料、橡胶和造纸等工业。
①向TiCl4中加入大量的水,可制得TiO2∙xH2O,该反应的化学方程式为
②金红石型TiO2的晶胞为长方体,晶胞参数如图所示。TiO2的摩尔质量为80 g∙mol-1,阿伏加德罗常数为NA,该晶体的密度为

(5)Ti(SO4)2是有机合成中常见的催化剂。测定Ti(SO4)2溶液物质的量浓度的方法为:
ⅰ.取5mL待测液于烧杯中,加入足量铝粉,充分反应;
ⅱ.将所得混合物过滤、洗涤,将滤液和洗涤液合并,转移到锥形瓶中,加水稀释到25mL;
ⅲ.向锥形瓶中滴加2滴KSCN溶液;
ⅳ.用cmol/LFe2(SO4)3溶液滴定,滴定终点时消耗Fe2(SO4)3溶液VmL。
已知:
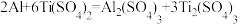
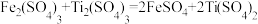
①滴定终点时的现象为
②待测液中Ti(SO4)2的浓度为
 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】镓、锗是重要的半导体材料。中国是全球最大的镓、锗生产国,也是最大的出口国。2022年,中国镓产量占全球的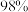 、精炼锗产量占全球
、精炼锗产量占全球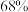 。
。
(1)基态镓 原子核外价电子的轨道表示式为
原子核外价电子的轨道表示式为_____ ;同周期主族元素基态原子与其具有相同数目未成对电子的有_____ (填元素符号)。
(2)按照核外电子的排布,可将元素周期表划分为4个区, 属于_____。
属于_____。
(3)用原子光谱分析法可以确定元素种类。 元素的光谱不可能是_____。
元素的光谱不可能是_____。
(4)与镓同族元素硼可以形成一系列的硼氢化合物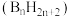 称为硼烷,随着硼原子数的增加,硼烷由气态经液态至固态,其原因是
称为硼烷,随着硼原子数的增加,硼烷由气态经液态至固态,其原因是_____ 。
 、精炼锗产量占全球
、精炼锗产量占全球 。
。(1)基态镓
 原子核外价电子的轨道表示式为
原子核外价电子的轨道表示式为(2)按照核外电子的排布,可将元素周期表划分为4个区,
 属于_____。
属于_____。A. 区 区 | B. 区 区 | C. 区 区 | D. 区 区 |
 元素的光谱不可能是_____。
元素的光谱不可能是_____。| A.发射光谱 | B.吸收光谱 | C.线光谱 | D.连续光谱 |
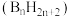 称为硼烷,随着硼原子数的增加,硼烷由气态经液态至固态,其原因是
称为硼烷,随着硼原子数的增加,硼烷由气态经液态至固态,其原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】全球首次在350公里时速的奥运版复兴号高铁列车上依托5G技术打造的超高清直播演播室,实现了超高清信号的长时间稳定传输。请回答下列问题:
(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有___________ 种。
(2)高纯硅制备过程中会有 、
、 等中间产物生成。沸点:
等中间产物生成。沸点:
___________  (填“>”或“<”),与
(填“>”或“<”),与 互为等电子体的离子为
互为等电子体的离子为___________ (任写1种即可)。已知电负性:H>Si,则 充分水解的化学方程式为
充分水解的化学方程式为___________ 。
(3)复兴号高铁车体材质用到Mn、Co等元素。
①Mn的一种配合物化学式为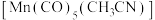 ,下列说法正确的是
,下列说法正确的是____ (填字母标号)。
A. 与Mn原子配位时,提供孤电子对的是C原子
与Mn原子配位时,提供孤电子对的是C原子
B.Mn原子的配位数为6
C. 中C原子的杂化类型为
中C原子的杂化类型为 、
、
D. 中
中 键与
键与 键数目之比为5∶2
键数目之比为5∶2
② 的原因是
的原因是____ 。
③已知 ,
, ,推测
,推测 比
比 的分解温度
的分解温度____ (填“高”或“低”)。
(4)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图),晶胞参数(晶胞边长)为 ,其中阴离子
,其中阴离子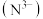 采用面心立方最密堆积方式,则
采用面心立方最密堆积方式,则 为
为___________ m;阿伏加德罗常数的值为 ,则该氮化钛的密度
,则该氮化钛的密度____  (列出计算式即可)。
(列出计算式即可)。

(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有
(2)高纯硅制备过程中会有
 、
、 等中间产物生成。沸点:
等中间产物生成。沸点:
 (填“>”或“<”),与
(填“>”或“<”),与 互为等电子体的离子为
互为等电子体的离子为 充分水解的化学方程式为
充分水解的化学方程式为(3)复兴号高铁车体材质用到Mn、Co等元素。
①Mn的一种配合物化学式为
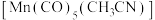 ,下列说法正确的是
,下列说法正确的是A.
 与Mn原子配位时,提供孤电子对的是C原子
与Mn原子配位时,提供孤电子对的是C原子B.Mn原子的配位数为6
C.
 中C原子的杂化类型为
中C原子的杂化类型为 、
、
D.
 中
中 键与
键与 键数目之比为5∶2
键数目之比为5∶2②
 的原因是
的原因是③已知
 ,
, ,推测
,推测 比
比 的分解温度
的分解温度(4)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图),晶胞参数(晶胞边长)为
 ,其中阴离子
,其中阴离子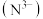 采用面心立方最密堆积方式,则
采用面心立方最密堆积方式,则 为
为 ,则该氮化钛的密度
,则该氮化钛的密度 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】Ti及其化合物在航天工业上有重要的应用,回答下列问题:
(1)基态Ti原子的价电子排布式为_______ ,基态Ti原子核外存在_______ 对自旋相反的电子。
(2)TiCl4熔点为−23℃,沸点为136℃,TiCl4晶体属于_______ 晶体。TiCl4可由TiO2与COCl2在一定条件下反应得到,反应的化学方程式为_______ ,COCl2中共价键类型为_______ ,C原子的杂化轨道类型是_______ ,与COCl2互为等电子体的分子为_______ 。C、O、Cl的电负性由小到大的顺序为_______ 。
(3)金红石型TiO2晶胞如图,如果晶胞的边长为apm,则它的密度为_______ g/cm3(列出计算式即可)。

(1)基态Ti原子的价电子排布式为
(2)TiCl4熔点为−23℃,沸点为136℃,TiCl4晶体属于
(3)金红石型TiO2晶胞如图,如果晶胞的边长为apm,则它的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2 [Sn(OH) 6][B (OH)4] 2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)基态Sn原子价层电子的空间运动状态有______ 种,基态氧原子的价层电子排布式不能表示为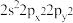 ,因为这违背了
,因为这违背了______ 原理(规则)。
(2)[B(OH)4] -中氧原子的杂化轨道类型为______ ,[B(OH)4] -的空间构型为______ (写名称)。 [Sn(OH)6] 2-中,Sn与O之间的化学键不可能是______ 。
a.π键 b. σ键 c. 配位键 d. 极性键
(3)碳酸钡、碳酸镁分解得到的金属氧化物中,分解温度较低的是______ (填化学式),其原因是______ 。
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为______ 。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为______ g·cm-3(列出含a、NA的计算式即可)。

(1)基态Sn原子价层电子的空间运动状态有
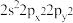 ,因为这违背了
,因为这违背了(2)[B(OH)4] -中氧原子的杂化轨道类型为
a.π键 b. σ键 c. 配位键 d. 极性键
(3)碳酸钡、碳酸镁分解得到的金属氧化物中,分解温度较低的是
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为

您最近一年使用:0次



