天然气的主要成分是CH4,是一种重要的燃料和化工原料,工业上可用天然气为原料制取一氧化碳和氢气。
(1)已知:①CH4(g)+ O2(g)⇌CO(g)+2H2O(g) K1 ∆H1=-519 kJ∙mol-1。
O2(g)⇌CO(g)+2H2O(g) K1 ∆H1=-519 kJ∙mol-1。
②H2(g)+ O2(g)⇌H2O(g) K2 ∆H2=-242 kJ∙mol-1
O2(g)⇌H2O(g) K2 ∆H2=-242 kJ∙mol-1
反应③CH4(g)+H2O(g)⇌CO(g)+3H2(g)的∆H3=___________ kJ∙mol-1,平衡常数K3=___________ (用K1、K2表示)。该反应在___________ (填“低温”、“高温”或“任何温度”)条件下自发进行。
(2)一定温度下,将2 mol CH4(g)与2 mol H2O(g)置于2 L密闭容器中发生反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。
①下列可判断反应达到平衡状态的是___________ (填字母)。
A.混合气体的平均相对分子质量不变 B.混合气体的密度保持不变
C.CH4和H2O的物质的量之比保持不变 D.v正(H2O)=3v逆(H2)
②若该反应初始混合气中的n(H2O)/n(CH4)恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
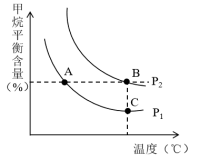
图中两条曲线表示的压强的关系是:P1___________ P2(填“>”“=”或“<”)。图中A、B、C三点平衡常数KA、KB、KC的大小关系是___________ 。
③某学习小组的同学模拟其原理,在一定温度下,体积为2 L的恒容密闭容器中测得如下表所示数据。
分析表中数据,判断5 min时反应是否处于平衡状态___________ (填“是”或“否”),前5 min反应的平均反应速率
___________  。
。
(1)已知:①CH4(g)+
 O2(g)⇌CO(g)+2H2O(g) K1 ∆H1=-519 kJ∙mol-1。
O2(g)⇌CO(g)+2H2O(g) K1 ∆H1=-519 kJ∙mol-1。②H2(g)+
 O2(g)⇌H2O(g) K2 ∆H2=-242 kJ∙mol-1
O2(g)⇌H2O(g) K2 ∆H2=-242 kJ∙mol-1反应③CH4(g)+H2O(g)⇌CO(g)+3H2(g)的∆H3=
(2)一定温度下,将2 mol CH4(g)与2 mol H2O(g)置于2 L密闭容器中发生反应:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。
①下列可判断反应达到平衡状态的是
A.混合气体的平均相对分子质量不变 B.混合气体的密度保持不变
C.CH4和H2O的物质的量之比保持不变 D.v正(H2O)=3v逆(H2)
②若该反应初始混合气中的n(H2O)/n(CH4)恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:

图中两条曲线表示的压强的关系是:P1
③某学习小组的同学模拟其原理,在一定温度下,体积为2 L的恒容密闭容器中测得如下表所示数据。
| 时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | 0.20 | 0.60 |
| 7 | 0.20 | b | 0.20 | d |

 。
。
更新时间:2024-01-23 15:09:45
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】高纯硅用途广泛, 是制备高纯硅的主要原料,制备
是制备高纯硅的主要原料,制备 主要有以下工艺。
主要有以下工艺。

I.热氢化法:在 条件下,
条件下, 和
和 在热氢化炉内反应。
在热氢化炉内反应。
(1)已知热氢化法制 有两种反应路径,反应进程如图所示,若从反应能量角度考虑,该过程更优的路径是
有两种反应路径,反应进程如图所示,若从反应能量角度考虑,该过程更优的路径是_______ (填“a”或“b”)。
Ⅱ.氯氢化法:反应原理为 。
。
(2)在恒温恒容条件下,该反应达到化学平衡状态,下列说法正确的是_______ 。
A. 和
和 的物质的量浓度之比为
的物质的量浓度之比为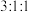
B.向体系中充入 ,反应速率增大,平衡常数增大
,反应速率增大,平衡常数增大
C.向反应体系充入惰性气体,平衡不发生移动
D.移除部分 ,逆反应速率减小,平衡向正反应方向移动
,逆反应速率减小,平衡向正反应方向移动
E.该反应在高温下自发进行
Ⅲ.冷氢化法:在一定条件下发生如下反应
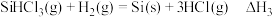
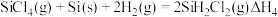
(3)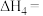
_______ 。(写出代数式)
(4)已知反应i和反应 的压强平衡常数的负对数随着温度的变化如图所示,反应
的压强平衡常数的负对数随着温度的变化如图所示,反应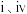 中,属于放热反应的是
中,属于放热反应的是_______ 。(填序号)

Ⅳ.锌还原法:发生以下反应
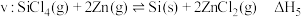

(5)一定温度下,向恒容密闭容器中充入 和
和 的混合气体,发生反应v和
的混合气体,发生反应v和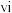 ,反应
,反应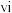 的净速率
的净速率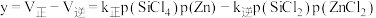 ,其中
,其中 分别为正、逆反应的速率常数,p为气体的分压。降低温度时
分别为正、逆反应的速率常数,p为气体的分压。降低温度时
_______ (填“增大”“减小”或“不变”)。
 是制备高纯硅的主要原料,制备
是制备高纯硅的主要原料,制备 主要有以下工艺。
主要有以下工艺。
I.热氢化法:在
 条件下,
条件下, 和
和 在热氢化炉内反应。
在热氢化炉内反应。(1)已知热氢化法制
 有两种反应路径,反应进程如图所示,若从反应能量角度考虑,该过程更优的路径是
有两种反应路径,反应进程如图所示,若从反应能量角度考虑,该过程更优的路径是Ⅱ.氯氢化法:反应原理为
 。
。(2)在恒温恒容条件下,该反应达到化学平衡状态,下列说法正确的是
A.
 和
和 的物质的量浓度之比为
的物质的量浓度之比为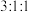
B.向体系中充入
 ,反应速率增大,平衡常数增大
,反应速率增大,平衡常数增大C.向反应体系充入惰性气体,平衡不发生移动
D.移除部分
 ,逆反应速率减小,平衡向正反应方向移动
,逆反应速率减小,平衡向正反应方向移动E.该反应在高温下自发进行
Ⅲ.冷氢化法:在一定条件下发生如下反应
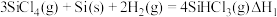
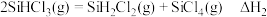
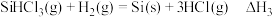
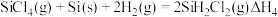
(3)
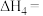
(4)已知反应i和反应
 的压强平衡常数的负对数随着温度的变化如图所示,反应
的压强平衡常数的负对数随着温度的变化如图所示,反应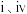 中,属于放热反应的是
中,属于放热反应的是
Ⅳ.锌还原法:发生以下反应
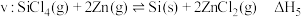

(5)一定温度下,向恒容密闭容器中充入
 和
和 的混合气体,发生反应v和
的混合气体,发生反应v和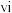 ,反应
,反应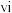 的净速率
的净速率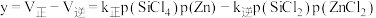 ,其中
,其中 分别为正、逆反应的速率常数,p为气体的分压。降低温度时
分别为正、逆反应的速率常数,p为气体的分压。降低温度时
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ.用太阳能分解水制备 是一项新技术,其过程如图:
是一项新技术,其过程如图:
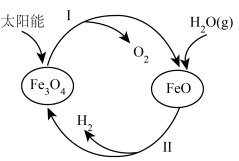
已知:
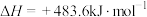
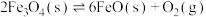
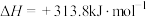
(1)过程Ⅱ的热化学方程式为___________ 。
Ⅱ.生物材质(以C计)与水蒸气反应制取是一种低耗能,高效率的制方法。该方法由气化炉制造和燃烧炉再生 两步构成。其中气化炉中涉及的反应有:
两步构成。其中气化炉中涉及的反应有:
① ;
;
② ;
;
③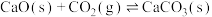 ;
;
(2)该工艺制 总反应可表示为
总反应可表示为 ,其反应的平衡常数
,其反应的平衡常数
___________ (用 、
、 、
、 的代数式表示)。
的代数式表示)。
(3)在一容积可变的密闭容器中进行反应①。恒温恒压条件下,向其中加入 碳和
碳和 水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为
水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为___________ ;向该容器中补充 炭,水蒸气的转化率将
炭,水蒸气的转化率将___________ (填“增大”、“减小”或“不变”)。
(4)恒温恒容条件下,对于反应③,若平衡时再充入 ,使其浓度增大到原来的2倍,则平衡
,使其浓度增大到原来的2倍,则平衡___________ 移动(填“向右”、“向左”或“不”);当重新平衡后, 浓度
浓度___________ (填“变大”“变小”或“不变”)。
Ⅰ.用太阳能分解水制备
 是一项新技术,其过程如图:
是一项新技术,其过程如图:
已知:

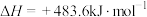
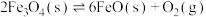
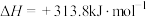
(1)过程Ⅱ的热化学方程式为
Ⅱ.生物材质(以C计)与水蒸气反应制取是一种低耗能,高效率的制方法。该方法由气化炉制造和燃烧炉再生
 两步构成。其中气化炉中涉及的反应有:
两步构成。其中气化炉中涉及的反应有:①
 ;
;②
 ;
;③
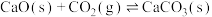 ;
;(2)该工艺制
 总反应可表示为
总反应可表示为 ,其反应的平衡常数
,其反应的平衡常数
 、
、 、
、 的代数式表示)。
的代数式表示)。(3)在一容积可变的密闭容器中进行反应①。恒温恒压条件下,向其中加入
 碳和
碳和 水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为
水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为 炭,水蒸气的转化率将
炭,水蒸气的转化率将(4)恒温恒容条件下,对于反应③,若平衡时再充入
 ,使其浓度增大到原来的2倍,则平衡
,使其浓度增大到原来的2倍,则平衡 浓度
浓度
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】硫化氢俗称“臭蛋气”,是一种无色具有臭鸡蛋气味的剧毒气体,由含硫物质分解而来,属于常见的酸性有害气体中的一种。研究硫化氢的利用及污染的防治很有意义。
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH1=-1123.6kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH2=-296kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ·mol-1
写出H2S分解为单质硫(用S表示)和H2的热化学方程式:___ 。
(2)H2S在一定条件下发生如下形式的分解:2H2S(g) S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。

①温度升高时,混合气体的平均摩尔质量减小的原因是___ 。
②P点时容器内气体压强与起始时气体压强之比为___ 。
③1050℃时,此反应的平衡常数___ (填序号)。
a.等于3.125×10-4 b.大于3.125×10-4
c.小于3.125×10-4 d.无法判断
(3)科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示:

①电极a上发生反应的电极反应式为___ 。
②当有1molH+经质子膜进入正极区时,反应消耗H2S的体积为___ L(标准状况下)。
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH1=-1123.6kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH2=-296kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ·mol-1
写出H2S分解为单质硫(用S表示)和H2的热化学方程式:
(2)H2S在一定条件下发生如下形式的分解:2H2S(g)
 S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
①温度升高时,混合气体的平均摩尔质量减小的原因是
②P点时容器内气体压强与起始时气体压强之比为
③1050℃时,此反应的平衡常数
a.等于3.125×10-4 b.大于3.125×10-4
c.小于3.125×10-4 d.无法判断
(3)科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示:

①电极a上发生反应的电极反应式为
②当有1molH+经质子膜进入正极区时,反应消耗H2S的体积为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:Ⅰ.2SO2(g) + O2(g) 2SO3(g)ΔH=-196.6 kJ· mol-1
2SO3(g)ΔH=-196.6 kJ· mol-1
Ⅱ.2NO(g) + O2(g) 2NO2(g)ΔH=-113.0 kJ· mol-1
2NO2(g)ΔH=-113.0 kJ· mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=
SO3(g)+NO(g)的ΔH=____ kJ· mol-1。
(2)一定条件下,将NO2(g)与SO2(g)以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____ 。
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1 mol SO3的同时生成1 mol NO
(3)CO可用于合成甲醇,化学方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示,该反应的ΔH
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示,该反应的ΔH____ 0(填“>”或“<”)。

(4)依据燃烧的反应原理,合成的甲醇可以设计成如图乙所示的原电池装置。
①该电池工作时,OH-向____ (填“正”或“负”)极移动。
②该电池正极的电极反应式为___________ 。
(1)已知:Ⅰ.2SO2(g) + O2(g)
 2SO3(g)ΔH=-196.6 kJ· mol-1
2SO3(g)ΔH=-196.6 kJ· mol-1Ⅱ.2NO(g) + O2(g)
 2NO2(g)ΔH=-113.0 kJ· mol-1
2NO2(g)ΔH=-113.0 kJ· mol-1则反应NO2(g)+SO2(g)
 SO3(g)+NO(g)的ΔH=
SO3(g)+NO(g)的ΔH=(2)一定条件下,将NO2(g)与SO2(g)以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1 mol SO3的同时生成1 mol NO
(3)CO可用于合成甲醇,化学方程式为CO(g)+2H2(g)
 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示,该反应的ΔH
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图甲所示,该反应的ΔH
(4)依据燃烧的反应原理,合成的甲醇可以设计成如图乙所示的原电池装置。
①该电池工作时,OH-向
②该电池正极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】研究NO2、SO2、CO等大气污染气体的处理具有重要意义。利用反应:6NO2+8NH3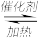 7N2+12H2O可处理NO2。
7N2+12H2O可处理NO2。
(1)若在120℃时该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2)=____________ 。
(2)一定条件下NO2与SO2可发生反应,其方程式为:NO2(g)+SO2(g)⇌SO3(g)+NO(g)-Q,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是__________ 。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.混合气体的平均相对分子质量保持不变
(3)若改变条件,使平衡常数变大,该反应__________ 。
A.一定向正反应方向移动 B.在平衡移动时,正反应速率先减小后增大
C.一定向逆反应方向移动 D.在平衡移动时,逆反应速率先增大后减小
(4)CO可用于合成甲醇,反应方程式为CO(g) + 2H2(g)⇌CH3OH(g) 。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应_________ (填“放热”或“吸热”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是:_______ 。

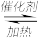 7N2+12H2O可处理NO2。
7N2+12H2O可处理NO2。(1)若在120℃时该反应在一容积为2L的容器内反应,20min时达到平衡,10min时电子转移了1.2mol,则0~10min时,平均反应速率υ(NO2)=
(2)一定条件下NO2与SO2可发生反应,其方程式为:NO2(g)+SO2(g)⇌SO3(g)+NO(g)-Q,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.混合气体的平均相对分子质量保持不变
(3)若改变条件,使平衡常数变大,该反应
A.一定向正反应方向移动 B.在平衡移动时,正反应速率先减小后增大
C.一定向逆反应方向移动 D.在平衡移动时,逆反应速率先增大后减小
(4)CO可用于合成甲醇,反应方程式为CO(g) + 2H2(g)⇌CH3OH(g) 。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】乙二酸(H2C2O4)俗称草酸,是二元弱酸。回答下列问题:
(1)在恒温、恒容密闭容器中发生反应:H2C2O4(s) H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是
H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是____________ (填标号)。
A.压强不再变化 B.CO2(g)的体积分数保持不变
C.混合气体密度不再变化 D.混合气体平均摩尔质量保持不变
(2)草酸溶液中各离子浓度分数δ(X)随溶液pH变化的关系如图所示:
①当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为____________ (填标号)。
A.强酸性 B.弱酸性 C.中性 D.碱性
②25℃时,反应C2O42-+H2C2O4- 2HC2O4-的平衡常数的对数值1gK=
2HC2O4-的平衡常数的对数值1gK=____________ 。
(3)向10 mL0.1mol·L-1H2C2O4溶液中逐滴加入0.1mol·L-1NaOH溶液,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入V(NaOH)____________ 10 mL(填“>”“=”或“<”)。
(4)草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取m g草酸晶体于试管中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是____________ ; 该过程中发生反应的离子方程式为____________ ;滴定过程中消耗V mL KMnO4标准溶液,草酸晶体纯度为____________ 。
(1)在恒温、恒容密闭容器中发生反应:H2C2O4(s)
 H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是
H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是A.压强不再变化 B.CO2(g)的体积分数保持不变
C.混合气体密度不再变化 D.混合气体平均摩尔质量保持不变
(2)草酸溶液中各离子浓度分数δ(X)随溶液pH变化的关系如图所示:

①当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为
A.强酸性 B.弱酸性 C.中性 D.碱性
②25℃时,反应C2O42-+H2C2O4-
 2HC2O4-的平衡常数的对数值1gK=
2HC2O4-的平衡常数的对数值1gK=(3)向10 mL0.1mol·L-1H2C2O4溶液中逐滴加入0.1mol·L-1NaOH溶液,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入V(NaOH)
(4)草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取m g草酸晶体于试管中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是
您最近一年使用:0次



