次磷酸钠(NaH2PO2)广泛应用于电镀、材料等行业,在生产 NaH2PO2 的过程中会产生大量废渣[主要含 NaH2PO2和 CaHPO3,还含有少量 Ca(OH)2], 一种回收 NaH2PO2实现废渣资源化利用的工艺流程如图:
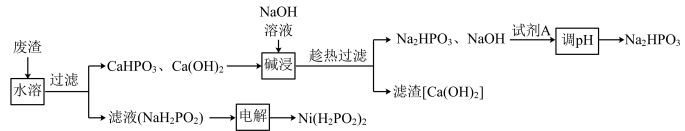
已知:CaHPO3和 Ca(OH)2的 Ksp 分别为 1 ×10-4和 6 ×10-6,H3PO3为二元中强酸。
回答下列问题:
(1)“碱浸”发生反应的化学方程式为__________ 。
(2)“试剂 A”的化学式为_________ 。
(3)电解 NaH2PO2溶液可制得 Ni(H2PO2)2,后者广泛用于化学镀镍,电解 NaH2PO2 溶液装置如图所示。阴极的电极反应式为__________ ,产品室能得到Ni(H2PO2)2的原理是_________ 。
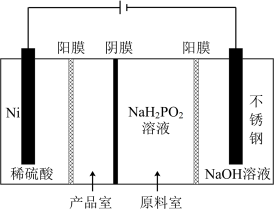
(4)化学镀镍的方法是:将镀件置于一定浓度的Ni(H2PO2)2溶液中,加入NaOH溶液至碱性,产生的Ni可均匀地沉积在镀件上(同时生成 ),发生反应的离子方程式为
),发生反应的离子方程式为________ 。

已知:CaHPO3和 Ca(OH)2的 Ksp 分别为 1 ×10-4和 6 ×10-6,H3PO3为二元中强酸。
回答下列问题:
(1)“碱浸”发生反应的化学方程式为
(2)“试剂 A”的化学式为
(3)电解 NaH2PO2溶液可制得 Ni(H2PO2)2,后者广泛用于化学镀镍,电解 NaH2PO2 溶液装置如图所示。阴极的电极反应式为

(4)化学镀镍的方法是:将镀件置于一定浓度的Ni(H2PO2)2溶液中,加入NaOH溶液至碱性,产生的Ni可均匀地沉积在镀件上(同时生成
 ),发生反应的离子方程式为
),发生反应的离子方程式为
更新时间:2024-01-31 11:06:54
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】随着我国碳达峰、碳中和目标的确定,二氧化碳资源化利用倍受关注。
I.以 和
和 为原料合成尿素
为原料合成尿素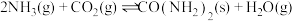
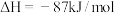 。
。
(1)有利于提高 平衡转化率的措施是___________(填序号)。
平衡转化率的措施是___________(填序号)。
(2)研究发现,合成尿素反应分两步完成,其能量变化如下图所示:
第一步: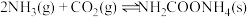

第二步: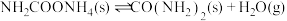


___________  。
。
②决定该反应速率是___________ 反应(填“第一步”或“第二步”),理由是___________ 。
Ⅱ.以和催化重整制备合成气: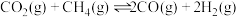 。
。
(3)在密闭容器中通入物质的量均为 的
的 和
和 ,在一定条件下发生反应
,在一定条件下发生反应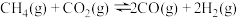 ,
, 的平衡转化率随温度、压强的变化关系如图所示。
的平衡转化率随温度、压强的变化关系如图所示。___________ (填序号)。
A.容器中混合气体的密度保持不变 B.容器内混合气体的压强保持不变
C.反应速率: D.同时断裂
D.同时断裂 键和
键和 键
键
②由图可知,压强
___________  (填“>”“<”或“=”,下同);
(填“>”“<”或“=”,下同); 点速率
点速率
___________ 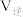 。
。
③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数 ,则
,则 点对应温度下的
点对应温度下的
___________ (用含 的代数式表示)。
的代数式表示)。
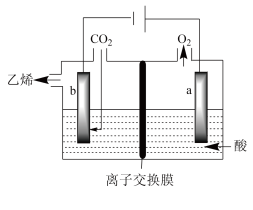
Ⅲ.电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示:___________ 。
I.以
 和
和 为原料合成尿素
为原料合成尿素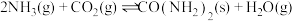
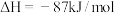 。
。(1)有利于提高
 平衡转化率的措施是___________(填序号)。
平衡转化率的措施是___________(填序号)。| A.高温低压 | B.低温高压 | C.高温高压 | D.低温低压 |
(2)研究发现,合成尿素反应分两步完成,其能量变化如下图所示:
第一步:
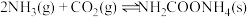

第二步:
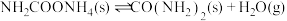


 。
。②决定该反应速率是
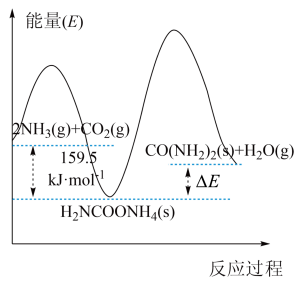
Ⅱ.以和催化重整制备合成气:
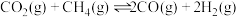 。
。(3)在密闭容器中通入物质的量均为
 的
的 和
和 ,在一定条件下发生反应
,在一定条件下发生反应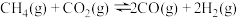 ,
, 的平衡转化率随温度、压强的变化关系如图所示。
的平衡转化率随温度、压强的变化关系如图所示。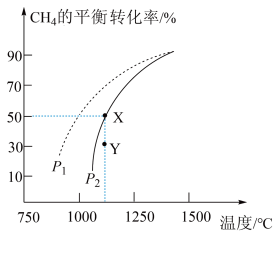
A.容器中混合气体的密度保持不变 B.容器内混合气体的压强保持不变
C.反应速率:
 D.同时断裂
D.同时断裂 键和
键和 键
键②由图可知,压强

 (填“>”“<”或“=”,下同);
(填“>”“<”或“=”,下同); 点速率
点速率
 。
。③已知气体分压=气体总压×气体的物质的量分数,用平衡分压代替平衡浓度可以得到平衡常数
 ,则
,则 点对应温度下的
点对应温度下的
 的代数式表示)。
的代数式表示)。Ⅲ.电化学法还原二氧化碳制乙烯
在强酸性溶液中通入二氧化碳,用惰性电极进行电解可制得乙烯,其原理如图所示:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】NH3是重要的化工原料,可以制备丙烯腈、尿素、硝酸等产品。回答下列问题:
(1)合成氨反应的能量变化如图甲所示(吸附在催化剂表面的物质用“*”表示)。
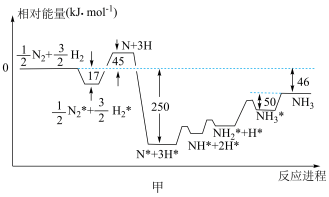
①该条件下,N2(g)+3H2(g) 2NH3(g) △H=
2NH3(g) △H=______ kJ•mol-1。
②实际生产中的工艺条件为:铁触媒作催化剂,控温773K,压强3.0×105Pa,原料气中n(N2):n(H2)=1:2.8。原料气中N2过量的理由是N2相对易得,______ 且N2的吸附分解是反应的决速步。(从平衡移动角度分析)
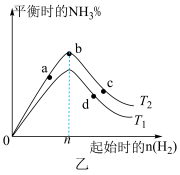
(2)其他条件不变,改变起始氢气的物质的量对工业合成氨反应的影响,实验结果如图乙所示(图中T表示温度)。则T2______ T1(填“>”“<”或“=”);a、b、c三点所处的平衡状态中,反应物N2的转化率最低的是______ (填字母)。
(3)以氨、丙烯、氧气为原料,可在催化剂存在下生成丙烯腈(C3H3N),同时得到副产物丙烯醛(C3H4O),热化学方程式如下:
主反应:C3H6(g)+NH3(g)+ O2(g)
O2(g) C3H3N(g)+3H2O(g) △H=-515kJ•mol-1;
C3H3N(g)+3H2O(g) △H=-515kJ•mol-1;
副反应:C3H6(g)+O2(g) C3H4O(g)+H2O(g) △H=-353kJ•mol-1
C3H4O(g)+H2O(g) △H=-353kJ•mol-1
已知:丙烯腈的选择性= ×100%,某气体分压=总压强×该气体物质的量分数。
×100%,某气体分压=总压强×该气体物质的量分数。
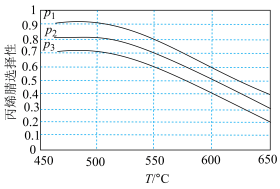
①一定条件下,平衡时丙烯腈的选择性与温度、压强的关系如图所示,则p1、p2、p3由大到小的顺序为________ 。
②某温度下,向100kPa的恒压密闭容器中通入1molC3H6、1molNH3和1.5molO2,发生上述反应。平衡时测得C3H6转化率为90%,H2O(g)的物质的量为2.5mol,则平衡时C3H3N的分压为______ kPa(保留3位有效数字),此温度下副反应的Kp=______ (计算结果保留三位有效数字)。
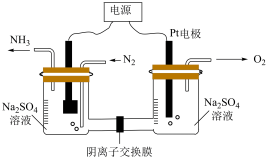
(4)常温常压下,以N2和H2O为原料的电化学合成氨是极具应用前途的绿色合成氨方法。实验室模拟氨的电化学合成过程如图所示,阴极的电极反应式为________ 。
(1)合成氨反应的能量变化如图甲所示(吸附在催化剂表面的物质用“*”表示)。

①该条件下,N2(g)+3H2(g)
 2NH3(g) △H=
2NH3(g) △H=②实际生产中的工艺条件为:铁触媒作催化剂,控温773K,压强3.0×105Pa,原料气中n(N2):n(H2)=1:2.8。原料气中N2过量的理由是N2相对易得,
(2)其他条件不变,改变起始氢气的物质的量对工业合成氨反应的影响,实验结果如图乙所示(图中T表示温度)。则T2

(3)以氨、丙烯、氧气为原料,可在催化剂存在下生成丙烯腈(C3H3N),同时得到副产物丙烯醛(C3H4O),热化学方程式如下:
主反应:C3H6(g)+NH3(g)+
 O2(g)
O2(g) C3H3N(g)+3H2O(g) △H=-515kJ•mol-1;
C3H3N(g)+3H2O(g) △H=-515kJ•mol-1;副反应:C3H6(g)+O2(g)
 C3H4O(g)+H2O(g) △H=-353kJ•mol-1
C3H4O(g)+H2O(g) △H=-353kJ•mol-1已知:丙烯腈的选择性=
 ×100%,某气体分压=总压强×该气体物质的量分数。
×100%,某气体分压=总压强×该气体物质的量分数。①一定条件下,平衡时丙烯腈的选择性与温度、压强的关系如图所示,则p1、p2、p3由大到小的顺序为

②某温度下,向100kPa的恒压密闭容器中通入1molC3H6、1molNH3和1.5molO2,发生上述反应。平衡时测得C3H6转化率为90%,H2O(g)的物质的量为2.5mol,则平衡时C3H3N的分压为
(4)常温常压下,以N2和H2O为原料的电化学合成氨是极具应用前途的绿色合成氨方法。实验室模拟氨的电化学合成过程如图所示,阴极的电极反应式为

您最近一年使用:0次
【推荐3】丁烯和丙烯都是重要的基础化工原料,工业上可用正丁烷制备1−丁烯,然后用1−丁烯制备丙烯。正丁烷催化脱氢制备1−丁烯的反应为:CH3CH2CH2CH3(g) CH2=CHCH2CH3(g)+H2(g) ΔH
CH2=CHCH2CH3(g)+H2(g) ΔH
已知:Ⅰ.温度过高会引发正丁烷裂解生成低碳烃类的副反应。
Ⅱ.H2(g)、CH3CH2CH2CH3(g)、CH2=CHCH2CH3(g)的燃烧热分别为ΔH1=−Q1kJ•mol−1、ΔH2=−Q2kJ•mol−1、ΔH3=−Q3kJ•mol−1。
回答下列问题:
(1)ΔH=___________ 。(用含Q1、Q2、Q3的代数式表示)。
(2)其他条件相同时,在不同配比的催化剂条件下,催化效果的相关数据如表所示。
下列说法正确的是___________ (填标号)。
a.脱氢反应中SiO2不起催化作用
b.CrOx的含量越高,催化效果越好
c.CrOx的含量对脱氢反应的焓变无影响
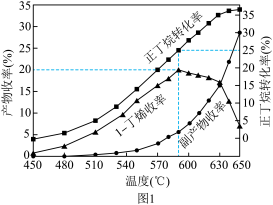
(3)其他条件相同,30min时测得正丁烷转化率、1−丁烯收率(收率= ×100%)随温度的变化关系如图1所示。实际生产温度选择590℃,理由是
×100%)随温度的变化关系如图1所示。实际生产温度选择590℃,理由是___________ 。590℃时,向体积为1L的密闭容器中充入3mol正丁烷气体,据图1计算0~30min生成1−丁烯的平均反应速率为___________ mol/(L·min)。
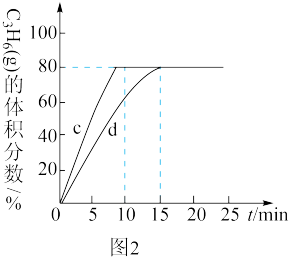
(4)在恒压密闭容器中投入等物质的量的1−丁烯和乙烯,某温度下制备丙烯,发生的反应为C4H8(g)+C2H4(g) 2C3H6(g),测得C3H6(g)的体积分数与时间的关系如图2所示。相对曲线d,曲线c仅改变一个条件,该条件可能是
2C3H6(g),测得C3H6(g)的体积分数与时间的关系如图2所示。相对曲线d,曲线c仅改变一个条件,该条件可能是___________ ,在该温度下,反应的平衡常数K=___________ 。
(5)Kolbe电解羧酸盐法可制取高纯度的烷烃。以Pt为电极,电解高浓度的丙酸钠(CH3CH2COONa)溶液可获得丁烷。装置如图3所示:
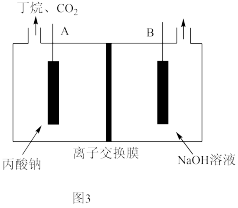
①该装置应选择___________ (填“阳”或“阴”)离子交换膜;
②A电极的电极反应式为___________ 。
 CH2=CHCH2CH3(g)+H2(g) ΔH
CH2=CHCH2CH3(g)+H2(g) ΔH已知:Ⅰ.温度过高会引发正丁烷裂解生成低碳烃类的副反应。
Ⅱ.H2(g)、CH3CH2CH2CH3(g)、CH2=CHCH2CH3(g)的燃烧热分别为ΔH1=−Q1kJ•mol−1、ΔH2=−Q2kJ•mol−1、ΔH3=−Q3kJ•mol−1。
回答下列问题:
(1)ΔH=
(2)其他条件相同时,在不同配比的催化剂条件下,催化效果的相关数据如表所示。
| 实验组 | 催化剂组成 | 正丁烷转化率/% | 1−丁烯收率/% |
| 1 | 无催化剂 | 5 | 0.35 |
| 2 | SiO2 | 5 | 0.35 |
| 3 | SiO2+9%CrOx | 25.5 | 18.3 |
| 4 | SiO2+15%CrOx | 27.5 | 20.65 |
| 5 | SiO2+21%CrOx | 24 | 17.87 |
a.脱氢反应中SiO2不起催化作用
b.CrOx的含量越高,催化效果越好
c.CrOx的含量对脱氢反应的焓变无影响
(3)其他条件相同,30min时测得正丁烷转化率、1−丁烯收率(收率=
 ×100%)随温度的变化关系如图1所示。实际生产温度选择590℃,理由是
×100%)随温度的变化关系如图1所示。实际生产温度选择590℃,理由是
(4)在恒压密闭容器中投入等物质的量的1−丁烯和乙烯,某温度下制备丙烯,发生的反应为C4H8(g)+C2H4(g)
 2C3H6(g),测得C3H6(g)的体积分数与时间的关系如图2所示。相对曲线d,曲线c仅改变一个条件,该条件可能是
2C3H6(g),测得C3H6(g)的体积分数与时间的关系如图2所示。相对曲线d,曲线c仅改变一个条件,该条件可能是
(5)Kolbe电解羧酸盐法可制取高纯度的烷烃。以Pt为电极,电解高浓度的丙酸钠(CH3CH2COONa)溶液可获得丁烷。装置如图3所示:

①该装置应选择
②A电极的电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
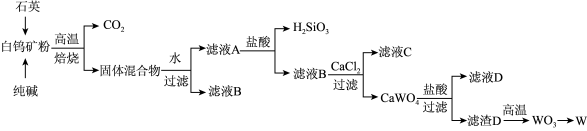
【推荐1】1781年由瑞典化学家卡尔·威廉·舍耶尔发现白钨矿,并提取出新的元素酸—钨酸,1783年被西班牙人德普尔亚用碳还原三氧化钨第一次得到了钨粉,并命名该元素。我国的白钨矿主要产自江西武宁、湖南汝城等地,其主要成分是CaWO4,含少量Fe2O3和SiO2,如图是利用白钨矿冶炼钨的工艺流程:
已知:①钨在高温下能与碳反应生成硬质合金碳化钨(WC),其中钨为+4价。
②钨酸(H2WO4)酸性很弱,难溶于水。
回答下列问题:
(1)高温焙烧前,需要将矿石粉碎,其目的是:____ ;高温焙烧时,原料之间除发生CaWO4+Na2CO3 CaCO3+Na2WO4反应外,还发生的反应是
CaCO3+Na2WO4反应外,还发生的反应是____ 。
(2)滤渣A的主要成分是____ ,向滤液A中加入盐酸调pH时,pH太低会导致钨的产率降低,其原因是___ 。
(3)若用等物质的量的CO、H2、Al作还原剂还原WO3冶炼W,理论上可得到的W的质量之比是____ 。
(4)已知Ca(OH)2和CaWO4的沉淀溶解平衡曲线如图甲所示。一定温度下,向Na2WO4溶液中加入石灰乳可以得到大量的CaWO4,该反应的平衡常数值K=____ 。

(5)利用电解法能从碳化钨废料中回收钨,电解装置如图乙,阳极析出滤渣D,写出阳极的电极反应____ 。
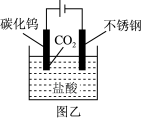

已知:①钨在高温下能与碳反应生成硬质合金碳化钨(WC),其中钨为+4价。
②钨酸(H2WO4)酸性很弱,难溶于水。
回答下列问题:
(1)高温焙烧前,需要将矿石粉碎,其目的是:
 CaCO3+Na2WO4反应外,还发生的反应是
CaCO3+Na2WO4反应外,还发生的反应是(2)滤渣A的主要成分是
(3)若用等物质的量的CO、H2、Al作还原剂还原WO3冶炼W,理论上可得到的W的质量之比是
(4)已知Ca(OH)2和CaWO4的沉淀溶解平衡曲线如图甲所示。一定温度下,向Na2WO4溶液中加入石灰乳可以得到大量的CaWO4,该反应的平衡常数值K=

(5)利用电解法能从碳化钨废料中回收钨,电解装置如图乙,阳极析出滤渣D,写出阳极的电极反应

您最近一年使用:0次
【推荐2】铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
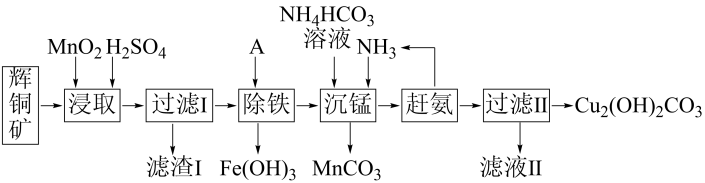
已知:常温下几种离子沉淀时的pH如下表(当离子浓度≤1.0×10-5mol·L-1时完全沉淀)
(1)下列措施不能加快浸取速率的是___________。(填字母)
(2)滤渣I的主要成分是MnO2、S、SiO2,请写出“浸取”反应中生成S的离子方程式:___________ 。
(3)研究表明矿物中Fe2O3在“浸取”反应中起着重要的媒介作用,促进Cu2S与MnO2的溶解,其反应过程如下:
①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
②Cu2S+2Fe2(SO4)3=2CuSO4+4FeSO4+S↓
③___________ (写出反应的化学方程式)。
Fe2O3可明显加快“浸取”的速率,可能的原因是___________ 。
(4)①常温“除铁”的方法是通过加入试剂A调节溶液的pH,使Fe3+转化为Fe(OH)3,则试剂A最好是___________ 。
A.氨水 B.Cu C.CuO D.CuCl2
②“除铁”时调节溶液pH的适宜范围为___________ ,Fe(OH)3的Ksp为___________ 。
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为___________ 。
(6)从滤液Ⅱ获得(NH4)2SO4晶体,当观察到___________ 现象时,即可停止加热。

已知:常温下几种离子沉淀时的pH如下表(当离子浓度≤1.0×10-5mol·L-1时完全沉淀)
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀pH | 7.5 | 2.0 | 4.7 | 8.3 |
| 完全沉淀pH | 9.0 | 3.0 | 6.7 | 9.8 |
(1)下列措施不能加快浸取速率的是___________。(填字母)
| A.将辉铜矿粉碎 | B.延长浸取时间 | C.充分搅拌 | D.适当增大硫酸浓度 |
(3)研究表明矿物中Fe2O3在“浸取”反应中起着重要的媒介作用,促进Cu2S与MnO2的溶解,其反应过程如下:
①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
②Cu2S+2Fe2(SO4)3=2CuSO4+4FeSO4+S↓
③
Fe2O3可明显加快“浸取”的速率,可能的原因是
(4)①常温“除铁”的方法是通过加入试剂A调节溶液的pH,使Fe3+转化为Fe(OH)3,则试剂A最好是
A.氨水 B.Cu C.CuO D.CuCl2
②“除铁”时调节溶液pH的适宜范围为
(5)“沉锰”(除Mn2+)过程中有关反应的离子方程式为
(6)从滤液Ⅱ获得(NH4)2SO4晶体,当观察到
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】某生产BaCO3的化工厂生产排出大量的钡泥(主要含有BaCO3、BaSO3、Ba(FeO2)2等),该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水)。部分工艺流程如下:

已知:pH=3.2时,可使Fe3+沉淀完全。
请回答下列问题:
(1)为提高酸溶速率,可采取的措施有___________ (任写一条)。
(2)酸溶时,Ba(FeO2)2与酸X反应的化学方程式为___________ 。
(3)该厂结合本厂实际,化合物Y最好 选用___________。
(4)滤渣1是___________ ,滤渣2是___________ 。
(5)反应II需调节溶液至中性,目的是___________ 。
(6)“一系列操作”具体是___________ 。
(7)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为___________ 。

已知:pH=3.2时,可使Fe3+沉淀完全。
请回答下列问题:
(1)为提高酸溶速率,可采取的措施有
(2)酸溶时,Ba(FeO2)2与酸X反应的化学方程式为
(3)该厂结合本厂实际,化合物Y
| A.HNO3 | B.Ba(OH)2 | C.BaCO3 | D.Na2CO3 |
(5)反应II需调节溶液至中性,目的是
(6)“一系列操作”具体是
(7)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。
(1)自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈________ ,可以认为存在锂元素。
A.紫红色B.紫色C.黄色
(2)工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:

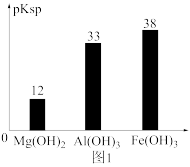
已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图1。
回答下列问题:
①锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为________ 。
②为提高“酸化焙烧”效率,常采取的措施是________ 。
③向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______ 。(保留到小数点后一位。已知:完全沉淀后离子浓度低于1×l0-5)mol/L)
④常温下,已知Ksp[ Mg(OH)2]=3.2×10-11mol/L,Ksp[Fe(OH)3]=2.7×10﹣39,若将足量的Mg(OH)2和Fe(OH)3分别投入水中均得到其相应的悬浊液,所得溶液中金属阳离子的浓度分别为____________ mol/L、__________ mol/L。
⑤“沉锂”过程所获得的“母液”中仍含有大量的Li+,可将其加入到“___________ ”步骤中。
⑥Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为__________
(3)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LiCoO2+C6 LixC6+Li1-xCoO2,其工作原理如图2。
LixC6+Li1-xCoO2,其工作原理如图2。

下列关于该电池的说法正确的是___________ (填字母)。
A.电池反应式中过程1为放电过程
B.该电池若用隔膜可选用质子交换膜
C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D.充电时,LiCoO2极发生的电极反应为LiCoO2-xe-=xLi++Li1-xCoO2
E.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
(1)自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈
A.紫红色B.紫色C.黄色
(2)工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:

已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图1。

回答下列问题:
①锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为
②为提高“酸化焙烧”效率,常采取的措施是
③向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为
④常温下,已知Ksp[ Mg(OH)2]=3.2×10-11mol/L,Ksp[Fe(OH)3]=2.7×10﹣39,若将足量的Mg(OH)2和Fe(OH)3分别投入水中均得到其相应的悬浊液,所得溶液中金属阳离子的浓度分别为
⑤“沉锂”过程所获得的“母液”中仍含有大量的Li+,可将其加入到“
⑥Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为
(3)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LiCoO2+C6
 LixC6+Li1-xCoO2,其工作原理如图2。
LixC6+Li1-xCoO2,其工作原理如图2。
下列关于该电池的说法正确的是
A.电池反应式中过程1为放电过程
B.该电池若用隔膜可选用质子交换膜
C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D.充电时,LiCoO2极发生的电极反应为LiCoO2-xe-=xLi++Li1-xCoO2
E.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】过氧化钙(CaO2)是一种用途广泛的优良供氧剂,常温下为白色固体,能溶于酸,难溶于水、乙醇,且本身无毒,不污染环境,某实验小组制备CaO2过程如下。
I.制备CaO2·8H2O
利用反应Ca2++H2O2+2NH3+8H2O=CaO2·8H2O↓+2 ,在碱性环境下制取CaO2·8H2O的装置如图:
,在碱性环境下制取CaO2·8H2O的装置如图:

(1)CaO2的电子式为___________ 。
(2)写出甲装置中反应的化学方程式___________ 。
(3)仪器A的名称为___________ ;仪器B的作用是___________ 。
(4)乙中反应温度需控制在0℃左右的原因是该反应是放热反应,温度低有利于提高CaO2·8H2O的产率和___________ 。
(5)反应结束后,分离提纯CaO2·8H2O的过程中,洗涤的操作为___________ 。
II.制得产品并定量检测
(6)CaO2·8H2O脱水干燥即得CaO2产品。经检测知某CaO2产品中含有CaO2·xH2O和CaO,已知CaO2·xH2O受热分解有CaO、O2和H2O生成。①称取3.24g产品,加热,在标准状况下生成268.8mL气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的Na2CO3溶液得到沉淀2.80g,则该产品中CaO2·xH2O的x值为___________ 。
I.制备CaO2·8H2O
利用反应Ca2++H2O2+2NH3+8H2O=CaO2·8H2O↓+2
 ,在碱性环境下制取CaO2·8H2O的装置如图:
,在碱性环境下制取CaO2·8H2O的装置如图:
(1)CaO2的电子式为
(2)写出甲装置中反应的化学方程式
(3)仪器A的名称为
(4)乙中反应温度需控制在0℃左右的原因是该反应是放热反应,温度低有利于提高CaO2·8H2O的产率和
(5)反应结束后,分离提纯CaO2·8H2O的过程中,洗涤的操作为
II.制得产品并定量检测
(6)CaO2·8H2O脱水干燥即得CaO2产品。经检测知某CaO2产品中含有CaO2·xH2O和CaO,已知CaO2·xH2O受热分解有CaO、O2和H2O生成。①称取3.24g产品,加热,在标准状况下生成268.8mL气体。②另取等量产品,溶于适量的稀盐酸后,加入足量的Na2CO3溶液得到沉淀2.80g,则该产品中CaO2·xH2O的x值为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下装置简图:

(1)装置B直形冷凝管进水方向______ (填“Ⅱ”或“Ⅲ”),装置D的名称是_________ 。
(2)在A圆底烧瓶中加入一定量工业溴和2小片碎瓷片,加入碎瓷片的作用是_________ ;如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是_______ (填正确答案标号)。A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_____________________ 。
(4)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:___________ 。
(5)装置C的作用:_____________________ 。装置D的作用是________________________ 。
(6)提纯液溴也要用到分液操作,分液漏斗在使用前须清洗干净并___________ ;用CCl4提取溴时,产物应该从分液漏斗的______________ (填“上口倒出”或“下口放出”)。

(1)装置B直形冷凝管进水方向
(2)在A圆底烧瓶中加入一定量工业溴和2小片碎瓷片,加入碎瓷片的作用是
(3)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
(4)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
(5)装置C的作用:
(6)提纯液溴也要用到分液操作,分液漏斗在使用前须清洗干净并
您最近一年使用:0次



