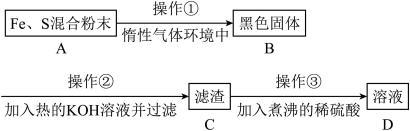
二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=+41kJ/mol
②CO(g)+2H2(g)=CH3OH(g) ΔH2=-90kJ/mol
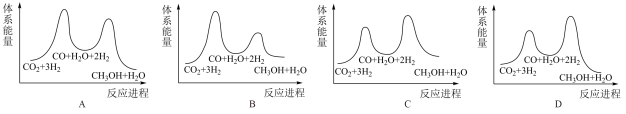
总反应的△H=_______ kJ/mol;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是_______ (填标号),判断的理由是_______ 。
A.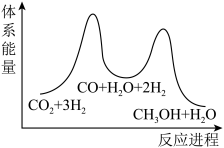 B.
B.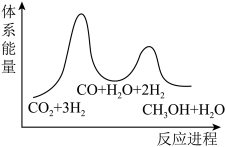
C.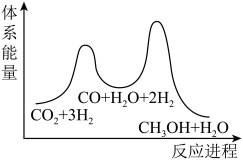 D.
D.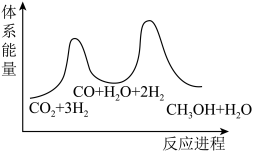
(2)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
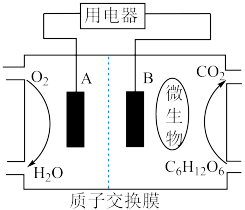
①B为生物燃料电池的_______ (填“正”或“负”)极。
②正极反应式为_______ 。
③电池工作过程中,H+将移向_______ (填“正”或“负”)极。
④在电池反应中,每消耗1mol氧气,理论上生成标准状况下二氧化碳的体积是_______ 。
(1)二氧化碳加氢制甲醇的总反应可表示为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=+41kJ/mol
②CO(g)+2H2(g)=CH3OH(g) ΔH2=-90kJ/mol
总反应的△H=
A.
 B.
B.
C.
 D.
D.
(2)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。

①B为生物燃料电池的
②正极反应式为
③电池工作过程中,H+将移向
④在电池反应中,每消耗1mol氧气,理论上生成标准状况下二氧化碳的体积是
更新时间:2024-03-19 10:18:17
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是_______(填字母)。
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
计算可得:2HCl(g)=H2(g)+Cl2(g) △H=_______ kJ/mol
②通过盖斯定律可计算。已知在25℃、101 kPa时:
I.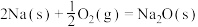
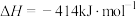
II.
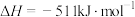
写出Na2O2与Na反应生成Na2O的热化学方程式:_______ 。
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。
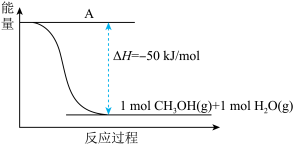
①补全上图:图中A处应填入_______ 。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H_______ (填“变大”“变小”或“不变”)。
③某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。
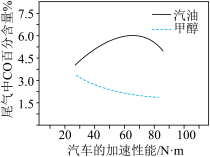
据图信息分析,与汽油相比,甲醇作为燃料的优点是_______ 。
(1)下列反应中,属于吸热反应的是_______(填字母)。
| A.NaHCO3与盐酸反应 | B.甲烷的燃烧反应 |
| C.Ba(OH)2·8H2O与氯化铵反应 | D.锌与盐酸反应 |
①通过化学键的键能计算。已知:
| 化学键种类 | H-H | Cl-Cl | H-Cl |
| 键能(kJ/mol) | 436 | 247 | 434 |
②通过盖斯定律可计算。已知在25℃、101 kPa时:
I.
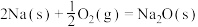
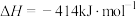
II.

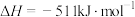
写出Na2O2与Na反应生成Na2O的热化学方程式:
(3)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

①补全上图:图中A处应填入
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H
③某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。

据图信息分析,与汽油相比,甲醇作为燃料的优点是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:

(1)该反应为_______ 反应(填“吸热”或“放热”)。
(2)若要使该反应的反应速率加快,下列措施可行的是_______ (选填A、B、C)。
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为_______ 极(填“正”或“负”)。铜片上产生的现象为_______ ,该极上发生的电极反应为_______ 。

(1)该反应为
(2)若要使该反应的反应速率加快,下列措施可行的是
A.改铁片为铁粉 B.改稀硫酸为98%的浓硫酸 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】回答下列问题:
(1)如图是H2(g)+I2(g) 2HI(g)反应过程中的能量变化图。
2HI(g)反应过程中的能量变化图。
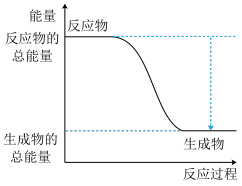
①由图可知,断开反应物的化学键吸收的总能量_______ (填“>”、“<”或者“=”)形成生成物化学键释放的总能量,2HI(g) H2(g)+I2(g)是
H2(g)+I2(g)是_______ (填“放热”或“吸热”)反应。
②已知1mol H2与1mol I2完全反应生成2mol HI会放出11kJ的热量,且断开1mol H-H键需要吸收的能量为436kJ、形成1mol H-I键会释放能量为299kJ。则断开1mol I-I键需要吸收的热量为_______ kJ的热量。
(2)一种用于潜艇的液氨-液氧燃料电池原理示意图如图所示。已知电池总电极反应为4NH3+3O2═2N2+6H2O。
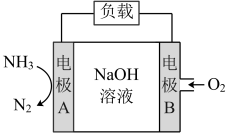
①电极B是_______ 极(填“正”或“负”)。
②该电池工作时,标况下每消耗22.4L NH3,转移电子数为_______ 。
③电极A上发生的电极反应为_______ 。
(1)如图是H2(g)+I2(g)
 2HI(g)反应过程中的能量变化图。
2HI(g)反应过程中的能量变化图。
①由图可知,断开反应物的化学键吸收的总能量
 H2(g)+I2(g)是
H2(g)+I2(g)是②已知1mol H2与1mol I2完全反应生成2mol HI会放出11kJ的热量,且断开1mol H-H键需要吸收的能量为436kJ、形成1mol H-I键会释放能量为299kJ。则断开1mol I-I键需要吸收的热量为
(2)一种用于潜艇的液氨-液氧燃料电池原理示意图如图所示。已知电池总电极反应为4NH3+3O2═2N2+6H2O。

①电极B是
②该电池工作时,标况下每消耗22.4L NH3,转移电子数为
③电极A上发生的电极反应为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】我国科学家研究Li-CO2电池,取得了重大科研成果。回答下列问题:
(1)Li-CO2电池中,Li为单质锂片,则该电池中的CO2在_______ (填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式
Ⅰ.2CO2+2e-=C2O
Ⅱ.C2O =CO2+CO
=CO2+CO
Ⅲ._______
Ⅳ.CO +2Li+=Li2CO3
+2Li+=Li2CO3
(2)研究表明,在电解质水溶液中,CO2气体可被电化学还原。CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为_______ 。
(1)Li-CO2电池中,Li为单质锂片,则该电池中的CO2在
Ⅰ.2CO2+2e-=C2O

Ⅱ.C2O
 =CO2+CO
=CO2+CO
Ⅲ.
Ⅳ.CO
 +2Li+=Li2CO3
+2Li+=Li2CO3(2)研究表明,在电解质水溶液中,CO2气体可被电化学还原。CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】应用电化学原理,回答下列问题。
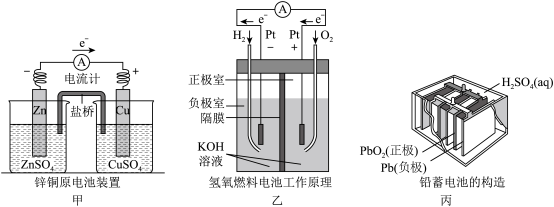
(1)上述三个装置中,负极反应物在化学性质上的共同特点是_____ 。
(2)电池装置中,盐桥中盛装浸有高浓度电解质溶液的琼脂,要求该电解质溶液中阴、阳离子扩散速率相近,即电迁移率(u∞)尽可能相接近。已知K+、Cl-、NO 的电迁移率(u∞×108/m2•s-1•V-1)分别为7.62、7.91、7.40,但是本实验盐桥中的电解质选择KCl而不选KNO3的可能原因是
的电迁移率(u∞×108/m2•s-1•V-1)分别为7.62、7.91、7.40,但是本实验盐桥中的电解质选择KCl而不选KNO3的可能原因是_____ 。甲中电流计指针偏移时,盐桥中离子移动的方向是______ 。
(3)乙中正极反应式为______ ,当消耗氢气的体积为22.4L(标准状况下)时,理论上导线中转移电子的物质的量为_____ 。若将H2换成CH4,则负极反应式为______ 。
(4)丙中铅蓄电池放电一段时间后,电解质溶液的pH值会_____ (填“升高”或“降低”或“不变”)。进行充电时,要将外接电源的负极与铅蓄电池的______ 极相连接(填“正”或“负”)。

(1)上述三个装置中,负极反应物在化学性质上的共同特点是
(2)电池装置中,盐桥中盛装浸有高浓度电解质溶液的琼脂,要求该电解质溶液中阴、阳离子扩散速率相近,即电迁移率(u∞)尽可能相接近。已知K+、Cl-、NO
 的电迁移率(u∞×108/m2•s-1•V-1)分别为7.62、7.91、7.40,但是本实验盐桥中的电解质选择KCl而不选KNO3的可能原因是
的电迁移率(u∞×108/m2•s-1•V-1)分别为7.62、7.91、7.40,但是本实验盐桥中的电解质选择KCl而不选KNO3的可能原因是(3)乙中正极反应式为
(4)丙中铅蓄电池放电一段时间后,电解质溶液的pH值会
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】实现碳达峰、碳中和是贯彻新发展理念的内在要求,因此二氧化碳的合理利用成为研究热点,有效方式之一就是二氧化碳直接加氢合成高附加值产品。
(1)一定条件下,可用二氧化碳加氢合成甲醇。
已知CO2(g)+3H2(g) CH3OH(g)+H2O(g) ∆H= -50kJ·mol-1 ,该反应经过如下步骤来实现:
CH3OH(g)+H2O(g) ∆H= -50kJ·mol-1 ,该反应经过如下步骤来实现:
I.CO2(g)+H2(g) CO(g)+H2O(g) ∆H1= +40.9kJ·mol-1
CO(g)+H2O(g) ∆H1= +40.9kJ·mol-1
II.CO(g)+2H2(g) CH3OH(g) ∆H2
CH3OH(g) ∆H2
①求∆H2=___________ kJ·mol-1
②已知反应I是整个反应的决速步,下列示意图中能体现上述反应能量变化的是___________ (填标号)。
(2)一定条件下也可用二氧化碳加氢合成甲烷:4H2(g)+CO2(g) CH4(g)+2H2O(g)。
CH4(g)+2H2O(g)。
①在绝热恒容密闭容器中,一定能说明该反应达到平衡状态的是___________ (填字母)。
A.v正(H2)=v逆(CH4) B.t min内断裂H-H的数目与断裂O—H数目相等
C.容器温度保持不变 D.当H2(g)与CO2(g)物质的量之比保持4:1不变
一定温度下在2L恒温恒容密闭容器中初始加入2.0mol CO2和一定量H2,发生上述反应数据如下:
②则3min时容器中CH4的物质的量浓度为___________ ,该温度下反应的化学平衡常数为___________ 。
③保持温度不变,在达平衡后,向容器中再加入H2(g)和CH4(g)各1mol,则此时v(正)___________ v(逆)(填“>”、“<”或“=”)。
(3)最近科学家开发出一种新系统,“溶解”水中的二氧化碳,发生电化学反应,生成电能和氢气,其工作原理如图所示。
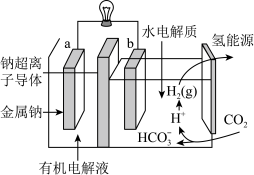
①有机电解液是有机溶剂加特定的盐加热制成,该装置的有机电解液___________ (填“能”或“不能”)用乙醇做溶剂。
②写出二氧化碳生成氢气的电极反应式:___________ 。
(1)一定条件下,可用二氧化碳加氢合成甲醇。
已知CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ∆H= -50kJ·mol-1 ,该反应经过如下步骤来实现:
CH3OH(g)+H2O(g) ∆H= -50kJ·mol-1 ,该反应经过如下步骤来实现:I.CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H1= +40.9kJ·mol-1
CO(g)+H2O(g) ∆H1= +40.9kJ·mol-1II.CO(g)+2H2(g)
 CH3OH(g) ∆H2
CH3OH(g) ∆H2①求∆H2=
②已知反应I是整个反应的决速步,下列示意图中能体现上述反应能量变化的是

(2)一定条件下也可用二氧化碳加氢合成甲烷:4H2(g)+CO2(g)
 CH4(g)+2H2O(g)。
CH4(g)+2H2O(g)。①在绝热恒容密闭容器中,一定能说明该反应达到平衡状态的是
A.v正(H2)=v逆(CH4) B.t min内断裂H-H的数目与断裂O—H数目相等
C.容器温度保持不变 D.当H2(g)与CO2(g)物质的量之比保持4:1不变
一定温度下在2L恒温恒容密闭容器中初始加入2.0mol CO2和一定量H2,发生上述反应数据如下:
| t(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
| n(CO2)(mol) | 2.0 | 1.5 | 1.1 | 0.8 | 0.6 | 0.5 | 0.5 |
| n(H2)(mol) | 3.2 |
③保持温度不变,在达平衡后,向容器中再加入H2(g)和CH4(g)各1mol,则此时v(正)
(3)最近科学家开发出一种新系统,“溶解”水中的二氧化碳,发生电化学反应,生成电能和氢气,其工作原理如图所示。

①有机电解液是有机溶剂加特定的盐加热制成,该装置的有机电解液
②写出二氧化碳生成氢气的电极反应式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】现代社会生活离不开能量。
I.(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用_______ (填“放热”或“吸热”)的化学变化或物理变化。
(2)“即热饭盒”给人们生活带来方便,它可利用下面_______ (填序号)反应释放的热量加热食物。
A.生石灰和水B. 和
和 C.硝酸铵和水
C.硝酸铵和水
II.某实验小组为了探究化学能与热能的转化,设计了如图所示的三套实验装置。
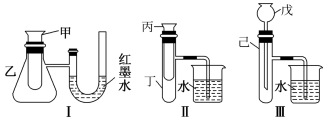
(1)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管中加入适量了 溶液与稀硫酸,U形管中可观察到的现象是
溶液与稀硫酸,U形管中可观察到的现象是_______ 。
(2)为探究固体M溶于水的热效应,选择装置II进行实验(反应在丙试管中进行)。
①若观察到烧杯中产生气泡,则说明M溶于水_______ (填“一定是放热反应”、“一定是吸热反应”或“可能是放热反应”)。
②若只观察到烧杯中的导管内形成一段水柱,则M可能为_______ 。
(3)上述3个装置中,能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是_______ (填装置序号)
III.天然气的主要成分是甲烷,甲烷是一种重要的燃料和化工原料。
(1)某种甲烷燃料电池工作原理如图1所示。
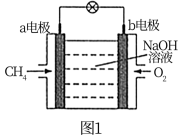
①电子移动方向为_______ (填“a→b“或“b→a“)。
②b电极的电极反应式为_______ 。
(2)甲烷可催化还原NO,反应历程如图2所示。

①该历程中,反应i为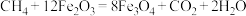 ,则反应ii的化学方程式为
,则反应ii的化学方程式为_______ 。
②工业上催化还原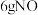 ,理论上需要
,理论上需要_______ LCH4(标准状况下)。
I.(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途。制作冷敷袋可以利用
(2)“即热饭盒”给人们生活带来方便,它可利用下面
A.生石灰和水B.
 和
和 C.硝酸铵和水
C.硝酸铵和水II.某实验小组为了探究化学能与热能的转化,设计了如图所示的三套实验装置。

(1)某同学选用装置I进行实验(实验前U形管里液面左右相平),在甲试管中加入适量了
 溶液与稀硫酸,U形管中可观察到的现象是
溶液与稀硫酸,U形管中可观察到的现象是(2)为探究固体M溶于水的热效应,选择装置II进行实验(反应在丙试管中进行)。
①若观察到烧杯中产生气泡,则说明M溶于水
②若只观察到烧杯中的导管内形成一段水柱,则M可能为
(3)上述3个装置中,能验证“铜与浓硝酸的反应是吸热反应还是放热反应”的装置是
III.天然气的主要成分是甲烷,甲烷是一种重要的燃料和化工原料。
(1)某种甲烷燃料电池工作原理如图1所示。

①电子移动方向为
②b电极的电极反应式为
(2)甲烷可催化还原NO,反应历程如图2所示。

①该历程中,反应i为
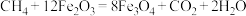 ,则反应ii的化学方程式为
,则反应ii的化学方程式为②工业上催化还原
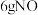 ,理论上需要
,理论上需要
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】氮循环是指氮在自然界中的循环转化过程,是生物圈内基本的物质循环之一,自然界氮的循环过程如图。
(1)农谚“一场雷雨一场肥”中属于自然固氮的化学方程式为_______ 。
(2)合成氨反应是重要的人工固氮方式,其中铁触媒是催化剂,反应机理如图所示_______ ,该过程原子利用率为_______ 。
②下列关于铁触媒催化剂的说法正确的是_______ (填字母)。
a.可以增大反应速率
b.可以降低合成氨反应的能耗
c.反应过程中,铁的化合价保持不变
d.催化剂的量越多。化学反应速率越快
(3)生活污水的直接排放,会使自然水域中的氨氮含量超标,折点氯化法是处理氨氮废水的常用方法,其原理是向废水中通入足量的氯气,利用氯水中的HClO将 转化为无害的气体,写出HClO和
转化为无害的气体,写出HClO和 反应的离子方程式:
反应的离子方程式:_______ ,该法的优点是反应速率快,脱氮效果好,缺点可能是_______ (答一条即可)。
(4)动物排泄物中含有尿素,化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素。既能产生净化的水,又能发电。尿素燃料电池结构如图所示。_______ 极,发生的反应类型为_______ ,甲电极上发生的电极方程式为_______ 。

(1)农谚“一场雷雨一场肥”中属于自然固氮的化学方程式为
(2)合成氨反应是重要的人工固氮方式,其中铁触媒是催化剂,反应机理如图所示

②下列关于铁触媒催化剂的说法正确的是
a.可以增大反应速率
b.可以降低合成氨反应的能耗
c.反应过程中,铁的化合价保持不变
d.催化剂的量越多。化学反应速率越快
(3)生活污水的直接排放,会使自然水域中的氨氮含量超标,折点氯化法是处理氨氮废水的常用方法,其原理是向废水中通入足量的氯气,利用氯水中的HClO将
 转化为无害的气体,写出HClO和
转化为无害的气体,写出HClO和 反应的离子方程式:
反应的离子方程式:(4)动物排泄物中含有尿素,化学家正在研究尿素动力燃料电池。用这种电池直接去除城市废水中的尿素。既能产生净化的水,又能发电。尿素燃料电池结构如图所示。

您最近一年使用:0次