某同学利用以下装置探究非金属元素性质的递变规律,并验证氯气的性质。
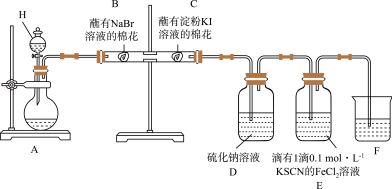
回答下列问题:
(1)仪器H的名称为______ 。
(2)能说明氯气的氧化性强于溴的实验现象为______ 。
(3)氯气进入D中,有黄色固体产生,反应的离子方程式为______ 。
(4)E中溶液先变为红色,后红色褪去,为探究E中溶液褪色的原因,该同学提出两种假设:
a: 被氧化; b:
被氧化; b:______ 。
设计实验方案验证以上假设,向褪色后的溶液中滴加______ ,若观察到______ ,可验证假设b成立。
(5)将溴水滴入淀粉 溶液中,溶液变蓝,再结合B处实验现象,可以得出的结论正确的是______(填标号)。
溶液中,溶液变蓝,再结合B处实验现象,可以得出的结论正确的是______(填标号)。

回答下列问题:
(1)仪器H的名称为
(2)能说明氯气的氧化性强于溴的实验现象为
(3)氯气进入D中,有黄色固体产生,反应的离子方程式为
(4)E中溶液先变为红色,后红色褪去,为探究E中溶液褪色的原因,该同学提出两种假设:
a:
 被氧化; b:
被氧化; b:设计实验方案验证以上假设,向褪色后的溶液中滴加
(5)将溴水滴入淀粉
 溶液中,溶液变蓝,再结合B处实验现象,可以得出的结论正确的是______(填标号)。
溶液中,溶液变蓝,再结合B处实验现象,可以得出的结论正确的是______(填标号)。A.氧化性: | B.同主族元素从上到下非金属性减弱 |
| C.同周期元素从左到右非金属性减弱 | D. 、 、 、I对应含氧酸酸性逐渐减弱 、I对应含氧酸酸性逐渐减弱 |
更新时间:2024-03-25 15:36:14
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】氮及其化合物是重要的化工原料。
(1)写出实验室制氨气的化学方程式___________ ,证明氨气已集满的操作和现象是___________ 。
(2)含氮废水会加速藻类和其他浮游生物的大量繁殖,使水质恶化。利用微生物对含氮废水进行处理的流程如下:
蛋白质 NH3
NH3 HNO2
HNO2 HNO3
HNO3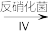 N2
N2
请回答:
①过程Ⅲ发生反应的化学方程式为____ 。
②根据图1和图2,判断使用亚硝化菌的最佳条件为_______ 。

③利用微生物处理含氮废水的优点为_______ 。
(3)肼(N2H4)暴露在空气中容易爆炸,但利用其制作的燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染等优点,其工作原理如图所示,写出该电池的正极反应式:_______ 。

(1)写出实验室制氨气的化学方程式
(2)含氮废水会加速藻类和其他浮游生物的大量繁殖,使水质恶化。利用微生物对含氮废水进行处理的流程如下:
蛋白质
 NH3
NH3 HNO2
HNO2 HNO3
HNO3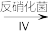 N2
N2请回答:
①过程Ⅲ发生反应的化学方程式为
②根据图1和图2,判断使用亚硝化菌的最佳条件为

③利用微生物处理含氮废水的优点为
(3)肼(N2H4)暴露在空气中容易爆炸,但利用其制作的燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染等优点,其工作原理如图所示,写出该电池的正极反应式:

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】化肥厂所产生的废水中,氮元素多以NH 和NH3·H2O的形式存在,直接排入水体中,不仅会引起水体富营养化,还会对人群及生物产生毒害作用。工业上,常用NaNO2来处理含NH
和NH3·H2O的形式存在,直接排入水体中,不仅会引起水体富营养化,还会对人群及生物产生毒害作用。工业上,常用NaNO2来处理含NH 或NH3·H2O的废水,其流程如图所示:
或NH3·H2O的废水,其流程如图所示:
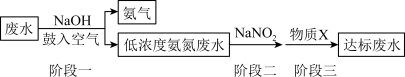
已知:二价硫可表示为S(II);NaNO2易被空气中的氧气氧化,其与稀硫酸反应会生成易分解的亚硝酸。
(1)NaNO2中N的化合价为_______ 价。
(2)NaNO2的外观、味道均与食盐相似,但具有剧毒,被严禁作为食盐食用。误食后,能将血液中的Fe(II)_______ (填“氧化”或“还原”)为Fe(III);服用维生素C能缓解NaNO2中毒,维生素C作_______ (填“氧化剂”或“还原剂”)。
(3)在“阶段一”中,加入NaOH的作用为_______ (用离子方程式表示);鼓入空气的目的是_______ 。
(4)“阶段二”中NH 与NaNO2反应生成无污染的物质,该反应的离子方程式为
与NaNO2反应生成无污染的物质,该反应的离子方程式为_______ 。
(5)某化学兴趣小组设计如下实验探究NaNO2溶液与KI溶液的反应,步骤及现象如下。
①2mL注射器,吸取1mL浓度均为0.2mol·L-1NaNO2和KI的混合溶液,针头朝上排出空气。
②吸入少量稀硫酸并迅速将针头插入橡皮塞,观察到有无色气泡产生,溶液变黑,黑色固体析出附着在壁上,轻轻摇动将黑色固体洗到溶液中。
③摘去橡皮塞,轻轻拉动注射器活塞,吸入少量空气,观察到无色气体变成红棕色。
④将注射器中少量溶液挤入淀粉溶液中,观察到淀粉溶液变为蓝色。
步骤①中排出空气的目的是_______ ;步骤③中红棕色气体的化学式为_______ ;实验中NaNO2溶液与KI溶液发生反应的离子方程式为_______ 。
 和NH3·H2O的形式存在,直接排入水体中,不仅会引起水体富营养化,还会对人群及生物产生毒害作用。工业上,常用NaNO2来处理含NH
和NH3·H2O的形式存在,直接排入水体中,不仅会引起水体富营养化,还会对人群及生物产生毒害作用。工业上,常用NaNO2来处理含NH 或NH3·H2O的废水,其流程如图所示:
或NH3·H2O的废水,其流程如图所示:
已知:二价硫可表示为S(II);NaNO2易被空气中的氧气氧化,其与稀硫酸反应会生成易分解的亚硝酸。
(1)NaNO2中N的化合价为
(2)NaNO2的外观、味道均与食盐相似,但具有剧毒,被严禁作为食盐食用。误食后,能将血液中的Fe(II)
(3)在“阶段一”中,加入NaOH的作用为
(4)“阶段二”中NH
 与NaNO2反应生成无污染的物质,该反应的离子方程式为
与NaNO2反应生成无污染的物质,该反应的离子方程式为(5)某化学兴趣小组设计如下实验探究NaNO2溶液与KI溶液的反应,步骤及现象如下。
①2mL注射器,吸取1mL浓度均为0.2mol·L-1NaNO2和KI的混合溶液,针头朝上排出空气。
②吸入少量稀硫酸并迅速将针头插入橡皮塞,观察到有无色气泡产生,溶液变黑,黑色固体析出附着在壁上,轻轻摇动将黑色固体洗到溶液中。
③摘去橡皮塞,轻轻拉动注射器活塞,吸入少量空气,观察到无色气体变成红棕色。
④将注射器中少量溶液挤入淀粉溶液中,观察到淀粉溶液变为蓝色。
步骤①中排出空气的目的是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】完成下列实验设计题:
(1)证明CO2中含有CO___________
(2)证明SO2中含有CO2___________
(3)证明SO 中含有SO
中含有SO
___________
(4)①证明H2C2O4是弱酸;②证明草酸的酸性强于碳酸;③证明草酸是二元酸___________ (提供的试剂:0.1 mol·L-1 NaHCO3溶液、0.1 mol·L-1草酸溶液、0.1 mol·L-1 NaOH溶液、Na2C2O4晶体、甲基橙、酚酞、pH试纸)
(5)设计一个实验方案证明酸性条件下NaNO2具有氧化性___________ (提供的试剂:0.10 mol·L-1 NaNO2溶液、KMnO4溶液、0.10 mol·L-1 KI溶液、淀粉溶液、稀硝酸、稀硫酸)
(1)证明CO2中含有CO
(2)证明SO2中含有CO2
(3)证明SO
 中含有SO
中含有SO
(4)①证明H2C2O4是弱酸;②证明草酸的酸性强于碳酸;③证明草酸是二元酸
(5)设计一个实验方案证明酸性条件下NaNO2具有氧化性
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】下图所涉及的物质均为中学化学中的常见物质,其中:①C、D、E、F都为单质,其余为化合物;②C、D、E在常温下为气体,其它物质为固体或液体;③A、I两种化合物的焰色反应分别为紫色和黄色;④反应①、②中的一些生成物已经略去,有些反应的条件未列出,它们存在如下转化关系。

(1)写出有关物质的化学式:A_______ ,D________ ,F_______ ,I________ 。
(2)指出MnO2在相关反应中的作用:反应①中是_______ 剂,反应②中是_______ 剂。
(3)写出B与MnO2共热获得D的化学方程式__________________________________ 。

(1)写出有关物质的化学式:A
(2)指出MnO2在相关反应中的作用:反应①中是
(3)写出B与MnO2共热获得D的化学方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。请回答下列问题:
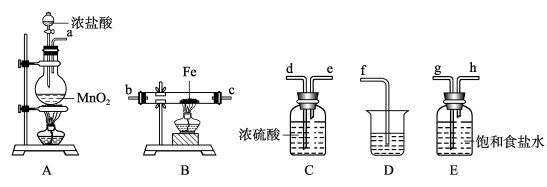
(1)A中发生反应的离子方程式为___________ 。
(2)各装置的正确连接顺序为(填写装置代号)a→___________ →___________ →___________ →___________ →b→c→f。
(3)装置E中饱和食盐水作用是___________ 写出装置D中反应的离子方程式___________ 。
(4)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为___________ ,漂白粉的有效成分是___________ 。(填化学式)
(5)将氯水滴入KI淀粉溶液中,用力振荡,看到的现象为__
A.液体呈黄绿色 B.液体无色
C.液体呈蓝色 D.液体呈红色

(1)A中发生反应的离子方程式为
(2)各装置的正确连接顺序为(填写装置代号)a→
(3)装置E中饱和食盐水作用是
(4)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为
(5)将氯水滴入KI淀粉溶液中,用力振荡,看到的现象为
A.液体呈黄绿色 B.液体无色
C.液体呈蓝色 D.液体呈红色
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】无水氯化铝是白色晶体,易吸收水分,在178℃升华。装有无水氯化铝的试剂瓶久置潮湿空气中,会自动爆炸并产生大量白雾。氯化铝常作为有机合成和石油工业的催化剂,并用于处理润滑油等。工业上由金属铝和氯气作用或由无水氯化氢气体与熔融金属铝作用而制得。某课外兴趣小组通过下列装置制取少量纯净的无水氯化铝。

(1)开始实验时,不能先点燃A装置的酒精灯,后打开分液漏斗的活塞,将适量浓硫酸注入烧瓶里,其理由是:_______ 。
(2)A装置中发生反应的化学方程式为_______ 。
(3)在E 处可收集到纯净的氯化铝,其原因是:_______ 。
(4)从A装置中导出的气体若不经过B、C装置而直接进入D管,将对实验产生不良的后果是:_______ 。F装置所起的作用有:_______ 。

(1)开始实验时,不能先点燃A装置的酒精灯,后打开分液漏斗的活塞,将适量浓硫酸注入烧瓶里,其理由是:
(2)A装置中发生反应的化学方程式为
(3)在E 处可收集到纯净的氯化铝,其原因是:
(4)从A装置中导出的气体若不经过B、C装置而直接进入D管,将对实验产生不良的后果是:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ.打开活塞b,将少量C中溶液滴入D中,然后关闭活塞b,
V.取下D并充分振荡。
(1)已知2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,该反应的离子方程式为:__________ 。
(2)验证氯气的氧化性强于碘的实验现象是___________ ,反应的离子方程 式为
式为____________ 。
(3)试管口浸有碱溶液的棉花的作用是_________ ,反应的离子方程式为:________ 。
(4)D中发生反应的化学方程式是__________ ,可观察到的现象是___________ 。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕色时,关闭活塞a。
Ⅳ.打开活塞b,将少量C中溶液滴入D中,然后关闭活塞b,
V.取下D并充分振荡。
(1)已知2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,该反应的离子方程式为:
(2)验证氯气的氧化性强于碘的实验现象是
 式为
式为(3)试管口浸有碱溶液的棉花的作用是
(4)D中发生反应的化学方程式是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】下图是部分短周期元素的常见化合价与原子序数的关系图:
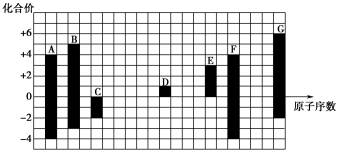
(1)元素B在周期表中的位置___________________________________ 。
(2)用电子式表示D2G的形成过程_______________________________________________________ ,其所含化学键类型为_____________ 。
(3)C2-、D+、G2-离子半径由大到小顺序是________________________ (用离子符号回答)。
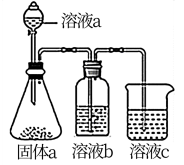
(4)某同学设计上图实验证明A、F的非金属性强弱关系。
①若溶液a为浓盐酸,固体a为石灰石,溶液 b和c分别为____________________ ,____________________ 。
②溶液c中的离子方程式为_______________________________________ 。
③请从原子结构的角度解释非金属性A>F的原因:________________________________________ 。


(1)元素B在周期表中的位置
(2)用电子式表示D2G的形成过程
(3)C2-、D+、G2-离子半径由大到小顺序是
(4)某同学设计上图实验证明A、F的非金属性强弱关系。
①若溶液a为浓盐酸,固体a为石灰石,溶液 b和c分别为
②溶液c中的离子方程式为
③请从原子结构的角度解释非金属性A>F的原因:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】某同学利用如图装置探究元素周期表中元素性质的递变规律。

(1) 仪器B的名称为________ ,干燥管D的作用为_________ 。
(2)若要证明非金属性:Cl > I,则A中加浓盐酸,B中加KMnO4(已知KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液________ 的现象,即可证明。此装置缺少尾气处理装置,可用________ 溶液吸收尾气,反应的离子方程式为:__________________________________ 。
(3)现有盐酸、CaCO3和Na2SiO3溶液,若要证明非金属性:C>Si,则C中装试剂______ 。观察到C中溶液________ 的现象,即可证明。但有同学认为盐酸具有挥发性,可进入C中干扰试验,也会产生相同的实验现象,为了避免干扰,应在两装置间添加装有________ 溶液的洗气瓶除去。

(1) 仪器B的名称为
(2)若要证明非金属性:Cl > I,则A中加浓盐酸,B中加KMnO4(已知KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液
(3)现有盐酸、CaCO3和Na2SiO3溶液,若要证明非金属性:C>Si,则C中装试剂
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】某同学用如图所示装置探究SO2的性质及其有关实验。

(1)实验室用亚硫酸钠固体和一定浓度的硫酸溶液反应制备SO2气体,写出该反应的化学方程式:_______ 。
(2)分别将SO2气体通入下列C溶液中,请回答下列问题:
①少量SO2通入紫色石蕊试液,现象是_______ ,继续通入过量SO2气体,现象是_______ 。
②SO2通入紫色KMnO4溶液,现象是_______ 。
③过量SO2慢慢地通入澄清石灰水中,现象是_______ 。
④若C为双氧水,则通入SO2后,请大胆判断所得溶液的溶质是_______ (填化学式),若该同学制备的SO2气体中混有CO2气体,产生杂质的原因可能是亚硫酸钠固体中混有_______ 。

(1)实验室用亚硫酸钠固体和一定浓度的硫酸溶液反应制备SO2气体,写出该反应的化学方程式:
(2)分别将SO2气体通入下列C溶液中,请回答下列问题:
①少量SO2通入紫色石蕊试液,现象是
②SO2通入紫色KMnO4溶液,现象是
③过量SO2慢慢地通入澄清石灰水中,现象是
④若C为双氧水,则通入SO2后,请大胆判断所得溶液的溶质是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某课外活动小组设计如图装置验证“二氧化碳与水接触时才能和过氧化钠反应”,已知盐酸具有挥发性且易挥发出HCl气体。
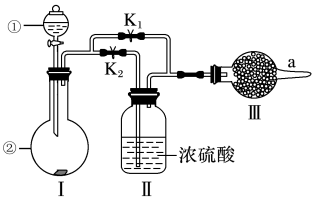
(1)过氧化钠与二氧化碳反应的化学方程式是_________ 。
(2)装置Ⅰ是制备纯净的_________ (写化学式),则仪器①和②中最适宜的药品组合是_________ (填字母)。
a.稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)装置Ⅲ中盛装的是过氧化钠,具体实验时操作步骤如下:
第一步:打开分液漏斗活塞,再打开弹簧夹 (
( 此时处于关闭状态),将带火星的木条置于a口。
此时处于关闭状态),将带火星的木条置于a口。
第二步:关闭 ,打开
,打开 ,再将带火星的木条置于a口。
,再将带火星的木条置于a口。
现象:第一步观察到带火星的木条始终不复燃。第二步观察到带火星的木条也始终不复燃。
①为了观察到木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是_________ 。
②乙采纳甲的建议在Ⅲ后安装一个盛有碱石灰的干燥管,再将带火星的木条置于盛有碱石灰的干燥管管口。改进后本实验预期现象是_________ 。这也不能证明实验结论,原因是_________ (用化学方程式表示)。
(4)为进一步达到实验目的,应补充的实验是:取第二步反应后的Ⅲ中所得固体少量于试管中,_________ (写出实验操作、现象及结论)。

(1)过氧化钠与二氧化碳反应的化学方程式是
(2)装置Ⅰ是制备纯净的
a.稀盐酸 b.稀硫酸 c.小苏打 d.石灰石
(3)装置Ⅲ中盛装的是过氧化钠,具体实验时操作步骤如下:
第一步:打开分液漏斗活塞,再打开弹簧夹
 (
( 此时处于关闭状态),将带火星的木条置于a口。
此时处于关闭状态),将带火星的木条置于a口。第二步:关闭
 ,打开
,打开 ,再将带火星的木条置于a口。
,再将带火星的木条置于a口。现象:第一步观察到带火星的木条始终不复燃。第二步观察到带火星的木条也始终不复燃。
①为了观察到木条复燃,甲建议在Ⅲ后安装一个盛有碱石灰的干燥管,目的是
②乙采纳甲的建议在Ⅲ后安装一个盛有碱石灰的干燥管,再将带火星的木条置于盛有碱石灰的干燥管管口。改进后本实验预期现象是
(4)为进一步达到实验目的,应补充的实验是:取第二步反应后的Ⅲ中所得固体少量于试管中,
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某化学兴趣研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物。已知SO3的熔点是16.8℃,沸点是44.8℃。

(1)装置II的试管中不装任何试剂,其作用是__ 。
(2)装置II的试管浸泡在50℃的水浴中,目的是__ 。
(3)装置III和装置IV的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。__
(4)装置V的作用是防止尾气污染环境,烧杯中应加入的试剂是__ 。

(1)装置II的试管中不装任何试剂,其作用是
(2)装置II的试管浸泡在50℃的水浴中,目的是
(3)装置III和装置IV的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。
| 检验试剂 | 预期现象与结论 |
| 装置III的试管中加入__ | 产生白色沉淀,证明气体产物中含有SO3 |
| 装置IV的试管中加入__ | __ |
您最近一年使用:0次



