研究含氮、含氯物质的转化是工业、农业、医药、环保等领域的重要课题,以下是其中两类常见研究。
I.研究氨催化氧化制硝酸,其流程示意图如下:
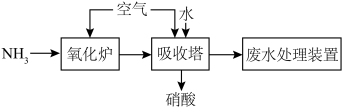
(1)“氧化炉”中还原剂为___________ (填化学式)。
(2)“吸收塔”中生成硝酸的化学方程式为___________ 。(写出一个即可)
(3)为避免硝酸工业废气中 污染环境,常用NaOH溶液吸收,其反应原理如下:
污染环境,常用NaOH溶液吸收,其反应原理如下:
①
②
现有一定条件下0.5mol 和0.1mol NO的混合气体恰好被300mL NaOH溶液完全吸收,则NaOH溶液的物质的量浓度为
和0.1mol NO的混合气体恰好被300mL NaOH溶液完全吸收,则NaOH溶液的物质的量浓度为___________ mol/L。
II.甲同学设计如图所示装置研究氯气能否与水发生反应,气体a是含有少量空气和水蒸气的氯气。请回答下列问题
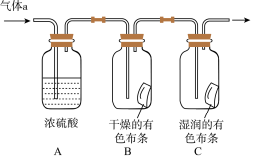
(4)浓硫酸的作用是___________ 。
(5)证明氯气和水反应的实验现象为___________ 。
(6)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是___________ 。
(7)漂白粉溶于水后,遇到空气中的 ,即产生漂白、杀菌作用,反应的化学方程式是
,即产生漂白、杀菌作用,反应的化学方程式是___________ 。
I.研究氨催化氧化制硝酸,其流程示意图如下:

(1)“氧化炉”中还原剂为
(2)“吸收塔”中生成硝酸的化学方程式为
(3)为避免硝酸工业废气中
 污染环境,常用NaOH溶液吸收,其反应原理如下:
污染环境,常用NaOH溶液吸收,其反应原理如下:①

②

现有一定条件下0.5mol
 和0.1mol NO的混合气体恰好被300mL NaOH溶液完全吸收,则NaOH溶液的物质的量浓度为
和0.1mol NO的混合气体恰好被300mL NaOH溶液完全吸收,则NaOH溶液的物质的量浓度为II.甲同学设计如图所示装置研究氯气能否与水发生反应,气体a是含有少量空气和水蒸气的氯气。请回答下列问题

(4)浓硫酸的作用是
(5)证明氯气和水反应的实验现象为
(6)若将氯气通入石灰乳制取漂白粉,反应的化学方程式是
(7)漂白粉溶于水后,遇到空气中的
 ,即产生漂白、杀菌作用,反应的化学方程式是
,即产生漂白、杀菌作用,反应的化学方程式是
更新时间:2024-04-02 19:26:32
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】钒性能优良,用途广泛,有金属“维生素”之称。在发展现代工业、国防等方面发挥着重要的作用。一种用废钒催化剂(含 、少量
、少量 、
、 )制取
)制取 的工艺流程如图:
的工艺流程如图:
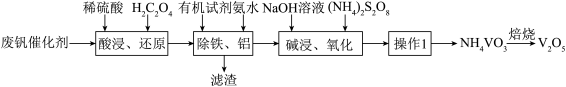
已知:溶液中四种含钒微粒的存在形式和颜色: 紫色、
紫色、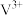 绿色、
绿色、 蓝色,
蓝色, 黄色。回答下列问题:
黄色。回答下列问题:
(1)“酸浸、还原”时, 被还原为
被还原为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(2)“碱浸、氧化”过程中会生成 ,在20.00mL
,在20.00mL
 溶液中,加入0.195g锌粉,恰好完全反应,则所得溶液的颜色为
溶液中,加入0.195g锌粉,恰好完全反应,则所得溶液的颜色为_______ 。
(3)将废钒催化剂与稀硫酸、亚硫酸钾溶液混合,充分反应后也能生成 等离子,写出生成
等离子,写出生成 离子的化学方程式是
离子的化学方程式是_______ 。
(4)向上述所得溶液中加入 溶液,完善并配平反应的离子方程式
溶液,完善并配平反应的离子方程式_______ 。
_____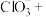 ____
____ _____=_____
_____=_____ _____
_____ _____
_____
(5) 能与盐酸反应产生
能与盐酸反应产生 和一种黄绿色气体,该气体能与
和一种黄绿色气体,该气体能与 溶液反应被吸收,则
溶液反应被吸收,则 、
、 、
、 还原性由小到大的顺序是
还原性由小到大的顺序是_______ 。
 、少量
、少量 、
、 )制取
)制取 的工艺流程如图:
的工艺流程如图:
已知:溶液中四种含钒微粒的存在形式和颜色:
 紫色、
紫色、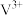 绿色、
绿色、 蓝色,
蓝色, 黄色。回答下列问题:
黄色。回答下列问题:(1)“酸浸、还原”时,
 被还原为
被还原为 ,该反应的离子方程式为
,该反应的离子方程式为(2)“碱浸、氧化”过程中会生成
 ,在20.00mL
,在20.00mL
 溶液中,加入0.195g锌粉,恰好完全反应,则所得溶液的颜色为
溶液中,加入0.195g锌粉,恰好完全反应,则所得溶液的颜色为(3)将废钒催化剂与稀硫酸、亚硫酸钾溶液混合,充分反应后也能生成
 等离子,写出生成
等离子,写出生成 离子的化学方程式是
离子的化学方程式是(4)向上述所得溶液中加入
 溶液,完善并配平反应的离子方程式
溶液,完善并配平反应的离子方程式_____
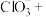 ____
____ _____=_____
_____=_____ _____
_____ _____
_____(5)
 能与盐酸反应产生
能与盐酸反应产生 和一种黄绿色气体,该气体能与
和一种黄绿色气体,该气体能与 溶液反应被吸收,则
溶液反应被吸收,则 、
、 、
、 还原性由小到大的顺序是
还原性由小到大的顺序是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】在印染工业中,连二亚硫酸钠( )能使染好的布褪色,也能使布重新染色,故俗称保险粉。实验室模拟工业生产保险粉的工艺流程如图所示:
)能使染好的布褪色,也能使布重新染色,故俗称保险粉。实验室模拟工业生产保险粉的工艺流程如图所示:
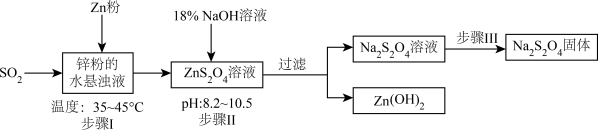
已知: 为白色固体,易溶于水,难溶于乙醇,在空气中极易被氧化,在碱性介质中稳定。
为白色固体,易溶于水,难溶于乙醇,在空气中极易被氧化,在碱性介质中稳定。
(1)工业上获得锌粉的方法为:将锌块加热熔化得到锌液,向锌液中不断鼓入 气体,冷却后可获得锌粉。鼓入
气体,冷却后可获得锌粉。鼓入 气体的目的除了防止氧化外,还有
气体的目的除了防止氧化外,还有__ 。
(2)在步骤I中,控制反应温度比较适宜的方法是___________ 加热(填“水浴”“油浴”或“砂浴”)。
(3)已知: 与
与 性质相似,当pH大于10.5时开始溶解,写出步骤II中碱性较强时
性质相似,当pH大于10.5时开始溶解,写出步骤II中碱性较强时 溶解的离子方程式:
溶解的离子方程式:___________ 。
(4)已知:水溶液温度低于52℃时 以
以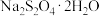 形态结晶,碱性溶液中温度高于52℃时
形态结晶,碱性溶液中温度高于52℃时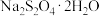 脱水成无水盐。
脱水成无水盐。
步骤III的操作过程为:在无氧减压的环境中,将 碱性溶液于60℃左右蒸发至有大量晶体析出,趁热过滤、洗涤、减压干燥。趁热过滤的目的是
碱性溶液于60℃左右蒸发至有大量晶体析出,趁热过滤、洗涤、减压干燥。趁热过滤的目的是___________ ;操作中常选用无水乙醇洗涤,其优点是___________ 、___________ 。
(5) 碱性溶液与
碱性溶液与 溶液反应有纳米银生成,该反应能用于
溶液反应有纳米银生成,该反应能用于 的纯度测定。若10mL
的纯度测定。若10mL 碱性溶液与20mL
碱性溶液与20mL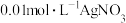 溶液恰好完全反应,则该反应的离子方程式为
溶液恰好完全反应,则该反应的离子方程式为___________ 。
 )能使染好的布褪色,也能使布重新染色,故俗称保险粉。实验室模拟工业生产保险粉的工艺流程如图所示:
)能使染好的布褪色,也能使布重新染色,故俗称保险粉。实验室模拟工业生产保险粉的工艺流程如图所示:
已知:
 为白色固体,易溶于水,难溶于乙醇,在空气中极易被氧化,在碱性介质中稳定。
为白色固体,易溶于水,难溶于乙醇,在空气中极易被氧化,在碱性介质中稳定。(1)工业上获得锌粉的方法为:将锌块加热熔化得到锌液,向锌液中不断鼓入
 气体,冷却后可获得锌粉。鼓入
气体,冷却后可获得锌粉。鼓入 气体的目的除了防止氧化外,还有
气体的目的除了防止氧化外,还有(2)在步骤I中,控制反应温度比较适宜的方法是
(3)已知:
 与
与 性质相似,当pH大于10.5时开始溶解,写出步骤II中碱性较强时
性质相似,当pH大于10.5时开始溶解,写出步骤II中碱性较强时 溶解的离子方程式:
溶解的离子方程式:(4)已知:水溶液温度低于52℃时
 以
以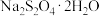 形态结晶,碱性溶液中温度高于52℃时
形态结晶,碱性溶液中温度高于52℃时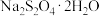 脱水成无水盐。
脱水成无水盐。步骤III的操作过程为:在无氧减压的环境中,将
 碱性溶液于60℃左右蒸发至有大量晶体析出,趁热过滤、洗涤、减压干燥。趁热过滤的目的是
碱性溶液于60℃左右蒸发至有大量晶体析出,趁热过滤、洗涤、减压干燥。趁热过滤的目的是(5)
 碱性溶液与
碱性溶液与 溶液反应有纳米银生成,该反应能用于
溶液反应有纳米银生成,该反应能用于 的纯度测定。若10mL
的纯度测定。若10mL 碱性溶液与20mL
碱性溶液与20mL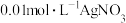 溶液恰好完全反应,则该反应的离子方程式为
溶液恰好完全反应,则该反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业,它不溶于 、
、 和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[
和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[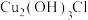 ]。以铜矿粉(含
]。以铜矿粉(含 、
、 、CuS及少量FeS等)为原料制取CuCl的工艺流程如图:
、CuS及少量FeS等)为原料制取CuCl的工艺流程如图:

已知:FeS高温条件下与氧气反应生成FeO; 高温条件下与氧气反应生成
高温条件下与氧气反应生成 ;
; 在酸性条件下会发生歧化反应。回答下列问题:
在酸性条件下会发生歧化反应。回答下列问题:
(1)“酸浸”时 发生反应的化学方程式为
发生反应的化学方程式为___________ 。“搅拌”时加入NaCl粉末的作用是___________ 。
(2)可在上述流程中循环利用的物质有___________ (填化学式),加热时试剂X的作用是___________ 。
(3)洗涤CuCl晶体所用的试剂为___________ (填序号),洗涤后并在真空干燥机内于70℃干燥2小时,冷却,密封包装。于70℃真空干燥的目的是___________ 。
a.饱和 溶液 b.NaOH溶液 c.无水乙醇 d.稀硫酸
溶液 b.NaOH溶液 c.无水乙醇 d.稀硫酸
(4)流程中“滤渣”的主要成分是___________ (填化学式)。
(5)测定产品中氯化亚铜的质量分数,实验过程如下:准确称取制备的氯化亚铜产品0.250g,将其置于足量的 溶液中,待样品全部溶解后,加入适量稀硫酸,用
溶液中,待样品全部溶解后,加入适量稀硫酸,用 的硫酸铈[
的硫酸铈[ ]标准溶液滴定到终点,消耗硫酸铈溶液24.60mL,反应中
]标准溶液滴定到终点,消耗硫酸铈溶液24.60mL,反应中 被还原为
被还原为 (已知
(已知 ),则产品中氯化亚铜的纯度为
),则产品中氯化亚铜的纯度为___________ (保留三位有效数字)。
 、
、 和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[
和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[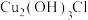 ]。以铜矿粉(含
]。以铜矿粉(含 、
、 、CuS及少量FeS等)为原料制取CuCl的工艺流程如图:
、CuS及少量FeS等)为原料制取CuCl的工艺流程如图:
已知:FeS高温条件下与氧气反应生成FeO;
 高温条件下与氧气反应生成
高温条件下与氧气反应生成 ;
; 在酸性条件下会发生歧化反应。回答下列问题:
在酸性条件下会发生歧化反应。回答下列问题:(1)“酸浸”时
 发生反应的化学方程式为
发生反应的化学方程式为(2)可在上述流程中循环利用的物质有
(3)洗涤CuCl晶体所用的试剂为
a.饱和
 溶液 b.NaOH溶液 c.无水乙醇 d.稀硫酸
溶液 b.NaOH溶液 c.无水乙醇 d.稀硫酸(4)流程中“滤渣”的主要成分是
(5)测定产品中氯化亚铜的质量分数,实验过程如下:准确称取制备的氯化亚铜产品0.250g,将其置于足量的
 溶液中,待样品全部溶解后,加入适量稀硫酸,用
溶液中,待样品全部溶解后,加入适量稀硫酸,用 的硫酸铈[
的硫酸铈[ ]标准溶液滴定到终点,消耗硫酸铈溶液24.60mL,反应中
]标准溶液滴定到终点,消耗硫酸铈溶液24.60mL,反应中 被还原为
被还原为 (已知
(已知 ),则产品中氯化亚铜的纯度为
),则产品中氯化亚铜的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
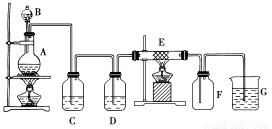
【推荐1】如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置。
试回答:
(1)C、G两个装置所盛放的试剂分别是:C__________ ;G ________ 。
(2)F中的现象为__________ ,G中出现了一种沉淀,该沉淀的化学式_________ 。
(3)写出在A、E发生反应的化学方程式为: A:_______________ ;E:__________________ 。

试回答:
(1)C、G两个装置所盛放的试剂分别是:C
(2)F中的现象为
(3)写出在A、E发生反应的化学方程式为: A:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验,请回答下列问题。

(1)淀粉-KI溶液变蓝色,反应的离子方程式为_______ 。
(2)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放的是_______ (填名称)。
(3) 与石灰乳反应制取漂白粉的化学方程式为
与石灰乳反应制取漂白粉的化学方程式为_______ 。
(4)该兴趣小组用8.7g二氧化锰与足量的浓盐酸制备氯气,则理论上最多可制得氯气的质量是_______ 。

(1)淀粉-KI溶液变蓝色,反应的离子方程式为
(2)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放的是
(3)
 与石灰乳反应制取漂白粉的化学方程式为
与石灰乳反应制取漂白粉的化学方程式为(4)该兴趣小组用8.7g二氧化锰与足量的浓盐酸制备氯气,则理论上最多可制得氯气的质量是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某化学兴趣小组同学利用以下装置制备干燥的氯气并对氯气的性质进行探究。
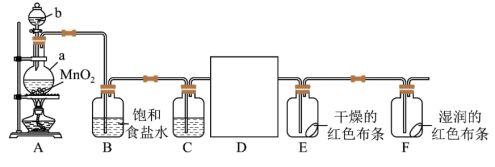
(1)A装置中b仪器名称_____ 。
(2)仪器a中发生反应的离子方程式为_____ ,D为收集干燥的氯气仪器,可以选择_____ (填序号)。

(3)下列有关该实验的说法中不正确的是______ (填字母)。
a.B中饱和食盐水主要作用之一是除去氯气中的氯化氢气体
b.C中试剂是浓硫酸,目的是干燥氯气
c.E中红色布条不褪色,F中红色布条褪色,证明氯气具有漂白性
d.尾气处理时,所用试剂可以选用澄清石灰水
(4)新冠肺炎疫情期间,“84消毒液”被广泛应用于物体表面杀菌消毒。制备“84消毒液”的化学反应方程式为______ 。
(5)利用数字化实验探究次氯酸的化学性质,用强光照射盛有氯水的密闭广口瓶;并用传感器测定广口瓶中数据,得到如图曲线。请用化学方程式解释曲线中氯离子的浓度和氧气体积分数变化的原因:_____ 。
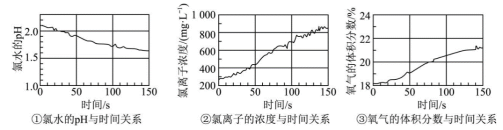
(6)该兴趣小组在40℃条件下,将一定量的Cl2通入一定量的NaOH溶液中,得到的产物中含有NaCl、NaClO和NaClO3,已知Cl-和ClO-的个数比为8:3,则此过程中氧化剂和还原剂的个数之比为_____ 。

(1)A装置中b仪器名称
(2)仪器a中发生反应的离子方程式为

(3)下列有关该实验的说法中不正确的是
a.B中饱和食盐水主要作用之一是除去氯气中的氯化氢气体
b.C中试剂是浓硫酸,目的是干燥氯气
c.E中红色布条不褪色,F中红色布条褪色,证明氯气具有漂白性
d.尾气处理时,所用试剂可以选用澄清石灰水
(4)新冠肺炎疫情期间,“84消毒液”被广泛应用于物体表面杀菌消毒。制备“84消毒液”的化学反应方程式为
(5)利用数字化实验探究次氯酸的化学性质,用强光照射盛有氯水的密闭广口瓶;并用传感器测定广口瓶中数据,得到如图曲线。请用化学方程式解释曲线中氯离子的浓度和氧气体积分数变化的原因:

(6)该兴趣小组在40℃条件下,将一定量的Cl2通入一定量的NaOH溶液中,得到的产物中含有NaCl、NaClO和NaClO3,已知Cl-和ClO-的个数比为8:3,则此过程中氧化剂和还原剂的个数之比为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】I.某实验小组利用以下装置制取氨气并探究氨气的性质:
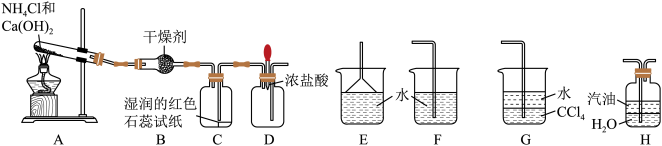
(1)装置A中发生反应的化学方程式为_______ 。
(2)装置B中的干燥剂是_______ (填名称)。
(3)装置C中的现象是_______ 。
(4)实验进行一段时间后,挤压装置D中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是_______ ,发生反应的化学方程式为_______ 。
(5)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气吸收装置,应选用的装置是_______ (填“E”、“F”、“G”或“H”)。
Ⅱ.为探究氨的还原性,某同学设计了如图所示实验装置(其中夹持装置略去)。回答下列问题:
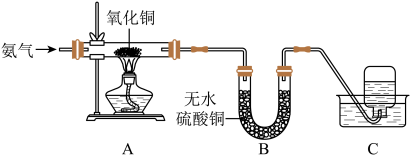
【实验现象】A中氧化铜全部转化成光亮的红色固体;B中U形管内物质变蓝;
(6)C中集气瓶内收集到一种无色气态单质,该气体用排水法收集的理由是_______
(7)从C中水槽里取适量液体于试管内,向试管里滴入无色酚酞试液,溶液呈_______ 色,原因是_______ 。
【实验结论】
(8)该实验证明氨气具有_______ 性,可与氧化铜反应,化学方程式是_______ 。

(1)装置A中发生反应的化学方程式为
(2)装置B中的干燥剂是
(3)装置C中的现象是
(4)实验进行一段时间后,挤压装置D中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是
(5)为防止过量氨气外逸,需要在上述装置的末端增加一个尾气吸收装置,应选用的装置是
Ⅱ.为探究氨的还原性,某同学设计了如图所示实验装置(其中夹持装置略去)。回答下列问题:

【实验现象】A中氧化铜全部转化成光亮的红色固体;B中U形管内物质变蓝;
(6)C中集气瓶内收集到一种无色气态单质,该气体用排水法收集的理由是
(7)从C中水槽里取适量液体于试管内,向试管里滴入无色酚酞试液,溶液呈
【实验结论】
(8)该实验证明氨气具有
您最近一年使用:0次
【推荐2】已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。 某些产物可能略去
某些产物可能略去 请回答下列问题:
请回答下列问题:
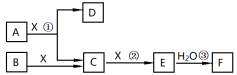
(1)若E是红棕色气体,F是一元强酸,反应①是工业制备F的第一步反应.
① 写出A与X反应的化学方程式:________ 。
② 在常温下,向pH=12的A的水溶液中加入等体积pH=2的盐酸,则反应后溶液的pH_____ 7(填“<”、“=”或“>”)
③ 已知常温下46g气体E与 发生反应③放出46kJ热量,写出气体E与
发生反应③放出46kJ热量,写出气体E与 发生反应③的热化学方程式
发生反应③的热化学方程式_____ 。
(2)若E为无色无味气体, F是二元弱酸:
① 请写出和E互为等电子体的一种分子的分子式:_______ 。
② 将少量气体E通入氢氧化钡溶液中得不溶物H,现将该沉淀放入0.1mol·L-1 的 溶液中,其
溶液中,其 
_____ (填“增大”、“减小”或“不变”),此时组成不溶物H的阴离子在溶液中的浓度为_______ mol·L-1 。(H的
 某些产物可能略去
某些产物可能略去 请回答下列问题:
请回答下列问题: 
(1)若E是红棕色气体,F是一元强酸,反应①是工业制备F的第一步反应.
① 写出A与X反应的化学方程式:
② 在常温下,向pH=12的A的水溶液中加入等体积pH=2的盐酸,则反应后溶液的pH
③ 已知常温下46g气体E与
 发生反应③放出46kJ热量,写出气体E与
发生反应③放出46kJ热量,写出气体E与 发生反应③的热化学方程式
发生反应③的热化学方程式(2)若E为无色无味气体, F是二元弱酸:
① 请写出和E互为等电子体的一种分子的分子式:
② 将少量气体E通入氢氧化钡溶液中得不溶物H,现将该沉淀放入0.1mol·L-1 的
 溶液中,其
溶液中,其 

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】下图为从反面看到的某套实验装置示意图,无法看到实验说明,加热装置已经省略。

甲同学认为此套装置用于合成物质X,E处冰水冷却的U形管中有固体X(X溶于水得到中学化学常见强酸)出现;乙同学认为此套装置用于合成物质Y,E处冰水冷却的U形管中才有红棕色气体Y生成,并且越接近U形管底部颜色越浅。对于A处,甲认为有加热装置,乙认为没有。
(1)事实上此装置所附实验说明符合甲同学的推断,那么X的化学式是________ ,C装置中盛放的液体药品是___________ 。其作用是_______________________________ 。
(2)若要用上述装置完成乙同学所认为的实验,C处所起作用与合成X时所起作用相似,那么C处的广口瓶应改为_______________ ,所装药品为_______________ 。
(3)写出乙同学认为的D装置中发生反应的化学方程式_______________ 。为什么此时U形管中的红棕色气体越接近管底颜色越浅?__________________________________ 。

甲同学认为此套装置用于合成物质X,E处冰水冷却的U形管中有固体X(X溶于水得到中学化学常见强酸)出现;乙同学认为此套装置用于合成物质Y,E处冰水冷却的U形管中才有红棕色气体Y生成,并且越接近U形管底部颜色越浅。对于A处,甲认为有加热装置,乙认为没有。
(1)事实上此装置所附实验说明符合甲同学的推断,那么X的化学式是
(2)若要用上述装置完成乙同学所认为的实验,C处所起作用与合成X时所起作用相似,那么C处的广口瓶应改为
(3)写出乙同学认为的D装置中发生反应的化学方程式
您最近一年使用:0次



