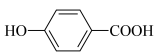
下列说法正确的是
A. P4和CH4都是正四面体形分子且键角都为 |
| B.C-C键的键能大于C-Si键,所以C60熔点高于金刚砂SiC |
| C.凡是中心原子采取sp3杂化方式成键的分子其空间结构都是正四面体形 |
| D.若ABn型分子的中心原子A上没有孤电子对,则ABn为非极性分子 |
更新时间:2024-04-09 07:42:29
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下列有关分子结构的描述正确的是
A. 的空间结构为三角锥形 的空间结构为三角锥形 |
B. 的VSEPR模型为 的VSEPR模型为 形 形 |
C. 分子为直线形,分子中 分子为直线形,分子中 键和 键和 键的个数比为 键的个数比为 |
D. 为正四面体形分子,能与水分子形成分子间氢键 为正四面体形分子,能与水分子形成分子间氢键 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】如图是C、N、O、S四种元素的简单氢化物的键角高低关系图(92°~109°28'之间),则有关说法正确的是
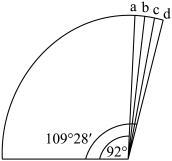

| A.b为NH3,c为CH4 |
| B.a分子的VSEPR构型和空间结构相同 |
| C.d在水中的溶解度大于在四氯化碳中的溶解度 |
| D.沸点b>c>a>d |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】根据价层电子对互斥模型,判断下列分子或离子的空间构型为三角锥形的是
| A.H2O | B. | C.BF3 | D.PCl3 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】类比推理是化学中常用的思维方法,下列推理合理的是
| A.Fe与Cl2反应可生成FeCl3,推测Fe与I2反应生成FeI3 |
| B.CaO与Al2O3都可与酸反应生成对应的盐和水,推测两者都属于碱性氧化物 |
| C.SO2与CaCl2溶液不反应,推测SO2与Ca(NO3)2溶液也不反应 |
| D.CO2是直线型分子,推测CS2也是直线型分子 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列叙述正确的是
| A.烯烃中的碳碳双键由l个δ键和l个π键组成 |
| B.2s轨道可以和3p轨道形成sp2杂化轨道 |
| C.由极性键组成的分子,一定是极性分子 |
| D.甲烷中sp3杂化轨道的构型是平面正方形 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】三氯化氮(NCl3)常温是一种淡黄色液体,其分子结构呈三角锥形,以下关于NCl3的说法中正确的是
| A.它是一种非极性分子 |
| B.它能以配位键与Cl-结合,生成NCl4- |
| C.其挥发性比PCl3小 |
| D.已知NCl3中N元素为-3价,所以NCl3水解产物为NH3和HClO |
您最近一年使用:0次
【推荐1】NO 在维持心血管功能方面具有重要作用,实验室通过干法制备NO的原理为:3KNO2+KNO3+Cr2O3═2K2CrO4+4NO↑。 下列说法不正确的是
| A.NO是极性分子 |
B. 的键角小于NO 的键角小于NO |
| C.氧化产物与还原产物的物质的量之比1∶2 |
| D.每消耗 10.1 g KNO3时,被KNO3氧化的Cr2O3为0.1 mol |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】一种因具有成本低廉及反应性质多样等优点被用作有机合成的缩合试剂,其由4种短周期非金属元素组成,结构如图所示,其中W、X、Y为同一周期,X与Z为同一主族。下列说法正确的是
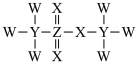
| A.简单氢化物的沸点:Y>W | B.电负性:X>W>Y>Z |
| C.XW2中元素X为sp3杂化 | D.YX2是含极性键的极性分子 |
您最近一年使用:0次

 、ClO
、ClO 等离子。下列说法错误是
等离子。下列说法错误是
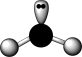
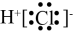
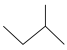 的名称:3-甲基丁烷
的名称:3-甲基丁烷 键的键能大于
键的键能大于 键
键 的成键电子对间排斥力较大,所以
的成键电子对间排斥力较大,所以 大
大 中B、S杂化轨道类型相同,二者VSEPR模型均为平面三角形
中B、S杂化轨道类型相同,二者VSEPR模型均为平面三角形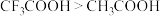 ,则碱性(即结合
,则碱性(即结合 能力):
能力):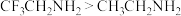
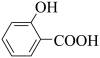 +CH3OH
+CH3OH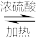
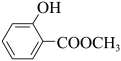 +H2O 。
+H2O 。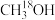 进行示踪,可得产物
进行示踪,可得产物