铬、钛、钴都属于过渡元素。
(1)铬元素属于周期表的___________ 区,基态Cr原子有___________ 个未成对电子。同周期的基态原子中,与Cr最高能层电子数相同的还有___________ (写元素符号)。
(2)钛元素形成的钛酸钡晶体的晶胞结构如图所示,该晶体经X射线分析得出,重复单元为立方体,顶点位置被Ti4+所占据,体心位置被Ba2+所占据,棱心位置被O2-所占据。___________ 。
②若将Ti4+置于晶胞的体心,Ba2+置于晶胞顶点,则O2-处于立方体的___________ 位置。
③Ti4+的氧配位数和Ba2+的氧配位数分别为___________ 。
(3)钴的某种配合物的化学式为[Co(H2O)6]F2,该配合物的立方晶胞如图所示,其晶胞参数为apm。___________ 个。
②设阿伏加德罗常数的值为NA,则[Co(H2O)6]F2晶体的密度为___________ g·cm-3。
(1)铬元素属于周期表的
(2)钛元素形成的钛酸钡晶体的晶胞结构如图所示,该晶体经X射线分析得出,重复单元为立方体,顶点位置被Ti4+所占据,体心位置被Ba2+所占据,棱心位置被O2-所占据。
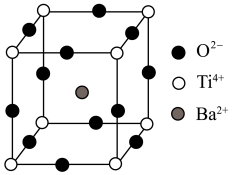
②若将Ti4+置于晶胞的体心,Ba2+置于晶胞顶点,则O2-处于立方体的
③Ti4+的氧配位数和Ba2+的氧配位数分别为
(3)钴的某种配合物的化学式为[Co(H2O)6]F2,该配合物的立方晶胞如图所示,其晶胞参数为apm。
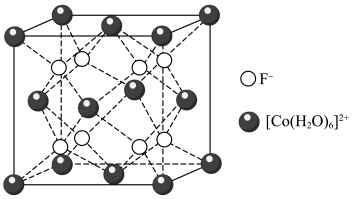
②设阿伏加德罗常数的值为NA,则[Co(H2O)6]F2晶体的密度为
更新时间:2024-04-11 12:54:49
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】铁及其化合物在生产生活中应用非常广泛,回答下列问题:
(1)根据价电子排布规律,铁元素位于元素周期表的_______ 区,下列状态的铁中,电离最外层一个电子所需能量最大的是_______ (填标号)。
a.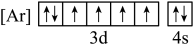 b.
b.
c.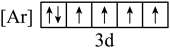 d.
d.
(2)有历史记载的第一个配合物是Fe4[Fe(CN)6]3(普鲁士蓝)。[Fe(CN)6]4-中σ键数目为_______ ,[Fe(CN)6]4-的空间结构为_______ 形。已知可溶性氰化物如KCN有剧毒,但普鲁士蓝无毒,请从结构角度解释原因:_______ 。
(3)某补铁剂的主要成分为琥珀酸亚铁,可用邻二氮菲测定Fe2+的含量,适宜pH范围为2~9,反应原理为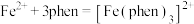 。邻二氮菲(平面形)与琥珀酸亚铁结构简式如图。下列说法正确的是
。邻二氮菲(平面形)与琥珀酸亚铁结构简式如图。下列说法正确的是_______ 。
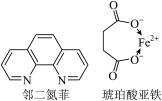
a.琥珀酸不具有旋光性
b.[Fe(phen)3]2+中,Fe2+的配位数为3
c.当pH<2时,邻二氮菲中的N会优先与H+形成配位键
d.邻二氮菲中N原子的孤电子对占据2p轨道
(4)Zn与S形成某种化合物的晶胞如图所示。
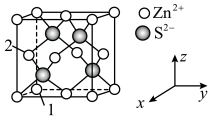
①用_______ 实验证明ZnS为晶体最科学。
②已知晶体密度为 ,S2-半径为apm,若要使S2-、Zn2+相切,则Zn2+半径为
,S2-半径为apm,若要使S2-、Zn2+相切,则Zn2+半径为_______ pm(写出计算表达式)。
(1)根据价电子排布规律,铁元素位于元素周期表的
a.
 b.
b.
c.
 d.
d.
(2)有历史记载的第一个配合物是Fe4[Fe(CN)6]3(普鲁士蓝)。[Fe(CN)6]4-中σ键数目为
(3)某补铁剂的主要成分为琥珀酸亚铁,可用邻二氮菲测定Fe2+的含量,适宜pH范围为2~9,反应原理为
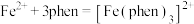 。邻二氮菲(平面形)与琥珀酸亚铁结构简式如图。下列说法正确的是
。邻二氮菲(平面形)与琥珀酸亚铁结构简式如图。下列说法正确的是
a.琥珀酸不具有旋光性
b.[Fe(phen)3]2+中,Fe2+的配位数为3
c.当pH<2时,邻二氮菲中的N会优先与H+形成配位键
d.邻二氮菲中N原子的孤电子对占据2p轨道
(4)Zn与S形成某种化合物的晶胞如图所示。

①用
②已知晶体密度为
 ,S2-半径为apm,若要使S2-、Zn2+相切,则Zn2+半径为
,S2-半径为apm,若要使S2-、Zn2+相切,则Zn2+半径为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。回答下列问题:
(1)基态Fe3+的电子排布式为___ 。
(2)实验室用KSCN溶液、苯酚(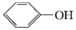 )检验Fe3+。N、O、S的第一电离能由大到小的顺序为
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为__ (用元素符号表示),苯酚中碳原子的杂化轨道类型为__ 。
(3)FeCl3的熔点为306℃,沸点为315℃,FeCl3的晶体类型是__ 。FeSO4常作补铁剂,SO 的立体构型是
的立体构型是__ 。
(4)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为__ 。
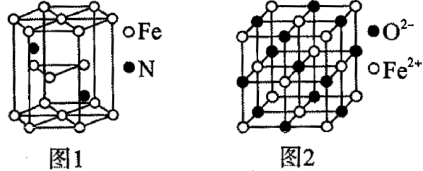
(5)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为__ ;Fe2+与O2-的最短间距为__ pm。
(1)基态Fe3+的电子排布式为
(2)实验室用KSCN溶液、苯酚(
 )检验Fe3+。N、O、S的第一电离能由大到小的顺序为
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为(3)FeCl3的熔点为306℃,沸点为315℃,FeCl3的晶体类型是
 的立体构型是
的立体构型是(4)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为

(5)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】N、Fe是两种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N 原子最高能级的电子云轮廓图形状为_____________ ;N原子的第一电离能比O原子的大,其原因是_________________________ ,基态铁原子的价电子排布图为_______
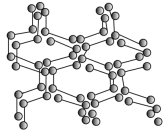
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为_________ 。这种高聚氮N-N 键的键能为160kJ/mol,而N2 的键能为942kJ/mol,其可能潜在的应用是______________________ 。
(3)叠氮化钠和氢叠氮酸(HN3)已一步步进入我们的生活,如汽车安全气囊等。
①写出与N3-属于等电子体的一种分子__________ (填分子式)。
②氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是___ (填标号)
A.上述生成HN3的化学方程式为:N2H4+HNO2= HN3+2 H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上
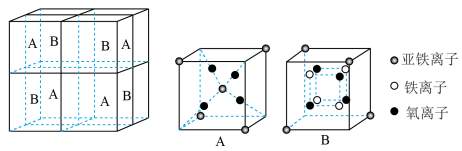
(4)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为______ (填最简整数比);已知该晶体的密度dg/cm3,阿伏伽德罗常数的值为NA,则晶胞参数为______ nm(用含d和NA的代数式表示)。
(5)一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心。每个铁原子又为两个八面体共用。则该化合物的化学式为_______ 。

(1)基态N 原子最高能级的电子云轮廓图形状为
(2)在高压下氮气会发生聚合得到高聚氮,晶体结构如图所示。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。氮原子的杂化轨道类型为

(3)叠氮化钠和氢叠氮酸(HN3)已一步步进入我们的生活,如汽车安全气囊等。
①写出与N3-属于等电子体的一种分子
②氢叠氮酸(HN3)可由肼(N2H4)被HNO2氧化制得,同时生成水。下列叙述错误的是
A.上述生成HN3的化学方程式为:N2H4+HNO2= HN3+2 H2O
B.NaN3的晶格能大于KN3的晶格能
C.氢叠氮酸(HN3)和水能形成分子间氢键
D.HN3和N2H4都是由极性键和非极性键构成的非极性分子。
E.HN3分子中四个原子可能在一条直线上
(4)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比为

(5)一种铁、碳形成的间隙化合物的晶体结构如图所示,其中碳原子位于铁原子形成的八面体的中心。每个铁原子又为两个八面体共用。则该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】现有A、B、C、D、E五种元素,他们性质如下:
请回答如下问题:
(1)E原子有___________ 个未成对电子,二价E离子的电子排布式为___________ 。
(2)A2D分子中D原子的杂化类型是___________ ,D的氧化物DO3分子空间构型为___________ 。
(3)CA3极易溶于水,其原因主要是___________ ,试判断CA3溶于水后,形成CA3·H2O的合理结构:___________ (填“a”或“b”),推理依据是___________ (用相关方程式表示)。
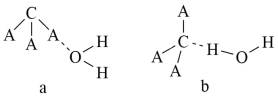
(4)在ESO4溶液中滴入过量氨水,E2+形成深蓝色配合物的离子方程式为:___________ 。
(5)ZnD的晶胞结构如图1所示,在ZnD晶胞中,D2-的配位数为___________ 。

(6)E与金形成的金属互化物结构如图2所示,其晶胞边长为a nm,该金属互化物的密度为___________ (用含a、NA的代数式表示)g·cm-3。

| A | 周期表中原子半径最小的元素 |
| B | 电负性最大的元素 |
| C | C的2p轨道中有三个未成对的单电子 |
| D | 原子核外电子数是B与C核外电子数之和 |
| E | E能形成红色(或砖红色) E2O和黑色的EO两种氧化物 |
(1)E原子有
(2)A2D分子中D原子的杂化类型是
(3)CA3极易溶于水,其原因主要是

(4)在ESO4溶液中滴入过量氨水,E2+形成深蓝色配合物的离子方程式为:
(5)ZnD的晶胞结构如图1所示,在ZnD晶胞中,D2-的配位数为

(6)E与金形成的金属互化物结构如图2所示,其晶胞边长为a nm,该金属互化物的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】半硫卡巴腙与放射性64Cu形成的配合物X可用于放射性治疗癌症。该配合物的分子结构如图所示,其中环上的所有原子共平面。
(1)基态64Cu原子的价电子排布式为___________ 。
(2)配合物X中,铜的化合价为____ ,N与Cu形成______ 键。
(3)基态S原子核外能量不同的电子有_____ 种。O和S处于同一主族,但H2O的键角比H2S的键角大,原因是_______________ 。
(4)单质S与热NaOH溶液反应生成Na2SO3、Na2S。 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为______ ;Na2S溶液还可溶解单质硫生成Na2Sx,其中 的空间构型为
的空间构型为_______ 。
(5)某铁的硫化物的结构属立方晶系,晶胞结构如图所示。________ 。若晶胞参数为apm,则晶体密度为____ g/cm3(列出计算式,NA表示阿伏加德罗常数的值)。
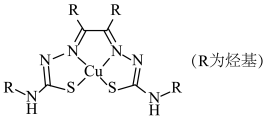
(1)基态64Cu原子的价电子排布式为
(2)配合物X中,铜的化合价为
(3)基态S原子核外能量不同的电子有
(4)单质S与热NaOH溶液反应生成Na2SO3、Na2S。
 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为 的空间构型为
的空间构型为(5)某铁的硫化物的结构属立方晶系,晶胞结构如图所示。

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】工业中可利用生产钛白的副产物 和硫铁矿(
和硫铁矿( )联合制备铁精粉(
)联合制备铁精粉( )和硫酸,实现能源及资源的有效利用。回答下列问题:
)和硫酸,实现能源及资源的有效利用。回答下列问题:
(1)在 气氛中,
气氛中,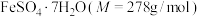 的脱水热分解过程如图1(a)所示
的脱水热分解过程如图1(a)所示

根据上述实验结果,可知
______ 。 结构示意图如图1(b),其中
结构示意图如图1(b),其中 与
与 、
、 与
与 的作用力类型分别是
的作用力类型分别是______ 、______ ,该物质脱水热分解过程中首先断开的是______ 键。
(2)已知下列热化学方程式:


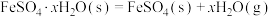



则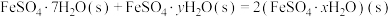 的
的
______  。
。
(3)将 置入抽空的刚性容器中,升高温度发生分解反应:
置入抽空的刚性容器中,升高温度发生分解反应: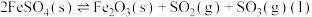 。平衡时
。平衡时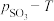 的关系如图2所示。660K时,该反应的平衡总压
的关系如图2所示。660K时,该反应的平衡总压
______  、平衡常数
、平衡常数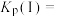
______  。
。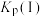 随反应温度升高而
随反应温度升高而______ (填“增大”“减小”或“不变”)。

 和硫铁矿(
和硫铁矿( )联合制备铁精粉(
)联合制备铁精粉( )和硫酸,实现能源及资源的有效利用。回答下列问题:
)和硫酸,实现能源及资源的有效利用。回答下列问题:(1)在
 气氛中,
气氛中,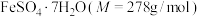 的脱水热分解过程如图1(a)所示
的脱水热分解过程如图1(a)所示
根据上述实验结果,可知

 结构示意图如图1(b),其中
结构示意图如图1(b),其中 与
与 、
、 与
与 的作用力类型分别是
的作用力类型分别是(2)已知下列热化学方程式:


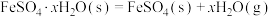



则
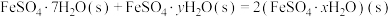 的
的
 。
。(3)将
 置入抽空的刚性容器中,升高温度发生分解反应:
置入抽空的刚性容器中,升高温度发生分解反应: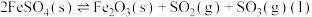 。平衡时
。平衡时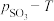 的关系如图2所示。660K时,该反应的平衡总压
的关系如图2所示。660K时,该反应的平衡总压
 、平衡常数
、平衡常数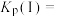
 。
。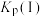 随反应温度升高而
随反应温度升高而
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】铁的化合物种类繁多,应用广泛。回答下列问题:
(1)某含Fe2+的结晶水合物的结构片段如图所示(球与球之间的短线代表单键或双键)。
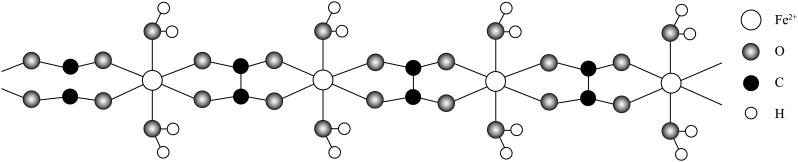
该结晶水合物的化学式为___________ ,其中Fe2+和H2O之间的作用力类型为___________ 。
(2)南开大学某课题组成功合成无机二茂铁的配离子[FeP8]2–,其中环状配体P 以π电子参与配位,结构如图。该配离子中与Fe2+形成配位键的电子共有
以π电子参与配位,结构如图。该配离子中与Fe2+形成配位键的电子共有___________ 个,P原子的价层孤电子对占据___________ (填标号)。
A.3s轨道 B.3p轨道 C.sp2杂化轨道 D.sp3杂化轨道

(3)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。由铁、钾、硒形成的一种超导材料的晶胞结构如下图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
晶胞中Fe的数目为___________ ,距离K(0.5,0.5,0.5)最近的Se的数目为___________ ,该晶体的密度ρ=___________ g·cm–3.(NA表示阿伏加德罗常数的值,用含a、c、NA的计算式表示),该晶胞在yz平面投影为___________ (填标号)。
A.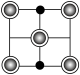 B.
B.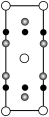 C.
C.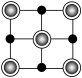 D.
D.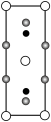
(1)某含Fe2+的结晶水合物的结构片段如图所示(球与球之间的短线代表单键或双键)。

该结晶水合物的化学式为
(2)南开大学某课题组成功合成无机二茂铁的配离子[FeP8]2–,其中环状配体P
 以π电子参与配位,结构如图。该配离子中与Fe2+形成配位键的电子共有
以π电子参与配位,结构如图。该配离子中与Fe2+形成配位键的电子共有A.3s轨道 B.3p轨道 C.sp2杂化轨道 D.sp3杂化轨道

(3)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。由铁、钾、硒形成的一种超导材料的晶胞结构如下图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
| 原子 坐标 | x | y | z | 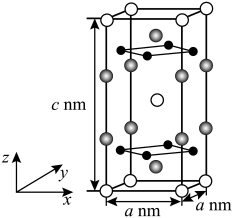 |
| K | 0.5 | 0.5 | 0.5 | |
| Fe | 0 | 0.5 | m | |
| Se | 0 | 0 | n | |
| 注:m、n均≠0 | ||||
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过________ 方法区分晶体、准晶体和非晶体。
(2)基态K原子中,核外电子排布图是_________ ,占据最高能层电子的电子云轮廓图形状为___________ 。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是______________________________________ 。
(3)测定发现I3AsF6中存在I3+离子。I3+离子的几何构型为_____________ ,中心原子的杂化类型为________________ 。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______ nm,与K紧邻的O个数为__________ 。

(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______ 位置,O处于______ 位置。
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过
(2)基态K原子中,核外电子排布图是
(3)测定发现I3AsF6中存在I3+离子。I3+离子的几何构型为
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为

(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________ (用对应的元素符号表示);基态D原子的价电子排布式为______________________ 。
(2)A的最高价氧化物分子中,其中心原子采取________ 杂化;BC3-的立体构型为________ (用文字描述)。
(3)1 mol AB-中含有的π键个数为________ 。
(4)化合物CH3COO[Cu(NH3)3·CO]中与Cu+形成配离子的配体为____________ (填化学式)。
(5) CH3COOH中C原子杂化轨道类型为_________________ 。

(6)元素D与元素C形成一种化合物其晶胞结构如图所示,该化合物的化学式为______ .
(1)A、B、C的第一电离能由小到大的顺序是
(2)A的最高价氧化物分子中,其中心原子采取
(3)1 mol AB-中含有的π键个数为
(4)化合物CH3COO[Cu(NH3)3·CO]中与Cu+形成配离子的配体为
(5) CH3COOH中C原子杂化轨道类型为

(6)元素D与元素C形成一种化合物其晶胞结构如图所示,该化合物的化学式为
您最近一年使用:0次



