工业上使用氯化粗五氧化二钒(杂质为Ti、Al的氧化物)的方法制备三氯氧钒( ),其装置如图所示(加热及夹持装置略)。已知:
),其装置如图所示(加热及夹持装置略)。已知: 熔点为−77℃,沸点为126℃,易水解(装置A为制备氯气的装置,未画出)。
熔点为−77℃,沸点为126℃,易水解(装置A为制备氯气的装置,未画出)。
(1)常温下,装置A中氯酸钾固体与浓盐酸发生反应,该反应中氧化剂和还原剂物质的量之比为________ ,装置A与实验室制取下列气体的装置相同的是________ (选填标号)。
a.铜与浓硫酸反应制二氧化硫 b.石灰石与盐酸反应制二氧化碳
c.熟石灰与氯化铵反应制氨气 d.过氧化钠和水反应制氧气
(2)装置C中盛装的试剂可以是________ ;实验开始先打开K,通入 一段时间后,加热
一段时间后,加热 装置,可产生一种还原性气体,则D装置中反应生成
装置,可产生一种还原性气体,则D装置中反应生成 的化学方程式为
的化学方程式为________ 。
(3)当D中反应结束后,停止加热,停止通氯气,此时杂质以氯化物的形式溶解在产物中,关闭开关K后,接下来进行的操作是________ (填操作名称)。
(4)装置H的作用为________ 。
(5)经检测,G所得的 中还含有
中还含有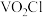 杂质,为测定其中
杂质,为测定其中 的质量分数,做如下实验:
的质量分数,做如下实验:
①取下锥形瓶,称量产品和锥形瓶的质量为 ;
;
②加入超纯水形成钒溶液,再向该钒溶液中加入氨水, 和
和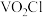 都会与氨水反应产生
都会与氨水反应产生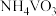 沉淀和
沉淀和 ;
;
③过滤洗涤后,将洗涤液与滤液合并后配制成250mL溶液,取25mL用浓度为 的
的 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 溶液
溶液 ;
;
④将锥形瓶洗涤干燥后称量其质量为 。
。
则 的质量分数表达式为
的质量分数表达式为________ ,下列情况会导致 的质量分数偏低的是
的质量分数偏低的是________ (选填标号)。
a.操作③过滤洗涤后,未将洗涤液与滤液合并
b.产品中残留少量 杂质
杂质
c.滴定读取标准液数据时,开始仰视,结束俯视
 ),其装置如图所示(加热及夹持装置略)。已知:
),其装置如图所示(加热及夹持装置略)。已知: 熔点为−77℃,沸点为126℃,易水解(装置A为制备氯气的装置,未画出)。
熔点为−77℃,沸点为126℃,易水解(装置A为制备氯气的装置,未画出)。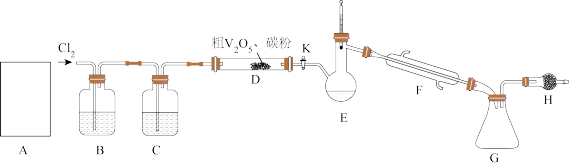
(1)常温下,装置A中氯酸钾固体与浓盐酸发生反应,该反应中氧化剂和还原剂物质的量之比为
a.铜与浓硫酸反应制二氧化硫 b.石灰石与盐酸反应制二氧化碳
c.熟石灰与氯化铵反应制氨气 d.过氧化钠和水反应制氧气
(2)装置C中盛装的试剂可以是
 一段时间后,加热
一段时间后,加热 装置,可产生一种还原性气体,则D装置中反应生成
装置,可产生一种还原性气体,则D装置中反应生成 的化学方程式为
的化学方程式为(3)当D中反应结束后,停止加热,停止通氯气,此时杂质以氯化物的形式溶解在产物中,关闭开关K后,接下来进行的操作是
(4)装置H的作用为
(5)经检测,G所得的
 中还含有
中还含有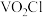 杂质,为测定其中
杂质,为测定其中 的质量分数,做如下实验:
的质量分数,做如下实验:①取下锥形瓶,称量产品和锥形瓶的质量为
 ;
;②加入超纯水形成钒溶液,再向该钒溶液中加入氨水,
 和
和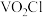 都会与氨水反应产生
都会与氨水反应产生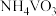 沉淀和
沉淀和 ;
;③过滤洗涤后,将洗涤液与滤液合并后配制成250mL溶液,取25mL用浓度为
 的
的 标准溶液进行滴定,消耗
标准溶液进行滴定,消耗 溶液
溶液 ;
;④将锥形瓶洗涤干燥后称量其质量为
 。
。则
 的质量分数表达式为
的质量分数表达式为 的质量分数偏低的是
的质量分数偏低的是a.操作③过滤洗涤后,未将洗涤液与滤液合并
b.产品中残留少量
 杂质
杂质c.滴定读取标准液数据时,开始仰视,结束俯视
2024·河北保定·一模 查看更多[2]
更新时间:2024-05-02 23:14:31
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】无水FeCl3呈棕红色,极易潮解,100℃左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。
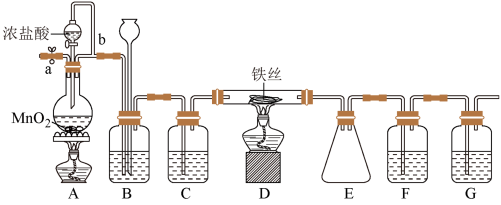
请回答:
(1)装置A中反应的化学方程式为_______________________________ 。
(2)装置F中所加的试剂为______________ 。
(3)导管b的作用为_________________ ;装置B的作用为____________________________ 。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为___________ 。
(5)反应结束后,拆卸装置前,必须进行的操作是_____________________________ 。
(6)为检验所得产品中是否含有FeCl2,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入一种试剂,该试剂为________ (填序号)。
①Fe粉 ②KSCN溶液 ③酸性KMnO4溶液 ④NaOH溶液

请回答:
(1)装置A中反应的化学方程式为
(2)装置F中所加的试剂为
(3)导管b的作用为
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为
(5)反应结束后,拆卸装置前,必须进行的操作是
(6)为检验所得产品中是否含有FeCl2,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入一种试剂,该试剂为
①Fe粉 ②KSCN溶液 ③酸性KMnO4溶液 ④NaOH溶液
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】TiCl4是制备金属钛的重要中间体。某小组同学利用如下装置在实验室制备TiCl4(夹持装置略去)。

已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如下表所示:
回答下列问题:
(1)A装置仪器b的名称是___________ ,E装置中的试剂是_________________ 。
(2)装置A中发生反应的离子方程式为________ 。
(3)在通入Cl2前,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是______________________________ 。
(4)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为:___ 。
(5)制得的TiCl4中常含有少量CCl4,从混合液中分离出TiCl4操作的名称是______ 。
(6)利用如图装置测定所得TiCl4的纯度:

取wg产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1mol·L-1K2CrO4溶液作指示剂,用cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液VmL。已知:常温下Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.1×10-12,Ag2CrO4呈砖红色, TiCl4+(2+n)H2O=TiO2·nH2O↓+4HCl
①滴定终点的判断方法是______________________ 。
②产品的纯度为___________ (用含w、c和V的代数式表示)。

已知:TiCl4易挥发,高温时能与O2反应,不与HCl反应,其他相关信息如下表所示:
| 熔点/℃ | 沸点/℃ | 密度/(g·cm-3) | 水溶性 | |
| TiCl4 | -24 | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
| CC14 | -23 | 76.8 | 1.6 | 难溶于水 |
(1)A装置仪器b的名称是
(2)装置A中发生反应的离子方程式为
(3)在通入Cl2前,先打开开关k,从侧管持续通入一段时间的CO2气体的目的是
(4)装置C中除生成TiCl4外,还生成一种气态不成盐氧化物,该反应的化学方程式为:
(5)制得的TiCl4中常含有少量CCl4,从混合液中分离出TiCl4操作的名称是
(6)利用如图装置测定所得TiCl4的纯度:

取wg产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待TiCl4充分反应后,将烧瓶和漏斗中的液体一并转入锥形瓶中,滴加几滴0.1mol·L-1K2CrO4溶液作指示剂,用cmol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液VmL。已知:常温下Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=1.1×10-12,Ag2CrO4呈砖红色, TiCl4+(2+n)H2O=TiO2·nH2O↓+4HCl
①滴定终点的判断方法是
②产品的纯度为
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】用碳在高温下还原二氧化硅制粗硅(含Fe、Al、B、P等杂质),粗硅与氯气反应生成四氯化硅反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

已知:
①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见表:
(1)写出装置A中发生反应的化学方程式___________ 。
(2)装置A中g管的作用是___________ ,装置C中的试剂是___________ ,装置F的作用是___________ 。
(3)常用强碱溶液吸收尾气,反应的离子方程式为___________ 。
(4)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除Fe元素外可能还含有的元素是P、___________ 、___________ (元素符号)。
(5)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成 ,再用
,再用 标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是
标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是___________ 。

已知:
①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见表:
| 物质 |  |  |  |  |  |
| 沸点/℃ | 57.7 | 12.8 | — | 31.5 | — |
| 熔点/℃ | -70.0 | -107.2 | — | — | — |
| 升华温度/℃ | — | — | 180 | 300 | 162 |
(2)装置A中g管的作用是
(3)常用强碱溶液吸收尾气,反应的离子方程式为
(4)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除Fe元素外可能还含有的元素是P、
(5)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成
 ,再用
,再用 标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是
标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】氯化钴( )在工业催化、涂料工业、干湿指示剂等领域具有广泛应用。
)在工业催化、涂料工业、干湿指示剂等领域具有广泛应用。
(1)某钴矿石的主要成分包括CoO、MnO、 和
和 。由该矿石制
。由该矿石制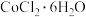 固体的方法如图(部分操作省略):
固体的方法如图(部分操作省略):

资料: 生成
生成 ,开始沉淀时
,开始沉淀时 ,完全沉淀时
,完全沉淀时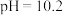 。
。
①上述矿石溶解过程中,能够加快化学反应速率的措施有_________ (写出一条即可)。
②CoO溶于浓硫酸是非氧化还原反应,溶液1中阳离子包括 和
和________ 。
③调节溶液的pH至2.8时,得到的沉淀2可能是________ 。
④溶液2中含有 和
和 。
。
ⅰ.已知:常温时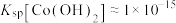 ,当
,当 时可认为
时可认为 完全沉淀。若向溶液2中加入碱溶液,常温下,当
完全沉淀。若向溶液2中加入碱溶液,常温下,当
_______ 时 完全沉淀。
完全沉淀。
由此可知,通过调节pH将 和
和 完全分离
完全分离_______ (填“可行”或“不可行”)。
ⅱ.溶液2中加入氨水和H2O2溶液,发生的反应为:________ (完成离子方程式)
___ ____
____ _____
_____ ____+____
____+____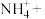 ____。
____。
(2)可用如下方法测定产品中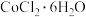 的质量分数(其他杂质不干扰测定):
的质量分数(其他杂质不干扰测定):
资料:ⅲ.Co2+与EDTA以物质的量比1:1反应,
取mg产品溶于水,向其中加入少量紫脲酸铵指示剂。再用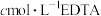 溶液滴定,消耗EDTA溶液的体积为VmL。产品中
溶液滴定,消耗EDTA溶液的体积为VmL。产品中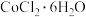 的质量分数为
的质量分数为________ (结果用m、v、c表示)。
 )在工业催化、涂料工业、干湿指示剂等领域具有广泛应用。
)在工业催化、涂料工业、干湿指示剂等领域具有广泛应用。(1)某钴矿石的主要成分包括CoO、MnO、
 和
和 。由该矿石制
。由该矿石制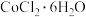 固体的方法如图(部分操作省略):
固体的方法如图(部分操作省略):
资料:
 生成
生成 ,开始沉淀时
,开始沉淀时 ,完全沉淀时
,完全沉淀时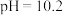 。
。①上述矿石溶解过程中,能够加快化学反应速率的措施有
②CoO溶于浓硫酸是非氧化还原反应,溶液1中阳离子包括
 和
和③调节溶液的pH至2.8时,得到的沉淀2可能是
④溶液2中含有
 和
和 。
。ⅰ.已知:常温时
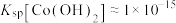 ,当
,当 时可认为
时可认为 完全沉淀。若向溶液2中加入碱溶液,常温下,当
完全沉淀。若向溶液2中加入碱溶液,常温下,当
 完全沉淀。
完全沉淀。由此可知,通过调节pH将
 和
和 完全分离
完全分离ⅱ.溶液2中加入氨水和H2O2溶液,发生的反应为:
___
 ____
____ _____
_____ ____+____
____+____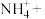 ____。
____。(2)可用如下方法测定产品中
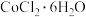 的质量分数(其他杂质不干扰测定):
的质量分数(其他杂质不干扰测定):资料:ⅲ.Co2+与EDTA以物质的量比1:1反应,

取mg产品溶于水,向其中加入少量紫脲酸铵指示剂。再用
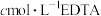 溶液滴定,消耗EDTA溶液的体积为VmL。产品中
溶液滴定,消耗EDTA溶液的体积为VmL。产品中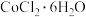 的质量分数为
的质量分数为
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】钴产品的湿法生产中会生成大量的铜锰渣,主要含有MnO2、CuO,还含有少量的Co2O3、Fe2O3、Al2O3、CaO、MgO等。以铜锰渣为原料制备MnCO3和Cu2(OH)2CO3的工艺流程如下图所示:
已知:室温时相关金属离子形成氢氧化物沉淀的pH范围如下(当离子浓度不大于10-5mol·L-1时,认为该离子沉淀完全):
(1)“还原浸出”发生的最主要反应的离子方程式为___________ 。
(2)“净化除杂I”需先加入双氧水,再加入氨水调高pH除掉铁、铝杂质,应调节溶液pH范围为___________ 。室温时,当c(Fe3+)<10-6.2mol·L-1时,溶液
___________  。
。
(3)“沉铜”操作中,通过加入MnCO3调控溶液酸碱性实现Cu2+与其他金属离子的有效分离,该过程产生无色无味的气体,写出“沉铜”的离子方程式___________ 。
(4)“净化除杂II”能深度除钙和镁,则“沉锰”后的母液中存在的主要溶质为___________ (写化学式)
(5)MnCO3纯度测定:准确称取10.00gMnCO3产品完全溶于稀硫酸,加入适量ZnO调节溶液为中性,将上述溶液配制为500mL溶液,取20.00mL于锥形瓶中,用0.1000mol/LKMnO4标准溶液滴定(已知:2MnO +3Mn2++2H2O=5MnO2↓+4H+),KMnO4溶液盛装在
+3Mn2++2H2O=5MnO2↓+4H+),KMnO4溶液盛装在___________ (填“酸式”或“碱式”)滴定管中,重复滴定三次,平均消耗KMnO4标准溶液20.00mL,则MnCO3的纯度为___________ (结果保留4位有效数字)。

已知:室温时相关金属离子形成氢氧化物沉淀的pH范围如下(当离子浓度不大于10-5mol·L-1时,认为该离子沉淀完全):
| 金属离子 | Mn2+ | Cu2+ | Co2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时pH | 8.1 | 5.2 | 7.1 | 7.5 | 2.2 | 3.7 | 8.9 |
| 完全沉淀时pH | 10.1 | 7.2 | 9.1 | 9.0 | 3.6 | 4.7 | 10.9 |
(2)“净化除杂I”需先加入双氧水,再加入氨水调高pH除掉铁、铝杂质,应调节溶液pH范围为

 。
。(3)“沉铜”操作中,通过加入MnCO3调控溶液酸碱性实现Cu2+与其他金属离子的有效分离,该过程产生无色无味的气体,写出“沉铜”的离子方程式
(4)“净化除杂II”能深度除钙和镁,则“沉锰”后的母液中存在的主要溶质为
(5)MnCO3纯度测定:准确称取10.00gMnCO3产品完全溶于稀硫酸,加入适量ZnO调节溶液为中性,将上述溶液配制为500mL溶液,取20.00mL于锥形瓶中,用0.1000mol/LKMnO4标准溶液滴定(已知:2MnO
 +3Mn2++2H2O=5MnO2↓+4H+),KMnO4溶液盛装在
+3Mn2++2H2O=5MnO2↓+4H+),KMnO4溶液盛装在
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】磁性Fe3O4纳米粒子(粒径1~100nm)因其独特的物理化学性质如电学特性、磁学特性等引起广泛的研究。通过共沉淀法制备磁性Fe3O4纳米粒子的方法如下:
I.连接好如图装置;
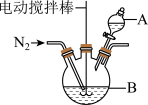
I.取10 mL0.5mol/LFeSO4,溶液和20mL0.5 mol/LFeCl3溶液于反应容器B,并向装置中通入N2;
III.在不断搅拌的条件下,向混合溶液中逐滴加入60mL12 mol/L的氨水,溶液中逐渐出现黑色物质;
IV.充分反应后,从混合液中分离出纳米粒子,并反复洗涤干燥后得到磁性Fe3O4纳米粒子。
回答下列问题:
(1)仪器A的名称为_______ ,反应容器B的最佳规格为_______ (填序号)。
a.100 mL b.250 mL c.500 mL
(2)生成磁性Fe3O4纳米粒子的离子方程式为_______ 。
(3)实验过程中通入N2的目的是_______ 。
(4)从反应后的混合液中分离出Fe3O4纳米粒子,最简便的方法是_______ (填序号);用水洗涤Fe3O4纳米粒子后,需要用无水乙醇洗涤,其原因是_______ 。
a.磁分离 b.过滤 c.分液
(5)产物中混杂的Fe2O3会降低纳米粒子的磁性,为了测定产品中Fe2O3的含量,采取如下实验方法:
准确称取0.3120g产品于锥形瓶中,用稀硝酸充分浸取,再加热使过量的硝酸全部逸出,冷却后加入足量KI溶液充分混合反应后,用0.2000mol/L Na2S2O3标准溶液滴定至溶液颜色明显变浅,加入几滴淀粉溶液,继续滴定至终点,消耗Na2S2O3标准溶液的体积为20.00mL。
已知滴定过程中发生反应的离子方程式为I2+2S2O = 2I—+S4O
= 2I—+S4O 。
。
①滴定终点的现象为_______ 。
②所取样品中Fe2O3的质量为_______ g(结果保留4位小数);若加入KI溶液的量不足,则会导致测定结果_______ (填 “偏高”“偏低”或“不变”)。
I.连接好如图装置;

I.取10 mL0.5mol/LFeSO4,溶液和20mL0.5 mol/LFeCl3溶液于反应容器B,并向装置中通入N2;
III.在不断搅拌的条件下,向混合溶液中逐滴加入60mL12 mol/L的氨水,溶液中逐渐出现黑色物质;
IV.充分反应后,从混合液中分离出纳米粒子,并反复洗涤干燥后得到磁性Fe3O4纳米粒子。
回答下列问题:
(1)仪器A的名称为
a.100 mL b.250 mL c.500 mL
(2)生成磁性Fe3O4纳米粒子的离子方程式为
(3)实验过程中通入N2的目的是
(4)从反应后的混合液中分离出Fe3O4纳米粒子,最简便的方法是
a.磁分离 b.过滤 c.分液
(5)产物中混杂的Fe2O3会降低纳米粒子的磁性,为了测定产品中Fe2O3的含量,采取如下实验方法:
准确称取0.3120g产品于锥形瓶中,用稀硝酸充分浸取,再加热使过量的硝酸全部逸出,冷却后加入足量KI溶液充分混合反应后,用0.2000mol/L Na2S2O3标准溶液滴定至溶液颜色明显变浅,加入几滴淀粉溶液,继续滴定至终点,消耗Na2S2O3标准溶液的体积为20.00mL。
已知滴定过程中发生反应的离子方程式为I2+2S2O
 = 2I—+S4O
= 2I—+S4O 。
。①滴定终点的现象为
②所取样品中Fe2O3的质量为
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】钨 具有很大的工业价值,主要用于电子工业,合金添加剂等。工业上利用白钨矿精矿为原料
具有很大的工业价值,主要用于电子工业,合金添加剂等。工业上利用白钨矿精矿为原料 主要成分为钨酸钙
主要成分为钨酸钙 ,还含有CaO、
,还含有CaO、 等杂质
等杂质 生产钨粉的一种工艺流程如下:
生产钨粉的一种工艺流程如下:

已知:
 钨酸钙微溶于水,能溶解在热盐酸中。
钨酸钙微溶于水,能溶解在热盐酸中。
 降低溶液pH可以从钨酸铵溶液中析出仲钨酸铵晶体,常温时可析出带11个结晶水的仲钨酸铵晶体,但是由于颗粒很细小,难以进一步提纯。在
降低溶液pH可以从钨酸铵溶液中析出仲钨酸铵晶体,常温时可析出带11个结晶水的仲钨酸铵晶体,但是由于颗粒很细小,难以进一步提纯。在 时可析出颗粒较大的带5个结晶水的仲钨酸铵晶体,可进一步提纯精制。
时可析出颗粒较大的带5个结晶水的仲钨酸铵晶体,可进一步提纯精制。
 酸浸时为了提高浸出率,可采取的措施有
酸浸时为了提高浸出率,可采取的措施有___________ 。 答出两条即可
答出两条即可
 酸浸时,需控制反应温度在
酸浸时,需控制反应温度在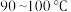 之间的原因是
之间的原因是________ 。
 酸浸时发生的主要反应的化学方程式是
酸浸时发生的主要反应的化学方程式是____ 。
 将废酸与粗钨酸分离的操作是
将废酸与粗钨酸分离的操作是_____  填操作名称
填操作名称 。
。
 加入过量氨水后过滤,得到滤渣的主要成分是
加入过量氨水后过滤,得到滤渣的主要成分是______  填化学式
填化学式 。
。
 工艺流程中“结晶析出”,采用的结晶方法是
工艺流程中“结晶析出”,采用的结晶方法是________ 。
 仲钨酸铵的化学式为
仲钨酸铵的化学式为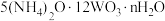 ,写出仲钨酸铵煅烧转化为
,写出仲钨酸铵煅烧转化为 的化学方程式
的化学方程式_______________ 。
 已知白钨矿精矿中的钨酸钙质量分数为a%,wt该精矿经上述流程制得mkg钨粉。则该生产中钨的产率为
已知白钨矿精矿中的钨酸钙质量分数为a%,wt该精矿经上述流程制得mkg钨粉。则该生产中钨的产率为_______  用含“a”“w”“m”的代数式表示
用含“a”“w”“m”的代数式表示 。
。
 具有很大的工业价值,主要用于电子工业,合金添加剂等。工业上利用白钨矿精矿为原料
具有很大的工业价值,主要用于电子工业,合金添加剂等。工业上利用白钨矿精矿为原料 主要成分为钨酸钙
主要成分为钨酸钙 ,还含有CaO、
,还含有CaO、 等杂质
等杂质 生产钨粉的一种工艺流程如下:
生产钨粉的一种工艺流程如下:
已知:
 钨酸钙微溶于水,能溶解在热盐酸中。
钨酸钙微溶于水,能溶解在热盐酸中。 降低溶液pH可以从钨酸铵溶液中析出仲钨酸铵晶体,常温时可析出带11个结晶水的仲钨酸铵晶体,但是由于颗粒很细小,难以进一步提纯。在
降低溶液pH可以从钨酸铵溶液中析出仲钨酸铵晶体,常温时可析出带11个结晶水的仲钨酸铵晶体,但是由于颗粒很细小,难以进一步提纯。在 时可析出颗粒较大的带5个结晶水的仲钨酸铵晶体,可进一步提纯精制。
时可析出颗粒较大的带5个结晶水的仲钨酸铵晶体,可进一步提纯精制。 酸浸时为了提高浸出率,可采取的措施有
酸浸时为了提高浸出率,可采取的措施有 答出两条即可
答出两条即可
 酸浸时,需控制反应温度在
酸浸时,需控制反应温度在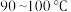 之间的原因是
之间的原因是 酸浸时发生的主要反应的化学方程式是
酸浸时发生的主要反应的化学方程式是 将废酸与粗钨酸分离的操作是
将废酸与粗钨酸分离的操作是 填操作名称
填操作名称 。
。 加入过量氨水后过滤,得到滤渣的主要成分是
加入过量氨水后过滤,得到滤渣的主要成分是 填化学式
填化学式 。
。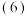 工艺流程中“结晶析出”,采用的结晶方法是
工艺流程中“结晶析出”,采用的结晶方法是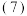 仲钨酸铵的化学式为
仲钨酸铵的化学式为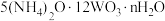 ,写出仲钨酸铵煅烧转化为
,写出仲钨酸铵煅烧转化为 的化学方程式
的化学方程式 已知白钨矿精矿中的钨酸钙质量分数为a%,wt该精矿经上述流程制得mkg钨粉。则该生产中钨的产率为
已知白钨矿精矿中的钨酸钙质量分数为a%,wt该精矿经上述流程制得mkg钨粉。则该生产中钨的产率为 用含“a”“w”“m”的代数式表示
用含“a”“w”“m”的代数式表示 。
。
您最近半年使用:0次
【推荐2】Pd/A12O3是常见的汽车尾气催化剂。一种从废Pd/A12O3纳米催化剂(主要成分及含量:Pd0.3%,γ-A12O392.8%,其他杂质6.9%)中回收金属Pd的工艺如图:
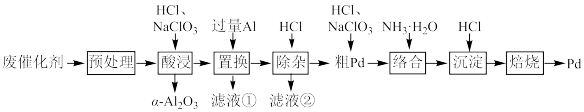
已知:γ-Al2O3能与酸反应,α-A12O3不与酸反应。
回答下列问题:
(1)“预处理”时,γ-A12O3经焙烧转化为α-A12O3,该操作的主要目的是___ 。
(2)“酸浸”时,Pd转化为PdCl ,其离子方程式为
,其离子方程式为___ 。
(3)“滤液①”和“滤液②”中都含有的主要溶质有___ (填化学式)。
(4)“粗Pd”溶解时,可用稀HNO3替代NaClO3,但缺点是___ 。两者相比,___ (填化学式)的氧化效率更高(氧化效率以单位质量得到的电子数表示)。
(5)“沉淀”时,[Pd(NH3)4]2+转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为___ 。
(6)酸性条件下,BrO3-能在负载Pd/A12O3纳米催化剂的电极表面快速转化为Br-。
①发生上述转化反应的电极应接电源的___ 极(填“正”或“负”);
②研究表明,电流密度越大,电催化效率越高;但当电流密度过大时,该电极会发生副反应生成___ (填化学式)。

已知:γ-Al2O3能与酸反应,α-A12O3不与酸反应。
回答下列问题:
(1)“预处理”时,γ-A12O3经焙烧转化为α-A12O3,该操作的主要目的是
(2)“酸浸”时,Pd转化为PdCl
 ,其离子方程式为
,其离子方程式为(3)“滤液①”和“滤液②”中都含有的主要溶质有
(4)“粗Pd”溶解时,可用稀HNO3替代NaClO3,但缺点是
(5)“沉淀”时,[Pd(NH3)4]2+转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为
(6)酸性条件下,BrO3-能在负载Pd/A12O3纳米催化剂的电极表面快速转化为Br-。
①发生上述转化反应的电极应接电源的
②研究表明,电流密度越大,电催化效率越高;但当电流密度过大时,该电极会发生副反应生成
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐3】某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
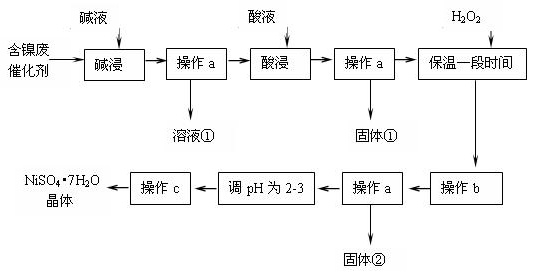
部分阳离子以氢氧化物形式沉淀时的pH如下:
(1)操作a应选用下列哪种方法或装置:_____
A. B.
B. C.
C. D.
D.
(2)“碱浸”过程中发生反应的离子方程式是________
(3)“酸浸”时所加入的酸是________ (填化学式).
(4)加入H2O2时发生反应的离子方程式为________
(5)操作b为调节溶液的pH,你认为pH的调控范围是________
(6)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是____ (写出一点即可).
(7)NiSO4•7H2O可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为________ .

部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(1)操作a应选用下列哪种方法或装置:
A.
 B.
B. C.
C. D.
D.
(2)“碱浸”过程中发生反应的离子方程式是
(3)“酸浸”时所加入的酸是
(4)加入H2O2时发生反应的离子方程式为
(5)操作b为调节溶液的pH,你认为pH的调控范围是
(6)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是
(7)NiSO4•7H2O可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
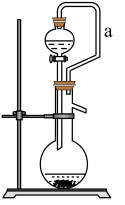
【推荐1】某研究性学习小组利用下列有关装置,对二氧化疏的性质及空气中二氧化疏的含量进行探究(装置的气密性已检查):

(1)装置A中盛浓硫酸的仪器名称是_______ 。
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间 ,再关闭弹簧夹,此操作的目的是:
,再关闭弹簧夹,此操作的目的是:_______ 。
(3)实验过程中装置B中没有明显变化。实验结束后取下装置B,从中取少量溶液于洁净试管中,向试管中滴加适量_______出现白色沉淀。
(4)装置C中的溶液中出现_______ 浑浊,发生的反应方程式为_______ 。
(5)装置D中溶液是_______ 。
(6)如果用硫酸溶液和 固体反应制取
固体反应制取 装置如图所示,其中a导管的作用是
装置如图所示,其中a导管的作用是_______ 。
(7)拟用以下方案测定空气中 含量(假设空气中无其他还原性气体)。
含量(假设空气中无其他还原性气体)。

实验中若通过空气的体积为33.6L(标准状况下),最终所得固体质量为0.233g,通过计算确定该空气中二氧化硫的含量是_______ 。(结果精确到0.001%)

(1)装置A中盛浓硫酸的仪器名称是
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间
 ,再关闭弹簧夹,此操作的目的是:
,再关闭弹簧夹,此操作的目的是:(3)实验过程中装置B中没有明显变化。实验结束后取下装置B,从中取少量溶液于洁净试管中,向试管中滴加适量_______出现白色沉淀。
| A.氨水 | B. | C.硝酸 | D.盐酸 |
(5)装置D中溶液是
(6)如果用硫酸溶液和
 固体反应制取
固体反应制取 装置如图所示,其中a导管的作用是
装置如图所示,其中a导管的作用是
(7)拟用以下方案测定空气中
 含量(假设空气中无其他还原性气体)。
含量(假设空气中无其他还原性气体)。
实验中若通过空气的体积为33.6L(标准状况下),最终所得固体质量为0.233g,通过计算确定该空气中二氧化硫的含量是
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】 是一种易溶于热水,难溶于乙醇的紫红色晶体。可通过如下实验步骤制备。
是一种易溶于热水,难溶于乙醇的紫红色晶体。可通过如下实验步骤制备。
Ⅰ.将适量氯化铵溶于浓氨水中,搅拌下,分批次加入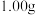 研细的
研细的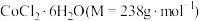 ,得到
,得到 沉淀。
沉淀。
Ⅱ.边搅拌边慢慢滴入足量 溶液,得到
溶液,得到 溶液。
溶液。
Ⅲ.慢慢注入适量浓盐酸,得到沉淀,水浴加热,冷却至室温,得到紫红色晶体,减压过滤。
Ⅳ.依次用不同试剂洗涤晶体,烘干,得到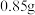 产品。
产品。
回答下列问题:
(1)本实验涉及钴配合物的配体有_______ (填化学式)。
(2)本实验应在通风橱中进行,原因是_______ 。
(3)步骤Ⅰ中分批次加入研细的 ,原因是
,原因是_______ 。
(4)步骤Ⅱ发生反应的离子方程式是_______ 。
(5)步骤Ⅳ中使用的洗涤试剂有:①冷水 ②乙醇 ③冷的盐酸 ④丙酮。试剂使用的先后顺序是:①
_______  ④(填序号)。
④(填序号)。
(6)已知: ;
; 。则在水溶液中的稳定性:
。则在水溶液中的稳定性:
_______  (填“大于”或“小于”)。
(填“大于”或“小于”)。
(7)本实验的产率最接近于_______(填标号)。
 是一种易溶于热水,难溶于乙醇的紫红色晶体。可通过如下实验步骤制备。
是一种易溶于热水,难溶于乙醇的紫红色晶体。可通过如下实验步骤制备。Ⅰ.将适量氯化铵溶于浓氨水中,搅拌下,分批次加入
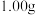 研细的
研细的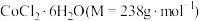 ,得到
,得到 沉淀。
沉淀。Ⅱ.边搅拌边慢慢滴入足量
 溶液,得到
溶液,得到 溶液。
溶液。Ⅲ.慢慢注入适量浓盐酸,得到沉淀,水浴加热,冷却至室温,得到紫红色晶体,减压过滤。
Ⅳ.依次用不同试剂洗涤晶体,烘干,得到
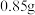 产品。
产品。回答下列问题:
(1)本实验涉及钴配合物的配体有
(2)本实验应在通风橱中进行,原因是
(3)步骤Ⅰ中分批次加入研细的
 ,原因是
,原因是(4)步骤Ⅱ发生反应的离子方程式是
(5)步骤Ⅳ中使用的洗涤试剂有:①冷水 ②乙醇 ③冷的盐酸 ④丙酮。试剂使用的先后顺序是:①

 ④(填序号)。
④(填序号)。(6)已知:
 ;
; 。则在水溶液中的稳定性:
。则在水溶液中的稳定性:
 (填“大于”或“小于”)。
(填“大于”或“小于”)。(7)本实验的产率最接近于_______(填标号)。
A. | B. | C. | D. |
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。一种制备草酸钴晶体(CoC2O4·2H2O)的工艺流程如下:
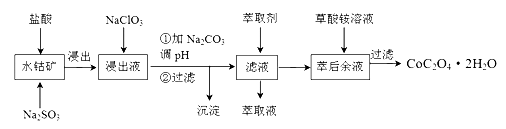
已知:①水钴矿主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等杂质。
②浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(金属离子浓度以0.01mol·L-1计)
(1) 写出浸出过程中Co(OH)3发生反应的离子方程式:____________________ 。
(2) NaClO3的作用是_______________________ 。
(3) 加Na2CO3调pH的范围应该在_____ 之间。加入萃取剂的目的是____________ 。
(4) 在空气中加热5.49g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是____________________ 。[M(CoC2O4·2H2O=183g/mol]

已知:①水钴矿主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等杂质。
②浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(金属离子浓度以0.01mol·L-1计)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1) 写出浸出过程中Co(OH)3发生反应的离子方程式:
(2) NaClO3的作用是
(3) 加Na2CO3调pH的范围应该在
(4) 在空气中加热5.49g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表:
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
经测定,210~290℃过程中产生的气体只有CO2,此过程发生反应的化学方程式是
您最近半年使用:0次



