(I)元素是组成我们生活的世界中一切物质的“原材料”。
(1)1869年,门捷列夫在前人研究的基础上研制出了第一张元素周期表。到20世纪初,门捷列夫在周期表中为未知元素留下的空位逐渐被填满,而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量的递增呈现周期性变化,而是随着原子序数(核电荷数)的递增呈现周期性变化。其本质原因是___________ (填字母序号)。
A.随着核电荷数递增,原子半径呈现周期性变化
B.随着核电荷数递增,元素的化合价呈现周期性变化
C.随着核电荷数递增,原子核外电子排布呈现周期性变化
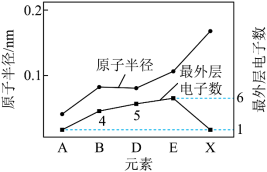
(2)有A、B、D、E、X、Y、Z七种短周期元素。X与Y处于同一周期,Y的最高价氧化物对应的水化物与强酸、强碱均能反应。Z的单质常温下为气态,同条件下对于氢气的相对密度为35.5.其余元素的信息如图所示:___________ 。
②A、D、Z三种元素所形成的化合物DA4Z中的化学键类型是___________ 。
③X的最高价氧化物对应水化物与Y的单质反应的离子方程式为___________ 。
④下列可以判断X和Y元素原子失电子能力强弱的是___________ (填字母序号)。
a.单质的熔点X比Y低
b.单质与酸反应时,失电子数X比Y少
c.单质与水反应X比Y剧烈
d.最高价氧化物的水化物的碱性X比Y强
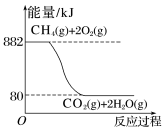
(3)已知天然气的主要成分甲烷(CH4)燃烧时的能量变化如图所示:___________ kJ。
(1)1869年,门捷列夫在前人研究的基础上研制出了第一张元素周期表。到20世纪初,门捷列夫在周期表中为未知元素留下的空位逐渐被填满,而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量的递增呈现周期性变化,而是随着原子序数(核电荷数)的递增呈现周期性变化。其本质原因是
A.随着核电荷数递增,原子半径呈现周期性变化
B.随着核电荷数递增,元素的化合价呈现周期性变化
C.随着核电荷数递增,原子核外电子排布呈现周期性变化
(2)有A、B、D、E、X、Y、Z七种短周期元素。X与Y处于同一周期,Y的最高价氧化物对应的水化物与强酸、强碱均能反应。Z的单质常温下为气态,同条件下对于氢气的相对密度为35.5.其余元素的信息如图所示:
②A、D、Z三种元素所形成的化合物DA4Z中的化学键类型是
③X的最高价氧化物对应水化物与Y的单质反应的离子方程式为
④下列可以判断X和Y元素原子失电子能力强弱的是
a.单质的熔点X比Y低
b.单质与酸反应时,失电子数X比Y少
c.单质与水反应X比Y剧烈
d.最高价氧化物的水化物的碱性X比Y强
(3)已知天然气的主要成分甲烷(CH4)燃烧时的能量变化如图所示:
更新时间:2024-04-23 18:08:30
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景。
(1)已知反应CO(g)+2H2(g) CH3OH(g)∆H=-99kJ.mol-1中的相关化学键键能如下:
CH3OH(g)∆H=-99kJ.mol-1中的相关化学键键能如下:
则x=_________________ 。
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
∆H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如右图所示
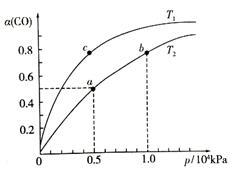
①a、b两点的反应速率:v(a)_________ v(b)(填“>”、“<”、“=”)
②T1_______ T2(填“>”、“<”、“=”),原因是_____________________ 。
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是_______ (填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=__________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
I:CO(g)+2H2(g) CH3OH(g) ∆H1
CH3OH(g) ∆H1
II:CO2(g)+H2(g) CO(g) + H2O(g) ∆H2
CO(g) + H2O(g) ∆H2
III:CO2(g)+3H2(g) CH3OH(g) + H2O(g) ∆H3
CH3OH(g) + H2O(g) ∆H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如下图所示。
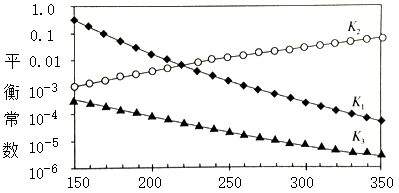
则∆H1_______ ∆H3(填“>”、“<”、“=”),理由是________________ 。
(1)已知反应CO(g)+2H2(g)
 CH3OH(g)∆H=-99kJ.mol-1中的相关化学键键能如下:
CH3OH(g)∆H=-99kJ.mol-1中的相关化学键键能如下:| 化学键 | H-H | C-O |  | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
则x=
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)
 CH3OH(g)
CH3OH(g)∆H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如右图所示

①a、b两点的反应速率:v(a)
②T1
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数KP=
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
I:CO(g)+2H2(g)
 CH3OH(g) ∆H1
CH3OH(g) ∆H1II:CO2(g)+H2(g)
 CO(g) + H2O(g) ∆H2
CO(g) + H2O(g) ∆H2III:CO2(g)+3H2(g)
 CH3OH(g) + H2O(g) ∆H3
CH3OH(g) + H2O(g) ∆H3上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如下图所示。

则∆H1
您最近一年使用:0次
【推荐2】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
则该反应的ΔH=_________ kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) ⇌CH3OH(g) ΔH <0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
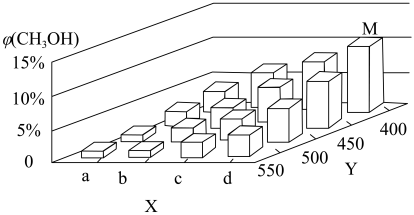
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为_________ 。
②X轴上a点的数值比b点_________ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是________________________________ 。
(3)工业上可采用CH3OH CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为_________ (填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
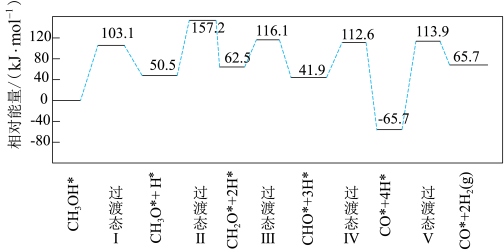
该历程中,放热最多的步骤的化学方程式为______________________________________________ 。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=_________ 。
(1)制取甲胺的反应为CH3OH(g)+NH3(g)⇌CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
| 共价键 | C—O | H—O | N—H | C—N | C—H |
| 键能/kJ·mol-1 | 351 | 463 | 393 | 293 | 414 |
则该反应的ΔH=
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) ⇌CH3OH(g) ΔH <0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:

①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为
②X轴上a点的数值比b点
(3)工业上可采用CH3OH
 CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为
下图为计算机模拟的各步反应的能量变化示意图。

该历程中,放热最多的步骤的化学方程式为
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】实验室利用下列装置模拟工业生产制备少量硝酸。
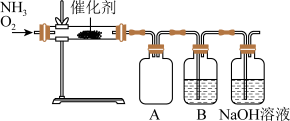
(1)化学实验室中干燥氨气使用的试剂是___________ 。
(2)B中反应的化学方程式为___________ 。
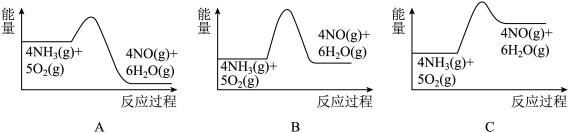
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是(填字母)___________ 。
(4)高温时,2 NO2(g) 2 NO(g)+ O2(g),因此氨气与氧气反应难以生成NO2.根据下列数据计算,当2 mol NO2分解时,反应会
2 NO(g)+ O2(g),因此氨气与氧气反应难以生成NO2.根据下列数据计算,当2 mol NO2分解时,反应会___________ (填“吸收”或“放出”)___________ kJ能量。
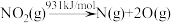
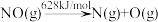

(5)控制氨气和氧气的比例是制备硝酸的关键。当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。产生红棕色气体的化学方程式是___________ ,白烟的化学式是___________ 。

(1)化学实验室中干燥氨气使用的试剂是
(2)B中反应的化学方程式为
(3)实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是(填字母)

(4)高温时,2 NO2(g)
 2 NO(g)+ O2(g),因此氨气与氧气反应难以生成NO2.根据下列数据计算,当2 mol NO2分解时,反应会
2 NO(g)+ O2(g),因此氨气与氧气反应难以生成NO2.根据下列数据计算,当2 mol NO2分解时,反应会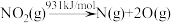
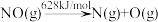

(5)控制氨气和氧气的比例是制备硝酸的关键。当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。产生红棕色气体的化学方程式是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】前四周期元素A、B、C、D、E原子序数依次增大,其相关性质如表所示:
请根据以上情况,回答下列问题:
(1)E元素基态原子核外有_______ 种能量不同的电子, 简化的电子排布式为_______ ,D位于元素周期表第_______ 行第_______ 列。
(2)B和C可形成一种同时含有共价键和离子键的化合物,写出此化合物与水反应的化学方程式_______ 。
(3)A、B、C、D四种元素第一电离能由大到小的顺序为_______ (用元素符号表示)。B、C、D三种元素的简单离子的半径由大到小的顺序为_______ (用离子符号表示)。
(4)A的简单氢化物与最高价氧化物对应的水化物可以发生反应,则生成物中阳离子的结构式为_______ 。
(5)含元素C的物质做焰色反应实验时,焰色呈_______ 色。
| A | 2p能级电子半充满 |
| B | 与A同周期,且原子核外有2个未成对电子 |
| C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
| D | 其基态原子外围电子排布式为nsn-1npn+1 |
| E | 前四周期元素中,E元素基态原子未成对电子数最多 |
(1)E元素基态原子核外有
(2)B和C可形成一种同时含有共价键和离子键的化合物,写出此化合物与水反应的化学方程式
(3)A、B、C、D四种元素第一电离能由大到小的顺序为
(4)A的简单氢化物与最高价氧化物对应的水化物可以发生反应,则生成物中阳离子的结构式为
(5)含元素C的物质做焰色反应实验时,焰色呈
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】几种主族元素在周期表中的位置如下
(1)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素在周期表中的位置是_______ 。
(2)①②③三种元素最高价氧化物对应水化物碱性最强的是_______ (填化学式)。
(3)①③⑦三种元素所形成的简单离子的半径由大到小的顺序是_______ (用元素的离子符号表示)。
(4)⑥元素最高价氧化物的水化物的浓溶液不稳定,受热或见光易分解,写出该反应的化学方程式_______ 。⑥的气态氢化物与⑦的气态氢化物水溶液反应生成X,写出X的电子式_______ ,X中含有的化学键类型有_______ 。
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是_______ (填字母)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑦的氧化物对应的水化物的酸性强于⑧的氧化物对应的水化物的酸性
c.⑦的单质能将⑧的单质从其钠盐溶液中置换出来
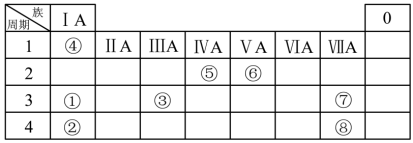
(1)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素在周期表中的位置是
(2)①②③三种元素最高价氧化物对应水化物碱性最强的是
(3)①③⑦三种元素所形成的简单离子的半径由大到小的顺序是
(4)⑥元素最高价氧化物的水化物的浓溶液不稳定,受热或见光易分解,写出该反应的化学方程式
(5)⑦的非金属性强于⑧,下列表述中能证明这一事实的是
a.⑦的氢化物比⑧的氢化物稳定
b.⑦的氧化物对应的水化物的酸性强于⑧的氧化物对应的水化物的酸性
c.⑦的单质能将⑧的单质从其钠盐溶液中置换出来
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】下表为元素周期表的一部分,用化学用语回答下列问题:
(1)⑧的原子结构示意图为___________ 。
(2)②和③气态氢化物稳定性的大小顺序:___________ (填化学式)。
(3)根据元素周期表中元素的性质存在递变规律,下列比较正确的是___________ 。
a.离子半径: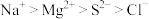
b.酸性: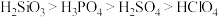
c.氢化物稳定性:
d.与HCl溶液反应的剧烈程度: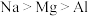
(4)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是___________ (填化学式),它属于___________ (填“共价化合物”或“离子化合物”)。
(5)⑤在一定条件下可与氢气反应生成氢化物(1:1型化合物)。生成物氢化物的电子式为___________ ,含有的化学键为___________ 键(填“离子”或“共价”)。
(6)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是___________(填字母)。
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)②和③气态氢化物稳定性的大小顺序:
(3)根据元素周期表中元素的性质存在递变规律,下列比较正确的是
a.离子半径:
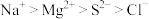
b.酸性:
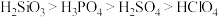
c.氢化物稳定性:

d.与HCl溶液反应的剧烈程度:
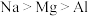
(4)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是
(5)⑤在一定条件下可与氢气反应生成氢化物(1:1型化合物)。生成物氢化物的电子式为
(6)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是___________(填字母)。
| A.比较这两种元素单质的沸点 |
| B.比较这两种元素单质与氢气化合的难易 |
| C.比较这两种元素的最高价氧化物对应水化物的酸性强弱 |
| D.比较这两种元素的单质与酸或碱反应的难易程度 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】现有部分短周期元素的性质或原子结构如下表:
(1)元素X位于元素周期表的第____ 周期第__ 族,它的一种核素可测定文物年代,这种核素的符号是____ 。
(2)元素Y的原子结构示意图为___ ,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法_____ 。
(3)元素Z与元素T相比,非金属性较强的是___ (用元素符号表示),下列表述中能证明这一事实的是___ 。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是____ ,理由______ 。
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(1)元素X位于元素周期表的第
(2)元素Y的原子结构示意图为
(3)元素Z与元素T相比,非金属性较强的是
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】短周期元素X、Y、Z、W、R原子序数依次增大,W原子次外层电子数比最外层电子数多2个,X与R同主族,其中部分元素的原子半径和主要化合价如下表所示:
请回答下列问题:
(1)W元素在元素周期表中的位置为_______ 。
(2)Y元素最高价氧化物水化物的溶液与Z的氧化物反应的离子方程式为_______ 。
(3)W、R元素最高价氧化物水化物的酸性较强的为_______ (用化学式表示);从原子结构角度解释原因_______ 。
(4)化合物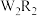 、
、 (所有原子均满足8电子结构)在工业生产中有广泛用途,
(所有原子均满足8电子结构)在工业生产中有广泛用途,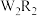 的结构式为
的结构式为_______ ;在一定条件下, 与
与 反应生成
反应生成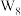 、
、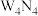 和一种仅由非金属元素组成的离子化合物,该离子化合物为
和一种仅由非金属元素组成的离子化合物,该离子化合物为_______ (填化学式)。
(5)化合物 可用作燃烧剂、推进剂中的氧化剂、高温金属的切割油等。
可用作燃烧剂、推进剂中的氧化剂、高温金属的切割油等。 与
与 反应生成两种单质(其中一种为黄绿色气体)和一种氢化物,则该反应的化学方程式为
反应生成两种单质(其中一种为黄绿色气体)和一种氢化物,则该反应的化学方程式为_______ 。
| N | X | Y | Z | |
| 原子半径/pm | 75 | 71 | 186 | 143 |
| 主要化合价 | / | -1 | +1 | +3 |
(1)W元素在元素周期表中的位置为
(2)Y元素最高价氧化物水化物的溶液与Z的氧化物反应的离子方程式为
(3)W、R元素最高价氧化物水化物的酸性较强的为
(4)化合物
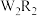 、
、 (所有原子均满足8电子结构)在工业生产中有广泛用途,
(所有原子均满足8电子结构)在工业生产中有广泛用途,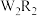 的结构式为
的结构式为 与
与 反应生成
反应生成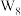 、
、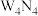 和一种仅由非金属元素组成的离子化合物,该离子化合物为
和一种仅由非金属元素组成的离子化合物,该离子化合物为(5)化合物
 可用作燃烧剂、推进剂中的氧化剂、高温金属的切割油等。
可用作燃烧剂、推进剂中的氧化剂、高温金属的切割油等。 与
与 反应生成两种单质(其中一种为黄绿色气体)和一种氢化物,则该反应的化学方程式为
反应生成两种单质(其中一种为黄绿色气体)和一种氢化物,则该反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】利用元素周期律和元素周期表可以系统研究元素的性质。几种主族元素在周期表中的位置如下,回答下列问题:
(1)元素⑥形成的单质的电子式是___________ 。
(2)⑥、⑦、⑨三种元素的简单气态氢化物中,稳定性最弱的是___________ (填化学式)。
(3)④、⑦、⑧三种元素的简单离子半径由大到小的顺序是___________ (用离子符号表示)。
(4)①和⑦可分别形成10电子和18电子分子,其中18电子分子是___________ (填化学式)。
(5)比较元素⑧和⑩的非金属性强弱:在⑧的氢化物的水溶液中通入少量⑩的单质,写出发生反应的化学方程式:___________ 。
(6)元素①和③形成的化合物能与水反应生成氢气,在反应后的溶液中滴入酚酞,溶液变红,该反应的氧化产物为___________ (填化学式)。
(7)工业上利用⑩的单质制取漂白粉,反应的化学方程式为___________ 。
(8)结合元素周期律,根据下列事实所得推测不合理的是___________ (填字母)。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ② | ④ | ⑤ | ⑧ | ⑩ | |||
| 4 | ③ | |||||||
(2)⑥、⑦、⑨三种元素的简单气态氢化物中,稳定性最弱的是
(3)④、⑦、⑧三种元素的简单离子半径由大到小的顺序是
(4)①和⑦可分别形成10电子和18电子分子,其中18电子分子是
(5)比较元素⑧和⑩的非金属性强弱:在⑧的氢化物的水溶液中通入少量⑩的单质,写出发生反应的化学方程式:
(6)元素①和③形成的化合物能与水反应生成氢气,在反应后的溶液中滴入酚酞,溶液变红,该反应的氧化产物为
(7)工业上利用⑩的单质制取漂白粉,反应的化学方程式为
(8)结合元素周期律,根据下列事实所得推测不合理的是
| 选项 | 事实 | 推测 |
| A | 随核电荷数递增,第ⅠA族的碱金属元素单质的沸点逐渐降低 | 随核电荷数递增,第ⅦA族元素单质的沸点也逐渐降低 |
| B |  、 、 均为强碱 均为强碱 |  (氢氧化锶)是强碱 (氢氧化锶)是强碱 |
| C |  与 与 在暗处剧烈化合, 在暗处剧烈化合, 与 与 光照或点燃时反应 光照或点燃时反应 |  与 与 在常温下即可反应 在常温下即可反应 |
| D | 第ⅣA族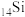 和 和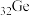 的单质是半导体材料 的单质是半导体材料 | 同族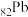 的单质是半导体材料 的单质是半导体材料 |
您最近一年使用:0次



