氮循环是自然界中一种重要的物质循环方式:
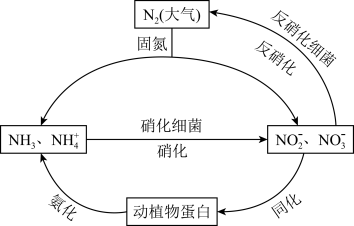
(1)化学与生产、生活和科技都密切相关。下列有关说法不正确的是___________ 。
A.硝化过程无需氧化剂参与
B.含有新冠病毒的飞沫分散在空气中形成的分散系为气溶胶
C.固氮过程中, 只做氧化剂
只做氧化剂
D.“落红不是无情物,化作春泥更护花”蕴含着自然界中的碳、氮循环
E.反硝化过程有助于弥补人工固氮对氮循环造成的影响
F.同化、氨化过程中,实现了氮元素在无机物和有机物之间的转化
(2)写出氮循环中 的电子式
的电子式___________ ,其空间构型是___________ 。写出 的检验方法
的检验方法___________ 。
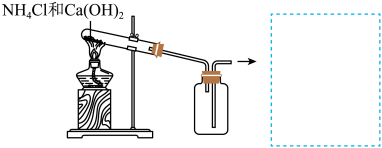
(3)实验室用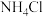 与
与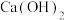 反应来制备
反应来制备 ,原理:
,原理:___________ (化学反应方程式)。在图中补上尾气处理装置(注明所用的化学物质的化学式)。___________
(4)通常我们把大气中游离态的氮转化为氮的化合物的过程称为氮的固定,主要有3种途径。如上① 称为
称为___________ ,②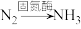 称为生物固氮,还有1种是工业固氮,其反应的化学方程式是
称为生物固氮,还有1种是工业固氮,其反应的化学方程式是___________ 。
(5)反硝化过程中, (C化合价:
(C化合价: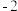 )可作为反应的还原剂。请将该反应的离子方程式补充完整:
)可作为反应的还原剂。请将该反应的离子方程式补充完整:___________ 。
___________ ___________
___________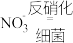 ___________
___________ ___________
___________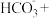 ___________
___________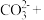 ___________。
___________。

(1)化学与生产、生活和科技都密切相关。下列有关说法不正确的是
A.硝化过程无需氧化剂参与
B.含有新冠病毒的飞沫分散在空气中形成的分散系为气溶胶
C.固氮过程中,
 只做氧化剂
只做氧化剂D.“落红不是无情物,化作春泥更护花”蕴含着自然界中的碳、氮循环
E.反硝化过程有助于弥补人工固氮对氮循环造成的影响
F.同化、氨化过程中,实现了氮元素在无机物和有机物之间的转化
(2)写出氮循环中
 的电子式
的电子式 的检验方法
的检验方法(3)实验室用
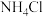 与
与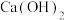 反应来制备
反应来制备 ,原理:
,原理:
(4)通常我们把大气中游离态的氮转化为氮的化合物的过程称为氮的固定,主要有3种途径。如上①
 称为
称为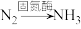 称为生物固氮,还有1种是工业固氮,其反应的化学方程式是
称为生物固氮,还有1种是工业固氮,其反应的化学方程式是(5)反硝化过程中,
 (C化合价:
(C化合价: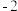 )可作为反应的还原剂。请将该反应的离子方程式补充完整:
)可作为反应的还原剂。请将该反应的离子方程式补充完整:___________
 ___________
___________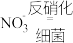 ___________
___________ ___________
___________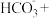 ___________
___________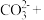 ___________。
___________。
更新时间:2024-04-30 06:54:04
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】按要求书写离子方程式:
(1)已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。在一氧化还原反应的体系中,共有KCl、 、浓
、浓 、
、 、
、 、
、 、
、 七种物质。在反应后的溶液中加入
七种物质。在反应后的溶液中加入 (不溶于冷水),溶液又变为紫红色,
(不溶于冷水),溶液又变为紫红色, 反应后变为无色的
反应后变为无色的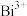 。写出该实验中涉及反应的离子方程式:
。写出该实验中涉及反应的离子方程式:_______ 。
(2)+6价铬的毒性很强,具有一定的致癌作用,需要转化为低毒的 ,再转化为不溶物除去,废水中含有的
,再转化为不溶物除去,废水中含有的 可以用绿矾(
可以用绿矾( )除去。测得反应后的溶液中含
)除去。测得反应后的溶液中含 、
、 、
、 、
、 等阳离子。写出该反应的离子方程式:
等阳离子。写出该反应的离子方程式:_______ 。
(3)已知:①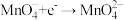 (绿色)(强碱性条件);
(绿色)(强碱性条件);
②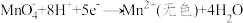 (强酸性条件)。
(强酸性条件)。
将 溶液滴入NaOH溶液中微热,得到透明的绿色溶液,写出反应的离子方程式:
溶液滴入NaOH溶液中微热,得到透明的绿色溶液,写出反应的离子方程式:_______ 。
(1)已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。在一氧化还原反应的体系中,共有KCl、
 、浓
、浓 、
、 、
、 、
、 、
、 七种物质。在反应后的溶液中加入
七种物质。在反应后的溶液中加入 (不溶于冷水),溶液又变为紫红色,
(不溶于冷水),溶液又变为紫红色, 反应后变为无色的
反应后变为无色的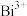 。写出该实验中涉及反应的离子方程式:
。写出该实验中涉及反应的离子方程式:(2)+6价铬的毒性很强,具有一定的致癌作用,需要转化为低毒的
 ,再转化为不溶物除去,废水中含有的
,再转化为不溶物除去,废水中含有的 可以用绿矾(
可以用绿矾( )除去。测得反应后的溶液中含
)除去。测得反应后的溶液中含 、
、 、
、 、
、 等阳离子。写出该反应的离子方程式:
等阳离子。写出该反应的离子方程式:(3)已知:①
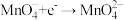 (绿色)(强碱性条件);
(绿色)(强碱性条件);②
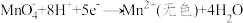 (强酸性条件)。
(强酸性条件)。将
 溶液滴入NaOH溶液中微热,得到透明的绿色溶液,写出反应的离子方程式:
溶液滴入NaOH溶液中微热,得到透明的绿色溶液,写出反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷还能让心脏有规律地跳动、维持肾脏正常机能和传达神经刺激的重要物质。许多磷的化合物是工业上的重要原料。请完成下列填空:
P(s,红磷)+ O2(g)=
O2(g)= P4O10(s)+738.5 kJ
P4O10(s)+738.5 kJ
P4(s,白磷)+ 5O2(g)=P4O10(s)+2983.2 kJ
(1)则白磷转化为红磷的热化学方程式_____________________ 。
(2)红磷在KOH溶液的悬浊液中和KOCl作用,可以生成K6P6O12的钾盐和KCl等产物。请写出该反应的化学方程式,并标出电子转移方向和数目。____
(3)制备MgNH4PO4时通常在镁盐(如氯化镁)溶液中加Na2HPO4 、氨水和铵盐溶液(如氯化铵),反应式为MgCl2+Na2HPO4+NH3=2NaCl+MgNH4PO4↓。在此反应中,如果不加铵盐,在碱性溶液中,Mg2+将会被氨水沉淀,其离子方程式为____________________ ;加入铵盐之后,可防止产生Mg(OH)2沉淀。请用电离平衡原理解释原因:_________
(4)H3PO3与碘水反应,碘水的棕黄色褪去,生成磷酸,向上述反应后的溶液中加入过量的AgNO3溶液,生成黄色沉淀。则H3PO3与碘水反应的化学方程式为___________ ;黄色沉淀是_________ ,可用作于_____________________ (写出任意一种用途即可)。
P(s,红磷)+
 O2(g)=
O2(g)= P4O10(s)+738.5 kJ
P4O10(s)+738.5 kJ P4(s,白磷)+ 5O2(g)=P4O10(s)+2983.2 kJ
(1)则白磷转化为红磷的热化学方程式
(2)红磷在KOH溶液的悬浊液中和KOCl作用,可以生成K6P6O12的钾盐和KCl等产物。请写出该反应的化学方程式,并标出电子转移方向和数目。
(3)制备MgNH4PO4时通常在镁盐(如氯化镁)溶液中加Na2HPO4 、氨水和铵盐溶液(如氯化铵),反应式为MgCl2+Na2HPO4+NH3=2NaCl+MgNH4PO4↓。在此反应中,如果不加铵盐,在碱性溶液中,Mg2+将会被氨水沉淀,其离子方程式为
(4)H3PO3与碘水反应,碘水的棕黄色褪去,生成磷酸,向上述反应后的溶液中加入过量的AgNO3溶液,生成黄色沉淀。则H3PO3与碘水反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】阅读下面科普信息,回答问题:
一个体重50 kg的健康人含铁2 g,这2 g铁在人体中以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是____
A.Fe
B.Fe2+
C.Fe3+
(2)工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有________ 性。
(3)在Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了______ 性。
(4)钒性能优良,用途广泛,有金属“维生素”之称。将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是________ 。
(5)V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则 、Cl-、VO2+还原性由大到小的顺序是
、Cl-、VO2+还原性由大到小的顺序是________ 。
(6)在20.00 mL 0.1 mol.L-1 溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是
溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是 ________ 。
a.VO2+ b. c. V2+ d.V
c. V2+ d.V
一个体重50 kg的健康人含铁2 g,这2 g铁在人体中以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是
A.Fe
B.Fe2+
C.Fe3+
(2)工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有
(3)在Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O的反应中,HNO3表现了
(4)钒性能优良,用途广泛,有金属“维生素”之称。将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应后生成VO2+等离子,该反应的化学方程式是
(5)V2O5能与盐酸反应产生VO2+和一种黄绿色气体,该气体能与Na2SO3溶液反应被吸收,则
 、Cl-、VO2+还原性由大到小的顺序是
、Cl-、VO2+还原性由大到小的顺序是(6)在20.00 mL 0.1 mol.L-1
 溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是
溶液中,加入0.195g锌粉,恰好完全反应,则还原产物可能是 a.VO2+ b.
 c. V2+ d.V
c. V2+ d.V
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】现代文明中将 排放到大气的同时,又想方设法地把空气中的
排放到大气的同时,又想方设法地把空气中的 吞下去,但在空气中的
吞下去,但在空气中的 是很稳定的。长期田间劳作的人们发现玉米等作物和豆类作物“轮换种植”长势优越。
是很稳定的。长期田间劳作的人们发现玉米等作物和豆类作物“轮换种植”长势优越。
(1)上述文字中所提到的 ,其分子的电子式是
,其分子的电子式是___________ 。简述N2稳定的原因___________ 。
(2)玉米与豆类作物轮换种植时,玉米长势优越的原因是___________
 排放到大气的同时,又想方设法地把空气中的
排放到大气的同时,又想方设法地把空气中的 吞下去,但在空气中的
吞下去,但在空气中的 是很稳定的。长期田间劳作的人们发现玉米等作物和豆类作物“轮换种植”长势优越。
是很稳定的。长期田间劳作的人们发现玉米等作物和豆类作物“轮换种植”长势优越。(1)上述文字中所提到的
 ,其分子的电子式是
,其分子的电子式是(2)玉米与豆类作物轮换种植时,玉米长势优越的原因是___________
| A.玉米有固氮作用 | B.豆类作物有固氮作用 |
| C.大气固氮的作用 | D.人工合成氨的作用 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】氮是植物体内蛋白质、叶绿素的重要组成元素,氮肥能促进农作物的生长。氨是生产氮肥的原料。氮及其部分化合物的转化关系如图所示,回答下列问题:
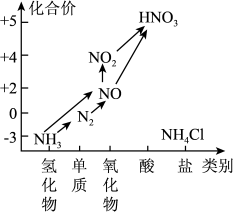
(1)下列反应中,不属于氮的固定的是_______
(2)氨的电子式是_______ 。
(3)在物质转化图中的各气体,可用排水法收集的气体是_______ (填化学式,下同),既可以用浓硫酸干燥,又可以用碱石灰干燥的是气体是_______ 。
(4)实验室常用NH4Cl与Ca(OH)2制取氨气,请写出该反应的化学方程式_______ 。而工业上则由氮气和氢气直接合成氨,该反应的化学方程式为_______ 。
(5)NO、CO都是汽车尾气的主要成分,直接排放会污染空气,人们研究出一种催化剂,可将两种气体通过,反应转化为无污染的空气成分,则反应的化学方程式是_______ 。
(6)氮的一种化合物肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H所需的能量是_______ kJ。


(1)下列反应中,不属于氮的固定的是_______
| A.N2和H2在一定条件下合成NH3 |
| B.豆科植物把空气中的氮气转化为化合态的氮 |
| C.雷电时,空气中的N2与O2反应生成NO |
| D.由NH3制碳酸氢铵 |
(3)在物质转化图中的各气体,可用排水法收集的气体是
(4)实验室常用NH4Cl与Ca(OH)2制取氨气,请写出该反应的化学方程式
(5)NO、CO都是汽车尾气的主要成分,直接排放会污染空气,人们研究出一种催化剂,可将两种气体通过,反应转化为无污染的空气成分,则反应的化学方程式是
(6)氮的一种化合物肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H所需的能量是

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】氮元素是地球上含量丰富的一种元素,氮单质及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)请写出工业固氮的化学方程式:_______ 。
(2)下列有关氮元素的说法正确的是_______。
(3)豆科植物种植时不需施加氮肥的原因是_______ 。
(1)请写出工业固氮的化学方程式:
(2)下列有关氮元素的说法正确的是_______。
| A.氮气因为其化学性质不活泼,可以作保护气,比如充填食品包装,充填电灯泡等 |
| B.医学上常用液氮作冷冻剂,在冷冻麻醉条件下做手术,是利用氮气化学性质的不活泼性 |
| C.氮、磷、钾是植物生长必需的营养元素 |
| D.用NO2与水反应制取硝酸时,水做还原剂 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】某学习小组欲制取氨气并探究其性质。请回答:
(1)实验室利用固体与固体反应制取氨气的化学方程式是___________ 。
(2)①如图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是___________ 。
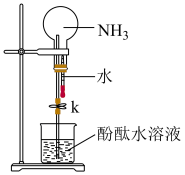
②氨气使烧杯中溶液由无色变为红色,其原因是(用方程式表示)___________ 。
(3)在上图的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是___________。
(1)实验室利用固体与固体反应制取氨气的化学方程式是
(2)①如图是进行氨气喷泉实验的装置,引发喷泉的操作步骤是

②氨气使烧杯中溶液由无色变为红色,其原因是(用方程式表示)
(3)在上图的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是___________。
A.HCl和 | B. 和 和 | C. 和苯 和苯 | D. 和烧碱溶液。 和烧碱溶液。 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】氮元素的单质和常见化合物在工、农业生产中用途广泛。
(1)氮气的化学性质很稳定,可用作灯泡填充气。从分子结构角度解释其原因是_______ 。
(2)N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式_______ 。
(3)NO和NO2可用NaOH溶液吸收主要反应为:
NO+NO2+2OH-=2NO +H2O
+H2O
2OH-+2NO2=NO +NO
+NO +H2O
+H2O
①下列措施可能提高尾气中NO和NO2去除率的有_______ (填字母)
A.加快通入尾气的速率。
B.采用气,液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
D.在尾气中同时通入氧气
②吸收后的溶液经浓缩,结晶,过滤,得到NaNO2晶体,该晶体的主要杂质_______ (填化学式)。
(4)铵盐大多在农业上用作化肥,实验室可用固体NH4Cl与固体Ca(OH)2加热反应来制备氨气,其化学方程式为_______ 。欲吸收尾气中的NH3,下列装置不宜选用_______ (填字母) 。(已知氨气难溶于有机溶剂CCl4)
A.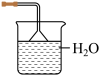 B.
B.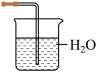 C.
C.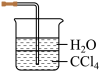 D.
D.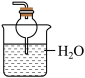
(1)氮气的化学性质很稳定,可用作灯泡填充气。从分子结构角度解释其原因是
(2)N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式
(3)NO和NO2可用NaOH溶液吸收主要反应为:
NO+NO2+2OH-=2NO
 +H2O
+H2O2OH-+2NO2=NO
 +NO
+NO +H2O
+H2O①下列措施可能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率。
B.采用气,液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
D.在尾气中同时通入氧气
②吸收后的溶液经浓缩,结晶,过滤,得到NaNO2晶体,该晶体的主要杂质
(4)铵盐大多在农业上用作化肥,实验室可用固体NH4Cl与固体Ca(OH)2加热反应来制备氨气,其化学方程式为
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2. 3350 g 样品,配制成100. 00 mL 溶液A;②准确量取25. 00 mL 溶液A,用0. 04000 mol·L-1 的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA 标准溶液31. 25 mL;③另取25. 00 mL溶液A,加足量的NaOH 溶液并充分加热,生成NH356. 00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA 标准溶液润洗,测得的Ni2+含量将_________ (填“偏高”、或“偏低”或“不变”)。
(2)氨气常用__________________ 检验,现象是________________ 。
(3)通过计算确定硫酸镍铵的化学式(写出计算过程)。________
(1)若滴定管在使用前未用EDTA 标准溶液润洗,测得的Ni2+含量将
(2)氨气常用
(3)通过计算确定硫酸镍铵的化学式(写出计算过程)。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
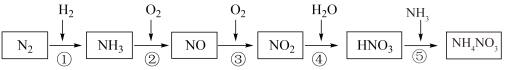
【推荐1】氮元素及其化合物的转化关系如图所示:_____ ,属于氮的固定的是______ (填序号)。
(2)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示:_______ 。
②写出催化转化过程中,生成 的化学方程式
的化学方程式_______ 。
(3) 是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是
是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是_______ (写出操作步骤、现象和结论) 。
(4)工业制硝酸时尾气中含有 、
、 ,可用以下方法吸收:
,可用以下方法吸收:
① 溶液吸收法。发生的反应有:
溶液吸收法。发生的反应有: ,
,
②用不同浓度的 溶液吸收
溶液吸收 含量不同的尾气,关系如下图:
含量不同的尾气,关系如下图: 、
、 中
中 的含量)
的含量)
i.根据上图得知_______ (填字母)。
a. 溶液浓度越大,氮氧化物的吸收率越大
溶液浓度越大,氮氧化物的吸收率越大
b. 含量越大,氮氧化物的吸收率越大
含量越大,氮氧化物的吸收率越大
ii.当 小于50%时,加入
小于50%时,加入 能提升氮氧化物的吸收率,原因是
能提升氮氧化物的吸收率,原因是_______ 。
(5)电化学气敏传感器可用于监测环境中氨气的含量,其工作原理示意图如下:_______ 。
②反应消耗的 与
与 的物质的量之比为
的物质的量之比为_______ 。
(2)汽车尾气净化装置中,气体在催化剂表面吸附与解吸作用的过程如图所示:

②写出催化转化过程中,生成
 的化学方程式
的化学方程式(3)
 是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是
是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是(4)工业制硝酸时尾气中含有
 、
、 ,可用以下方法吸收:
,可用以下方法吸收:①
 溶液吸收法。发生的反应有:
溶液吸收法。发生的反应有: ,
,
②用不同浓度的
 溶液吸收
溶液吸收 含量不同的尾气,关系如下图:
含量不同的尾气,关系如下图: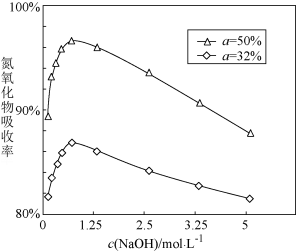
 、
、 中
中 的含量)
的含量)i.根据上图得知
a.
 溶液浓度越大,氮氧化物的吸收率越大
溶液浓度越大,氮氧化物的吸收率越大b.
 含量越大,氮氧化物的吸收率越大
含量越大,氮氧化物的吸收率越大ii.当
 小于50%时,加入
小于50%时,加入 能提升氮氧化物的吸收率,原因是
能提升氮氧化物的吸收率,原因是(5)电化学气敏传感器可用于监测环境中氨气的含量,其工作原理示意图如下:
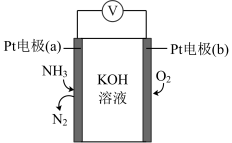
②反应消耗的
 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】氮在自然界中的循环如图所示。

(1)过程①称为_______ ,写出合成氨反应的化学方程式:_______ ,该反应中氮气显_______ 性(填“氧化”或“还原”)。
(2)过程②称为_______ ,写出③中“雷电发庄稼”的化学方程式:_______ 。

(1)过程①称为
(2)过程②称为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】氮肥的使用极大提高了粮食作物的产量,对解决世界粮食危机起到了不可或缺的作用,下面是几种通过氮的固定制备氮肥的方法。
(1)自然固氮:一种途径是通过雷电将空气中少量的氮气转化为含氮化合物(氮肥),主要转化途径如下(转化所需试剂及条件已略去):
 硝酸盐[如
硝酸盐[如 ]
]
①写出在空气中 转化为NO的化学方程式
转化为NO的化学方程式_______ 。
②将 转化为
转化为 ,列举两种不同类别的化合物M
,列举两种不同类别的化合物M_______ (写化学式)。
③若M是Cu单质,与稀硝酸反应也能生成硝酸盐,写出铜粉与稀硝酸反应的离子方程式_______ 。
(2)人工固氮:
①工业上以氮气和氢气为原料,在高温、高压和催化剂的条件下合成氨。该反应的化学方程式为_______ 。
②利用氨气与氧气在催化剂作用下生成NO,是工业制备硝酸的重要环节,该反应中NO是_______ (填“氧化产物”“还原产物”或“氧化产物和还原产物”)。
③利用氨气与二氧化碳在催化剂作用下合成重要氮肥尿素 ,尿素中N元素的化合价是
,尿素中N元素的化合价是_______ 。合成尿素的化学方程式_______ 。尿素在土壤中与水结合生成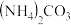 ,被植物吸收,有利于作物的生长。
,被植物吸收,有利于作物的生长。
(3)在微生物作用下实现 的转化,称为硝化过程。在一定条件下,
的转化,称为硝化过程。在一定条件下, 被
被 氧化成
氧化成 ,参加反应的
,参加反应的 和
和 的物质的量之比为
的物质的量之比为_______ 。由于 有毒,因此过量使用氮肥也会引起农作物大量减产,所以一定要合理科学使用。
有毒,因此过量使用氮肥也会引起农作物大量减产,所以一定要合理科学使用。
(4)有同学猜测,在 被细菌分解过程中,
被细菌分解过程中, 最终分解为
最终分解为 ,同时有
,同时有 生成。从化合价变化的角度分析有
生成。从化合价变化的角度分析有 生成的合理性
生成的合理性_______ 。
(1)自然固氮:一种途径是通过雷电将空气中少量的氮气转化为含氮化合物(氮肥),主要转化途径如下(转化所需试剂及条件已略去):
 硝酸盐[如
硝酸盐[如 ]
]①写出在空气中
 转化为NO的化学方程式
转化为NO的化学方程式②将
 转化为
转化为 ,列举两种不同类别的化合物M
,列举两种不同类别的化合物M③若M是Cu单质,与稀硝酸反应也能生成硝酸盐,写出铜粉与稀硝酸反应的离子方程式
(2)人工固氮:
①工业上以氮气和氢气为原料,在高温、高压和催化剂的条件下合成氨。该反应的化学方程式为
②利用氨气与氧气在催化剂作用下生成NO,是工业制备硝酸的重要环节,该反应中NO是
③利用氨气与二氧化碳在催化剂作用下合成重要氮肥尿素
 ,尿素中N元素的化合价是
,尿素中N元素的化合价是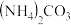 ,被植物吸收,有利于作物的生长。
,被植物吸收,有利于作物的生长。(3)在微生物作用下实现
 的转化,称为硝化过程。在一定条件下,
的转化,称为硝化过程。在一定条件下, 被
被 氧化成
氧化成 ,参加反应的
,参加反应的 和
和 的物质的量之比为
的物质的量之比为 有毒,因此过量使用氮肥也会引起农作物大量减产,所以一定要合理科学使用。
有毒,因此过量使用氮肥也会引起农作物大量减产,所以一定要合理科学使用。(4)有同学猜测,在
 被细菌分解过程中,
被细菌分解过程中, 最终分解为
最终分解为 ,同时有
,同时有 生成。从化合价变化的角度分析有
生成。从化合价变化的角度分析有 生成的合理性
生成的合理性
您最近一年使用:0次



