 与环氧丙烷(
与环氧丙烷( )在一定条件下反应制得碳酸丙烯酯。
)在一定条件下反应制得碳酸丙烯酯。
 是
是(2)环氧丙烷中,O原子的杂化轨道类型是
(3)沸点:环氧丙烷
 (填“>”或“<”),解释其原因:
(填“>”或“<”),解释其原因:
2024·上海·模拟预测 查看更多[1]
(已下线)化学(上海卷01)-2024年高考押题预测卷
更新时间:2024-05-27 15:19:15
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】下列粒子:①HCN、②NH 、③BeCl2、④
、③BeCl2、④ ,请填写下列空白(填序号):
,请填写下列空白(填序号):
(1)存在大π键的非极性分子是_______ ;只存在σ键的分子是_______ ;
(2)中心原子轨道为sp2杂化的是_______ ;空间构型呈“V”形的是_______ 。
 、③BeCl2、④
、③BeCl2、④ ,请填写下列空白(填序号):
,请填写下列空白(填序号):(1)存在大π键的非极性分子是
(2)中心原子轨道为sp2杂化的是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】Ⅰ.双氰胺结构简式如图。
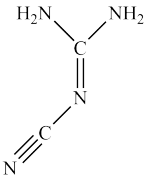
(1)双氰胺的晶体类型为_______ 。
(2)双氰胺所含元素中,_______ (填元素名称)元素基态原子核外未成对电子数最多。
(3)双氰胺分子中σ键和π键数目之比为_______ 。
Ⅱ.硼的最简单氢化物——乙硼烷球棍模型如下图,由它制取硼氢化锂的反应为2LiH+B2H6=2LiBH4
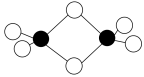
(4)乙硼烷分子中硼原子的杂化轨道类型为_______ 。
(5)BH 为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为
为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为_______ (填序号)。
A.离子键 B.金属键 C.氢键 D.配位键 E.极性键 F.非极性键
(6)根据以上反应判断,其中涉及元素的电负性从小到大的顺序为_______ (填元素符号)。
(7)碳的最简单氢化物是CH4,而硼的最简单氢化物不是BH3,其原因为_______ 。

(1)双氰胺的晶体类型为
(2)双氰胺所含元素中,
(3)双氰胺分子中σ键和π键数目之比为
Ⅱ.硼的最简单氢化物——乙硼烷球棍模型如下图,由它制取硼氢化锂的反应为2LiH+B2H6=2LiBH4

(4)乙硼烷分子中硼原子的杂化轨道类型为
(5)BH
 为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为
为正四面体结构,LiBH4中硼原子和氢原子之间的化学键为A.离子键 B.金属键 C.氢键 D.配位键 E.极性键 F.非极性键
(6)根据以上反应判断,其中涉及元素的电负性从小到大的顺序为
(7)碳的最简单氢化物是CH4,而硼的最简单氢化物不是BH3,其原因为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】几种简单有机分子中碳原子轨道的杂化方式
| 有机物分子 | 甲烷 | 乙烯 | 乙炔 | 苯 |
| 碳原子轨道的杂化方式 | ||||
| 分子空间结构 |
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
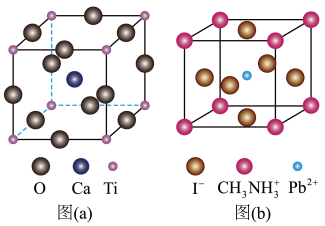
【推荐2】一种立方钙钛矿结构的金属卤化物光电材料的组成为 、
、 和有机碱离子
和有机碱离子 ,其晶胞如图(b)所示。其中
,其晶胞如图(b)所示。其中 与图(a)中
与图(a)中_______ 的空间位置相同,有机碱 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是_______ ;若晶胞参数为anm,则晶体密度为_______  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 、
、 和有机碱离子
和有机碱离子 ,其晶胞如图(b)所示。其中
,其晶胞如图(b)所示。其中 与图(a)中
与图(a)中 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
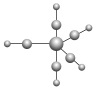
【推荐1】1985年,Rousssin研究发现了第一个金属原子簇类配位化合物,其结构如图所示,金属原子簇类化合物与金属原子表面性质相似,具有良好的催化活性等功能。请回答下列问题:
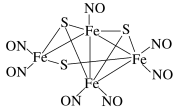
(1)硫可以形成SOCl2化合物,则该化合物的空间结构为_______ 。
(2)除了氮的氧化物之外,氮还可以形成NO 。请写出与NO
。请写出与NO 互为等电子体的分子
互为等电子体的分子_______ ;根据等电子体原理判断NO 中氮原子的杂化方式
中氮原子的杂化方式_______ 。
(3)上述原子簇类配合物,中心原子铁的配位原子是_______ 。
(4)配合物Fe(CO)5的熔点为-20 ℃,沸点为103 ℃。可用于制备纯铁。Fe(CO)5的结构如图所示。下列关于Fe(CO)5的说法正确的是_______(填字母)。

(1)硫可以形成SOCl2化合物,则该化合物的空间结构为
(2)除了氮的氧化物之外,氮还可以形成NO
 。请写出与NO
。请写出与NO 互为等电子体的分子
互为等电子体的分子 中氮原子的杂化方式
中氮原子的杂化方式(3)上述原子簇类配合物,中心原子铁的配位原子是
(4)配合物Fe(CO)5的熔点为-20 ℃,沸点为103 ℃。可用于制备纯铁。Fe(CO)5的结构如图所示。下列关于Fe(CO)5的说法正确的是_______(填字母)。

| A.Fe(CO)5是非极性分子,CO是极性分子 | B.Fe(CO)5中Fe原子以sp3杂化方式与CO成键 |
| C.1 mol Fe(CO)5含有10 mol配位键 | D.Fe(CO)5=Fe+5CO反应中没有新化学键生成 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】硅及其化合物在工业中有很多用处,一些硅的卤化物的熔点如表所示:
完成下列填空:
(1)硅原子核外共有_______ 种形状不同的电子云,画出基态硅原子最外层电子的轨道表示式_______ ;基态溴离子的核外电子排布式为_______ 。
(2)表中四种卤化物分子的空间结构均为_______ ,由此推断F-Si-F的键角为_______ ,SiF4属于______________ (填“极性”或“非极性”)分子。
(3)已知CO2(熔点为-56.6℃)和SiO2(熔点为1713℃)熔点相差较大;原因是_______ ,表中四种卤化硅熔点存在差异的原因是_______ 。
| 卤化物 | SiF4 | SiCl4 | SiBr4 | SiI4 |
| 熔点/℃ | -90.2 | -70.4 | 5.2 | 120.5 |
(1)硅原子核外共有
(2)表中四种卤化物分子的空间结构均为
(3)已知CO2(熔点为-56.6℃)和SiO2(熔点为1713℃)熔点相差较大;原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】在极性分子中,正电荷重心与负电荷重心间的距离称为偶极长,通常用d表示。极性分子的极性强弱与偶极长和电荷量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩是偶极长和电荷量的乘积即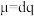 。在非极性分子中,其正、负电荷重心重合,故μ为0。试回答下列问题:
。在非极性分子中,其正、负电荷重心重合,故μ为0。试回答下列问题:
(1) 、
、 、
、 、
、 四种分子中
四种分子中 的有
的有_______ 。
(2)治癌药物 具有平面四边形结构,Pt处在四边形中心,
具有平面四边形结构,Pt处在四边形中心, 和Cl分别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的
和Cl分别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的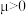 ,淡黄色化合物的
,淡黄色化合物的 。试写出两种同分异构体的结构简式:
。试写出两种同分异构体的结构简式:_______ 、_______ ,在水中溶解度较大的是_______ (填结构简式)。
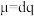 。在非极性分子中,其正、负电荷重心重合,故μ为0。试回答下列问题:
。在非极性分子中,其正、负电荷重心重合,故μ为0。试回答下列问题:(1)
 、
、 、
、 、
、 四种分子中
四种分子中 的有
的有(2)治癌药物
 具有平面四边形结构,Pt处在四边形中心,
具有平面四边形结构,Pt处在四边形中心, 和Cl分别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的
和Cl分别处在四边形的4个顶点。已知该化合物有两种同分异构体,棕黄色化合物的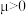 ,淡黄色化合物的
,淡黄色化合物的 。试写出两种同分异构体的结构简式:
。试写出两种同分异构体的结构简式:
您最近一年使用:0次





 ⑦
⑦ ⑧
⑧ ⑨
⑨ ,填下列空白(填序号):
,填下列空白(填序号): 杂化的是
杂化的是

