苯酚(C6H5OH)是一种广泛使用的化工产品,但若在水体中存在超标又会导致严重的污染。
Ⅰ.现有一种在一定温度下用某分子筛催化N2O废气氧化苯制备苯酚的新方法,方程式为C6H6(g)+N2O(g)⇌C6H5OH(g)+N2(g)。
(1)已知:①6C(s,石墨)+3H2(g)⇌C6H6(g);ΔH1=+82.9kJ·mol-1
②2N2(g)+O2(g)⇌2N2O(g);ΔH2=+163.2kJ·mol-1
③12C(s,石墨)+6H2(g)+O2(g)⇌2C6H5OH(g);ΔH3=-243kJ·mol-1
则C6H6(g)+N2O(g)⇌C6H5OH(g)+N2(g);ΔH=___________ 。
(2)以固定N2O和苯酚比例、恒定流速、O2加入量为1%的条件下,考查单因素改变反应温度时对N2O转化率和苯酚选择性的影响如图1和图2所示。___________ 。
②由图2可知,在648K和673K反应时,苯酚的选择性基本保持恒定,而在698K和723K时,苯酚选择性随着反应进行迅速下降,高温时苯酚选择性下降的原因可能是___________ 。
Ⅱ.以苯酚为原料化合成某有机物的反应机理如图3所示(图中个别反应物未列出,Ph为苯环):___________ 。
Ⅲ.Fenton试剂氧化法是一种很好的除去废水中苯酚的方法。Fe2+/H2O2联合处理有机废水时,Fe2++H2O2=Fe3++HO·+OH-,生成了氧化性能极强的HO·,使废水中的苯酚得到彻底降解。
(4)①·OH与苯酚反应的化学方程式为___________ 。
②H2O2在Fe3O4催化下除去废水中的苯酚的原理如图4所示。研究在不同初始pH条件下,苯酚的去除率随时间的变化,结果表明:在反应开始时,初始pH=6的溶液中苯酚的去除率明显低于初始pH=3的溶液,但一段时间后两者接近,原因是___________ 。
Ⅰ.现有一种在一定温度下用某分子筛催化N2O废气氧化苯制备苯酚的新方法,方程式为C6H6(g)+N2O(g)⇌C6H5OH(g)+N2(g)。
(1)已知:①6C(s,石墨)+3H2(g)⇌C6H6(g);ΔH1=+82.9kJ·mol-1
②2N2(g)+O2(g)⇌2N2O(g);ΔH2=+163.2kJ·mol-1
③12C(s,石墨)+6H2(g)+O2(g)⇌2C6H5OH(g);ΔH3=-243kJ·mol-1
则C6H6(g)+N2O(g)⇌C6H5OH(g)+N2(g);ΔH=
(2)以固定N2O和苯酚比例、恒定流速、O2加入量为1%的条件下,考查单因素改变反应温度时对N2O转化率和苯酚选择性的影响如图1和图2所示。
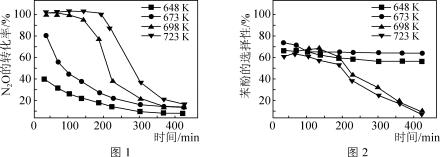
②由图2可知,在648K和673K反应时,苯酚的选择性基本保持恒定,而在698K和723K时,苯酚选择性随着反应进行迅速下降,高温时苯酚选择性下降的原因可能是
Ⅱ.以苯酚为原料化合成某有机物的反应机理如图3所示(图中个别反应物未列出,Ph为苯环):
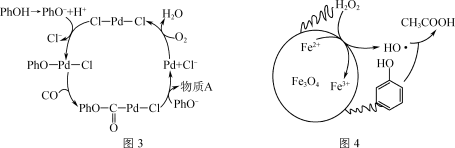
Ⅲ.Fenton试剂氧化法是一种很好的除去废水中苯酚的方法。Fe2+/H2O2联合处理有机废水时,Fe2++H2O2=Fe3++HO·+OH-,生成了氧化性能极强的HO·,使废水中的苯酚得到彻底降解。
(4)①·OH与苯酚反应的化学方程式为
②H2O2在Fe3O4催化下除去废水中的苯酚的原理如图4所示。研究在不同初始pH条件下,苯酚的去除率随时间的变化,结果表明:在反应开始时,初始pH=6的溶液中苯酚的去除率明显低于初始pH=3的溶液,但一段时间后两者接近,原因是
2024高三·全国·专题练习 查看更多[1]
(已下线)FHgkyldyjhx16
更新时间:2024-05-04 15:59:15
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】打造宜居环境,消除含氯、氮、硫等化合物的污染对建设美丽家乡具有重要意义。
(1)①以HCl为原料,用 氧化制取
氧化制取 ,可提高双益,减少污染。反应为:
,可提高双益,减少污染。反应为:
 ,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。原理如图所示:
,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。原理如图所示:
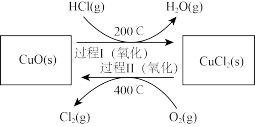
过程Ⅰ的反应为: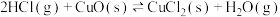
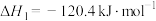 ,过程Ⅱ反应的热化学方程式为
,过程Ⅱ反应的热化学方程式为___________ 。
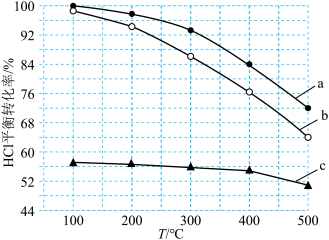
②下图为刚性容器中,进料浓度比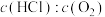 分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系,进料浓度比
分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系,进料浓度比 对应图中曲线
对应图中曲线___________ (填“a”、“b”或“c”);
(2)研究CO还原 对环境的治理有重要意义,相关的主要化学反应有:
对环境的治理有重要意义,相关的主要化学反应有:
Ⅰ.
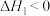
Ⅱ.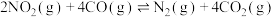
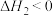
Ⅲ.
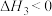
①下列描述正确的是___________ ;(填字母序号)
A.在绝热恒容密闭容器中只进行反应Ⅰ,若压强不变,能说明反应Ⅰ达到平衡状态
B.反应Ⅱ ,
, ;该反应在低温下自发进行
;该反应在低温下自发进行
C.恒温条件下,增大CO的浓度能使反应Ⅲ的平衡向正向移动,平衡常数增大
D.上述反应达到平衡后,升温,三个反应的逆反应速率均一直增大直至达到新的平衡
②一定温度下,向固定体积的密闭容器中充入等物质的量的NO和CO,体系的初始总压强为p kPa,发生反应Ⅲ,实验测得,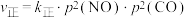 ,
,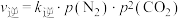 (
( 、
、 为速率常数,只与温度有关,p为物质的分压)。达到平衡时,
为速率常数,只与温度有关,p为物质的分压)。达到平衡时, 占平衡总体积的1/4,则
占平衡总体积的1/4,则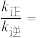
___________ 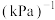 。
。
(3)将 与
与 按体积比1∶1充入恒容密闭容器中发生反应:
按体积比1∶1充入恒容密闭容器中发生反应: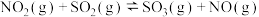
 ,
, ℃、
℃、 C时,物质的分压变化如图所示。
C时,物质的分压变化如图所示。
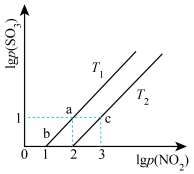
根据题意可知:
_________  (填“>”“<”或“=”),由平衡状态a到b,改变的条件是
(填“>”“<”或“=”),由平衡状态a到b,改变的条件是_________ 。
(1)①以HCl为原料,用
 氧化制取
氧化制取 ,可提高双益,减少污染。反应为:
,可提高双益,减少污染。反应为:
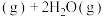
 ,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。原理如图所示:
,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。原理如图所示:
过程Ⅰ的反应为:
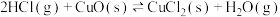
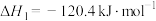 ,过程Ⅱ反应的热化学方程式为
,过程Ⅱ反应的热化学方程式为②下图为刚性容器中,进料浓度比
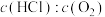 分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系,进料浓度比
分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系,进料浓度比 对应图中曲线
对应图中曲线
(2)研究CO还原
 对环境的治理有重要意义,相关的主要化学反应有:
对环境的治理有重要意义,相关的主要化学反应有:Ⅰ.

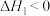
Ⅱ.
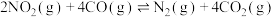
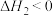
Ⅲ.

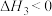
①下列描述正确的是
A.在绝热恒容密闭容器中只进行反应Ⅰ,若压强不变,能说明反应Ⅰ达到平衡状态
B.反应Ⅱ
 ,
, ;该反应在低温下自发进行
;该反应在低温下自发进行C.恒温条件下,增大CO的浓度能使反应Ⅲ的平衡向正向移动,平衡常数增大
D.上述反应达到平衡后,升温,三个反应的逆反应速率均一直增大直至达到新的平衡
②一定温度下,向固定体积的密闭容器中充入等物质的量的NO和CO,体系的初始总压强为p kPa,发生反应Ⅲ,实验测得,
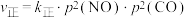 ,
,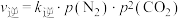 (
( 、
、 为速率常数,只与温度有关,p为物质的分压)。达到平衡时,
为速率常数,只与温度有关,p为物质的分压)。达到平衡时, 占平衡总体积的1/4,则
占平衡总体积的1/4,则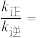
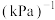 。
。(3)将
 与
与 按体积比1∶1充入恒容密闭容器中发生反应:
按体积比1∶1充入恒容密闭容器中发生反应: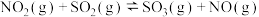
 ,
, ℃、
℃、 C时,物质的分压变化如图所示。
C时,物质的分压变化如图所示。
根据题意可知:

 (填“>”“<”或“=”),由平衡状态a到b,改变的条件是
(填“>”“<”或“=”),由平衡状态a到b,改变的条件是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】氮氧化物(NOx)的排放对环境造成严重污染。回答下列问题:
I.工业上可利用C(s)+2NO(g)=CO2(g)+N2(g)反应处理氮氧化物。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1,碳的燃烧热为393.5kJ·mol-1,则C(s)+2NO(g)=CO2(g)+N2(g) ΔH2=_______ kJ·mol-1。
(2)某温度下,向盛有足量单质C的恒容密闭容器通入NO,使其初始浓度为1mol·L-1。根据平衡时以某物质表示的v正(或v逆)、浓度的数值,绘制出下图中甲、乙两点。
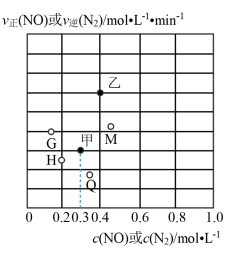
①乙点对应的物质是___ (填化学式);该反应的平衡常数为____ 。
②将温度降低至某一温度时,反应重新达到平衡,此时体系的压强为p=105Pa,NO的体积分数为30%,则N2的分压为p(N2)=____ Pa(分压=总压×物质的量分数);则图中甲点可能移动至____ 点位置(填字母标号)。
II.原煤经热解、冷却得到的煤焦可用于NO的脱除。热解温度为500℃、900℃得到的煤焦分别用S-500、S-900表示,相关信息如下表:
将NO浓度恒定的废气以固定流速通过如下反应器。不同温度下,进行多组平行实验,测定相同时间内NO的出口浓度,可得NO的脱除率与温度的关系如下图所示。[已知:NO的脱除主要含吸附和化学还原(ΔH<0)两个过程。]

(3)已知煤焦表面存在的官能团有利于NO的吸附,其数量与煤焦中氢碳质量比的值密切相关。由图可知,相同温度下,S-500对NO的脱除率比S-900的高,结合表格数据分析其可能原因是___ 、___ 。
(4)350℃后,随着温度升高,NO的脱除率增大的原因是____ 。
I.工业上可利用C(s)+2NO(g)=CO2(g)+N2(g)反应处理氮氧化物。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1,碳的燃烧热为393.5kJ·mol-1,则C(s)+2NO(g)=CO2(g)+N2(g) ΔH2=
(2)某温度下,向盛有足量单质C的恒容密闭容器通入NO,使其初始浓度为1mol·L-1。根据平衡时以某物质表示的v正(或v逆)、浓度的数值,绘制出下图中甲、乙两点。

①乙点对应的物质是
②将温度降低至某一温度时,反应重新达到平衡,此时体系的压强为p=105Pa,NO的体积分数为30%,则N2的分压为p(N2)=
II.原煤经热解、冷却得到的煤焦可用于NO的脱除。热解温度为500℃、900℃得到的煤焦分别用S-500、S-900表示,相关信息如下表:
| 煤焦 | 元素分析(%) | 比表面积(cm2∙g-1) | |
| C | H | ||
| S-500 | 80.79 | 2.76 | 105.69 |
| S-900 | 84.26 | 0.82 | 8.98 |

(3)已知煤焦表面存在的官能团有利于NO的吸附,其数量与煤焦中氢碳质量比的值密切相关。由图可知,相同温度下,S-500对NO的脱除率比S-900的高,结合表格数据分析其可能原因是
(4)350℃后,随着温度升高,NO的脱除率增大的原因是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
(1)则25℃时H2(g)和C(石墨,s)生成C6H6(l)的热化学方程式为________ 。
(2)雨水中含有来自大气的CO2,溶于水中的CO2进一步和水反应,发生电离:
①CO2(g)=CO2(aq)
②CO2(aq)+H2O(l)=H+(aq)+HCO (aq)
(aq)
25℃时,反应②的平衡常数为K2。
溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为ymol•L-1•kPa-1,当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为________ mol•L-1(写出表达式,考虑水的电离,忽略HCO 的电离)
的电离)
(3)105℃时,将足量的某碳酸氢盐(MHCO3)固体置于真空恒容容器中,存在如下平衡:2MHCO3(s)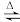 M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa。
M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa。
保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于________ kPa。
(4)我国科学家研究Li—CO2电池,取得了重大科研成果,回答下列问题:
①Li—CO2电池中,Li为单质锂片,则该电池中的CO2在___ (填“正”或“负”)极发生电化学反应。研究表明,该电池反应产物为碳酸锂和单质碳,且CO2电还原后与锂离子结合形成碳酸锂按以下4个步骤进行,写出步骤Ⅲ的离子方程式。
Ⅰ.2CO2+2e-=C2O Ⅱ.C2O
Ⅱ.C2O =CO2+CO
=CO2+CO
Ⅲ.__________ Ⅳ.CO +2Li+=Li2CO3
+2Li+=Li2CO3
②研究表明,在电解质水溶液中,CO2气体可被电化学还原。
Ⅰ.CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为_________ 。
Ⅱ.在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图.由此判断,CO2电还原为CO从易到难的顺序为_______ (用a、b、c字母排序)。
(1)大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知25℃时,相关物质的燃烧热数据如表:
| 物质 | H2(g) | C(石墨,s) | C6H6(l) |
| 燃烧热△H(kJ•mol-1) | -285.8 | -393.5 | -3267.5 |
(2)雨水中含有来自大气的CO2,溶于水中的CO2进一步和水反应,发生电离:
①CO2(g)=CO2(aq)
②CO2(aq)+H2O(l)=H+(aq)+HCO
 (aq)
(aq)25℃时,反应②的平衡常数为K2。
溶液中CO2的浓度与其在空气中的分压成正比(分压=总压×物质的量分数),比例系数为ymol•L-1•kPa-1,当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为
 的电离)
的电离)(3)105℃时,将足量的某碳酸氢盐(MHCO3)固体置于真空恒容容器中,存在如下平衡:2MHCO3(s)
 M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa。
M2CO3(s)+H2O(g)+CO2(g)。上述反应达平衡时体系的总压为46kPa。保持温度不变,开始时在体系中先通入一定量的CO2(g),再加入足量MHCO3(s),欲使平衡时体系中水蒸气的分压小于5kPa,CO2(g)的初始压强应大于
(4)我国科学家研究Li—CO2电池,取得了重大科研成果,回答下列问题:
①Li—CO2电池中,Li为单质锂片,则该电池中的CO2在
Ⅰ.2CO2+2e-=C2O
 Ⅱ.C2O
Ⅱ.C2O =CO2+CO
=CO2+CO
Ⅲ.
 +2Li+=Li2CO3
+2Li+=Li2CO3②研究表明,在电解质水溶液中,CO2气体可被电化学还原。
Ⅰ.CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为
Ⅱ.在电解质水溶液中,三种不同催化剂(a、b、c)上CO2电还原为CO的反应进程中(H+被还原为H2的反应可同时发生),相对能量变化如图.由此判断,CO2电还原为CO从易到难的顺序为

您最近一年使用:0次
【推荐1】甲烷和二氧化碳都是温室气体。随着石油资源日益枯竭,储量丰富的甲烷(天然气、页岩气、可燃冰的主要成分)及二氧化碳的高效利用已成为科学研究的热点。回答下列问题:
(1)在催化剂作用下,将甲烷部分氧化制备合成气(CO和H2)的反应为CH4(g)+ O2(g) =CO(g)+2H2(g)。
O2(g) =CO(g)+2H2(g)。
①已知:25℃,101 kPa,由稳定单质生成1mol化合物的焓变称为该化合物的标准摩尔生成焓。化学反应的反应热ΔH=生成物的标准摩尔生成焓总和-反应物的标准摩尔生成焓总和。相关数据如下表:
由此计算CH4(g)+ O2(g) =CO(g)+2H2(g)的∆H=
O2(g) =CO(g)+2H2(g)的∆H=_______ kJ·mol-1。
②催化剂能显著提高上述反应的速率,但不能改变下列中的_______ (填标号)。
a.反应的活化能 b.活化分子百分数 c.化学平衡常数 d.反应热(ΔH)
③T℃,向VL密闭容器中充入1 mol CH4和0.5 mol O2,在催化作用下发生上述反应,达到平衡时CO的物质的量为0.9 mol,平衡常数K=_______ (列出计算式即可,不必化简)。
④欲提高甲烷的平衡转化率,可采取的两条措施是_______ 。
(2)甲烷和二氧化碳催化重整制备合成气的反应为CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH>0。我国学者通过计算机模拟对该反应进行理论研究,提出在Pt-Ni合金或Sn-Ni合金催化下,以甲烷逐级脱氢开始产生的能量称为吸附能)。脱氢阶段的反应历程如下图所示(*表示吸附在催化剂表面,吸附过程产生的能量称为吸附能)。

该历程中最大能垒(活化能)E正=_______ eV·mol-1;两种催化剂比较,脱氢反应阶段催化效果更好的是_______ 合金。
(1)在催化剂作用下,将甲烷部分氧化制备合成气(CO和H2)的反应为CH4(g)+
 O2(g) =CO(g)+2H2(g)。
O2(g) =CO(g)+2H2(g)。 ①已知:25℃,101 kPa,由稳定单质生成1mol化合物的焓变称为该化合物的标准摩尔生成焓。化学反应的反应热ΔH=生成物的标准摩尔生成焓总和-反应物的标准摩尔生成焓总和。相关数据如下表:
| 物质 | CH4 | O2 | CO | H2 |
| 标准摩尔生成焓/kJ∙mol-1 | -74.8 | 0 | -110.5 | 0 |
 O2(g) =CO(g)+2H2(g)的∆H=
O2(g) =CO(g)+2H2(g)的∆H=②催化剂能显著提高上述反应的速率,但不能改变下列中的
a.反应的活化能 b.活化分子百分数 c.化学平衡常数 d.反应热(ΔH)
③T℃,向VL密闭容器中充入1 mol CH4和0.5 mol O2,在催化作用下发生上述反应,达到平衡时CO的物质的量为0.9 mol,平衡常数K=
④欲提高甲烷的平衡转化率,可采取的两条措施是
(2)甲烷和二氧化碳催化重整制备合成气的反应为CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH>0。我国学者通过计算机模拟对该反应进行理论研究,提出在Pt-Ni合金或Sn-Ni合金催化下,以甲烷逐级脱氢开始产生的能量称为吸附能)。脱氢阶段的反应历程如下图所示(*表示吸附在催化剂表面,吸附过程产生的能量称为吸附能)。

该历程中最大能垒(活化能)E正=
您最近一年使用:0次
【推荐2】单团簇催化剂(SCCs)是指由多个金属原子组成的亚纳米小颗粒,对其结构、性能、应用的研究具有广阔的前景。
(1)某SCCs的结构如下:
反应i.2NO(g)+2H2(g) N2(g)+2H2O(g)
N2(g)+2H2O(g)  kJ·mol-1;
kJ·mol-1;
反应ii.2NO(g)+5H2(g) 2NH3(g)+2H2O(g)
2NH3(g)+2H2O(g)  kJ·mol-1。
kJ·mol-1。
则NH3(g)
 N2(g)+
N2(g)+ H2(g)
H2(g)  =
=________ kJ·mol-1。
(3)在 ℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2发生上述反应i和ii,测得含氮元素物质占比[例如
℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2发生上述反应i和ii,测得含氮元素物质占比[例如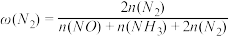 ×100%]与时间的关系如图所示。已知:反应ii为快反应,其平衡的建立可认为不受慢反应i的影响,即可认为反应ⅱ建立平衡后始终处于平衡状态。
×100%]与时间的关系如图所示。已知:反应ii为快反应,其平衡的建立可认为不受慢反应i的影响,即可认为反应ⅱ建立平衡后始终处于平衡状态。________ 、____ 。(填“ ”“
”“ ”或“
”或“ ”)
”)
②若选择对反应ii催化效果更好的催化剂,则A点可能移向________ (填“E”“E点上方”或“E点下方”)。
③已知C点、D点均为平衡点,则反应i的平衡常数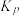 =
=____ kPa-1(列出计算式即可,平衡时分压代替平衡浓度)。
(1)某SCCs的结构如下:
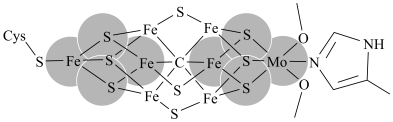
Cys的结构简式为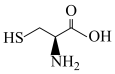 ,其组成元素中电负性从大到小依次是
,其组成元素中电负性从大到小依次是
反应i.2NO(g)+2H2(g)
 N2(g)+2H2O(g)
N2(g)+2H2O(g)  kJ·mol-1;
kJ·mol-1;反应ii.2NO(g)+5H2(g)
 2NH3(g)+2H2O(g)
2NH3(g)+2H2O(g)  kJ·mol-1。
kJ·mol-1。则NH3(g)

 N2(g)+
N2(g)+ H2(g)
H2(g)  =
=(3)在
 ℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2发生上述反应i和ii,测得含氮元素物质占比[例如
℃、100 kPa反应条件下,向密闭容器中充入2 mol NO和6 mol H2发生上述反应i和ii,测得含氮元素物质占比[例如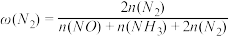 ×100%]与时间的关系如图所示。已知:反应ii为快反应,其平衡的建立可认为不受慢反应i的影响,即可认为反应ⅱ建立平衡后始终处于平衡状态。
×100%]与时间的关系如图所示。已知:反应ii为快反应,其平衡的建立可认为不受慢反应i的影响,即可认为反应ⅱ建立平衡后始终处于平衡状态。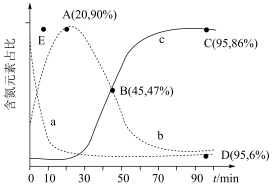
 ”“
”“ ”或“
”或“ ”)
”)②若选择对反应ii催化效果更好的催化剂,则A点可能移向
③已知C点、D点均为平衡点,则反应i的平衡常数
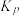 =
=
您最近一年使用:0次
【推荐3】“2030年前碳达峰,2060年前实现碳中和”定调国家级绿色发展战略。防治大气污染、水体污染等是世界各国保护环境的最重要课题。
Ⅰ.
(1)一氧化碳是一种大气污染物,也是一种重要的化工原料,科学家首次用X射线激光技术观察到CO与O2在催化剂表面生成CO2的过程,模拟图如图所示(部分微粒未画出)___________ 。
a.状态Ⅰ→状态Ⅲ未发生化学变化
b.状态Ⅲ→状态Ⅴ的反应为CO+O=CO2
c.状态Ⅳ→状态Ⅴ过程无能量变化
(2)CO2催化加氢合成二甲醚是一种实现“碳中和”理想的CO2转化方法。该过程中涉及的反应为:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)
该反应通过以下步骤来实现:
i.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)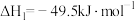
ii.2CH3OH(g)⇌CH3OCH3(g)+H2O(g)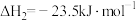
 =
=___________ kJ·mol-1,1molCH3OCH3中sp3杂化方式原子个数为___________ 。
Ⅱ.已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g) =-173.6kJ·mol-1。
=-173.6kJ·mol-1。
(3)图甲、图乙分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=n(H2)/n(CO2)。___________ 。
②图乙中m1、m2、m3投料比从大到小的顺序为___________ ,理由是___________ 。
(4)图丙表示在m=3,总压为5MPa的恒压条件下,各物质平衡时的物质的量分数随温度的变化关系。___________ 。(填化学式)
②T4温度时,该反应的平衡常数Kp=___________ 。
(提示:用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,列出计算式,不需化简和计算)
Ⅲ.北京冬奥会基本实现了100%绿电供应和碳中和。利用如图所示光催化技术装置可实现“碳中和”。___________ 。
Ⅰ.
(1)一氧化碳是一种大气污染物,也是一种重要的化工原料,科学家首次用X射线激光技术观察到CO与O2在催化剂表面生成CO2的过程,模拟图如图所示(部分微粒未画出)
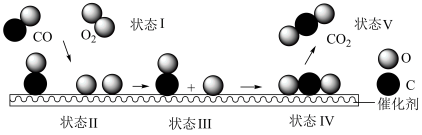
a.状态Ⅰ→状态Ⅲ未发生化学变化
b.状态Ⅲ→状态Ⅴ的反应为CO+O=CO2
c.状态Ⅳ→状态Ⅴ过程无能量变化
(2)CO2催化加氢合成二甲醚是一种实现“碳中和”理想的CO2转化方法。该过程中涉及的反应为:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g)

该反应通过以下步骤来实现:
i.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
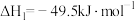
ii.2CH3OH(g)⇌CH3OCH3(g)+H2O(g)
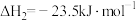
 =
=Ⅱ.已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)⇌C2H5OH(g)+3H2O(g)
 =-173.6kJ·mol-1。
=-173.6kJ·mol-1。(3)图甲、图乙分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=n(H2)/n(CO2)。
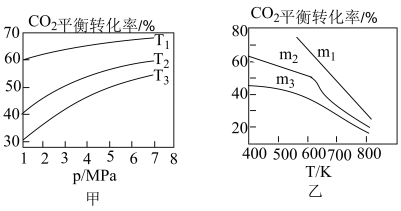
②图乙中m1、m2、m3投料比从大到小的顺序为
(4)图丙表示在m=3,总压为5MPa的恒压条件下,各物质平衡时的物质的量分数随温度的变化关系。
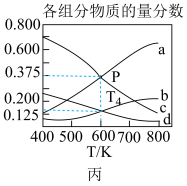
②T4温度时,该反应的平衡常数Kp=
(提示:用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,列出计算式,不需化简和计算)
Ⅲ.北京冬奥会基本实现了100%绿电供应和碳中和。利用如图所示光催化技术装置可实现“碳中和”。

您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】含苯酚的工业废水的方案如下图所示:
(1)设备①进行的是________ 操作(填写操作名称),实验室这一步操作所用的仪器是_______ 。
(2)由设备②进入设备③的物质A是_____________ 。
(3)在设备③中发生反应的化学方程式为_____________________________ 。
(4)在设备④中,物质B的水溶液和CaO反应,产物是CaCO3、_________ 和水,再通过过滤得产物。
(5)上图中,能循环使用的物质是C6H6、CaO、NaOH水溶液、___________ 。
(6)写出同时满足下列条件的苯酚的一种同分异构体的结构简式是_________ 。
①核磁共振氢谱只有一个峰
②分子中无碳碳双键

(1)设备①进行的是
(2)由设备②进入设备③的物质A是
(3)在设备③中发生反应的化学方程式为
(4)在设备④中,物质B的水溶液和CaO反应,产物是CaCO3、
(5)上图中,能循环使用的物质是C6H6、CaO、NaOH水溶液、
(6)写出同时满足下列条件的苯酚的一种同分异构体的结构简式是
①核磁共振氢谱只有一个峰
②分子中无碳碳双键
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】含苯酚的工业废水的处理流程如图所示。

(1)流程图设备Ⅰ中进行的是________ 操作(填写操作名称)。
(2)由设备Ⅱ进入设备Ⅲ的物质A是________ (填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是________ 。
(3)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和________ 。通过________ (填操作名称)操作,可以使产物相互分离。
(4)图中,能循环使用的物质是________ 、________ 、NaOH和CaO(填化学式)。

(1)流程图设备Ⅰ中进行的是
(2)由设备Ⅱ进入设备Ⅲ的物质A是
(3)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和
(4)图中,能循环使用的物质是
您最近一年使用:0次
【推荐3】Ⅰ、含苯酚的工业废水的处理流程如图所示。
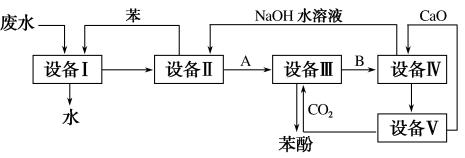
(1)①流程图设备Ⅰ中进行的是____ 操作(填写操作名称)。实验室里这一步操作可以用_______ (填仪器名称)进行。
②向设备Ⅱ加入NaOH溶液目的是________ (填化学方程式),由设备Ⅱ进入设备Ⅲ的物质A是________ (填化学式),由设备Ⅲ进入设备Ⅳ的物质B是________ 。
③在设备Ⅲ中发生反应的化学方程式为___________________________________ 。
④在设备Ⅳ中,CaO与水反应后的产物与B的水溶液反应的化学方程式为_____________ 。通过________ (填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是________ 、________ 、________ 、和________ 。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是_______ 。
(3)从溶有乙醇的苯酚溶液中回收苯酚有下列操作①蒸馏 ②过滤 ③静置分液 ④加入足量的金属钠 ⑤通入过量的CO2气体⑥加入足量的NaOH溶液⑦加入足量的FeCl3溶液 ⑧加入硫酸与NaBr共热,合理的步骤是___________
Ⅱ.某化学兴趣小组的同学在乙醛溶液中加入溴水,溴水褪色。分析乙醛的结构和性质,同学们认为溴水褪色的原因有三种可能(请补充完整):
①溴在不饱和键上发生加成反应。
②溴与甲基上的氢原子发生取代反应。
③______________________ 。
为确定此反应的机理,同学们进行了如下探究:
(1)向反应后的溶液中加入硝酸银溶液,若有沉淀产生,则上述第________ 种可能被排除。
(2)有同学提出通过检测反应后溶液的酸碱性作进一步验证,就可确定该反应究竟是何种反应原理。此方案是否可行?________ ,理由是__________________________ 。
(3)若反应物Br2与生成物Br-的物质的量之比是1∶2,则乙醛与溴水反应的化学方程式为________________________ 。
(4)已知烯烃能发生如下反应:
 RCHO+R′CHO,请写出下列反应产物的结构简式:
RCHO+R′CHO,请写出下列反应产物的结构简式:
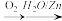
___________________________________________ ;

(1)①流程图设备Ⅰ中进行的是
②向设备Ⅱ加入NaOH溶液目的是
③在设备Ⅲ中发生反应的化学方程式为
④在设备Ⅳ中,CaO与水反应后的产物与B的水溶液反应的化学方程式为
⑤图中,能循环使用的物质是
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是
(3)从溶有乙醇的苯酚溶液中回收苯酚有下列操作①蒸馏 ②过滤 ③静置分液 ④加入足量的金属钠 ⑤通入过量的CO2气体⑥加入足量的NaOH溶液⑦加入足量的FeCl3溶液 ⑧加入硫酸与NaBr共热,合理的步骤是
Ⅱ.某化学兴趣小组的同学在乙醛溶液中加入溴水,溴水褪色。分析乙醛的结构和性质,同学们认为溴水褪色的原因有三种可能(请补充完整):
①溴在不饱和键上发生加成反应。
②溴与甲基上的氢原子发生取代反应。
③
为确定此反应的机理,同学们进行了如下探究:
(1)向反应后的溶液中加入硝酸银溶液,若有沉淀产生,则上述第
(2)有同学提出通过检测反应后溶液的酸碱性作进一步验证,就可确定该反应究竟是何种反应原理。此方案是否可行?
(3)若反应物Br2与生成物Br-的物质的量之比是1∶2,则乙醛与溴水反应的化学方程式为
(4)已知烯烃能发生如下反应:

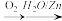 RCHO+R′CHO,请写出下列反应产物的结构简式:
RCHO+R′CHO,请写出下列反应产物的结构简式:
您最近一年使用:0次



