打造宜居环境,消除含氯、氮、硫等化合物的污染对建设美丽家乡具有重要意义。
(1)①以HCl为原料,用 氧化制取
氧化制取 ,可提高双益,减少污染。反应为:
,可提高双益,减少污染。反应为:
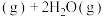
 ,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。原理如图所示:
,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。原理如图所示:
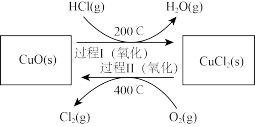
过程Ⅰ的反应为: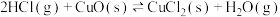
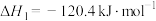 ,过程Ⅱ反应的热化学方程式为
,过程Ⅱ反应的热化学方程式为___________ 。
②下图为刚性容器中,进料浓度比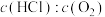 分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系,进料浓度比
分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系,进料浓度比 对应图中曲线
对应图中曲线___________ (填“a”、“b”或“c”);
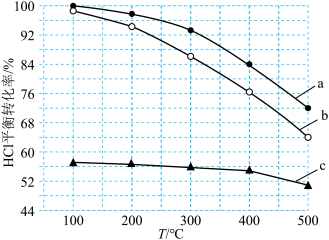
(2)研究CO还原 对环境的治理有重要意义,相关的主要化学反应有:
对环境的治理有重要意义,相关的主要化学反应有:
Ⅰ.
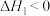
Ⅱ.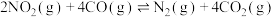

Ⅲ.

①下列描述正确的是___________ ;(填字母序号)
A.在绝热恒容密闭容器中只进行反应Ⅰ,若压强不变,能说明反应Ⅰ达到平衡状态
B.反应Ⅱ ,
, ;该反应在低温下自发进行
;该反应在低温下自发进行
C.恒温条件下,增大CO的浓度能使反应Ⅲ的平衡向正向移动,平衡常数增大
D.上述反应达到平衡后,升温,三个反应的逆反应速率均一直增大直至达到新的平衡
②一定温度下,向固定体积的密闭容器中充入等物质的量的NO和CO,体系的初始总压强为p kPa,发生反应Ⅲ,实验测得,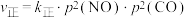 ,
,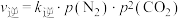 (
( 、
、 为速率常数,只与温度有关,p为物质的分压)。达到平衡时,
为速率常数,只与温度有关,p为物质的分压)。达到平衡时, 占平衡总体积的1/4,则
占平衡总体积的1/4,则
___________ 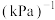 。
。
(3)将 与
与 按体积比1∶1充入恒容密闭容器中发生反应:
按体积比1∶1充入恒容密闭容器中发生反应: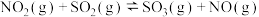
 ,
, ℃、
℃、 C时,物质的分压变化如图所示。
C时,物质的分压变化如图所示。
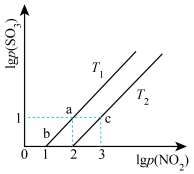
根据题意可知:
_________  (填“>”“<”或“=”),由平衡状态a到b,改变的条件是
(填“>”“<”或“=”),由平衡状态a到b,改变的条件是_________ 。
(1)①以HCl为原料,用
 氧化制取
氧化制取 ,可提高双益,减少污染。反应为:
,可提高双益,减少污染。反应为:
 ,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。原理如图所示:
,通过控制合适条件,分两步循环进行,可使HCl转化率接近100%。原理如图所示:
过程Ⅰ的反应为:
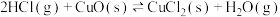
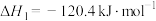 ,过程Ⅱ反应的热化学方程式为
,过程Ⅱ反应的热化学方程式为②下图为刚性容器中,进料浓度比
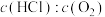 分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系,进料浓度比
分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系,进料浓度比 对应图中曲线
对应图中曲线
(2)研究CO还原
 对环境的治理有重要意义,相关的主要化学反应有:
对环境的治理有重要意义,相关的主要化学反应有:Ⅰ.

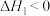
Ⅱ.
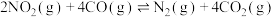

Ⅲ.


①下列描述正确的是
A.在绝热恒容密闭容器中只进行反应Ⅰ,若压强不变,能说明反应Ⅰ达到平衡状态
B.反应Ⅱ
 ,
, ;该反应在低温下自发进行
;该反应在低温下自发进行C.恒温条件下,增大CO的浓度能使反应Ⅲ的平衡向正向移动,平衡常数增大
D.上述反应达到平衡后,升温,三个反应的逆反应速率均一直增大直至达到新的平衡
②一定温度下,向固定体积的密闭容器中充入等物质的量的NO和CO,体系的初始总压强为p kPa,发生反应Ⅲ,实验测得,
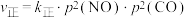 ,
,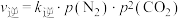 (
( 、
、 为速率常数,只与温度有关,p为物质的分压)。达到平衡时,
为速率常数,只与温度有关,p为物质的分压)。达到平衡时, 占平衡总体积的1/4,则
占平衡总体积的1/4,则
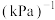 。
。(3)将
 与
与 按体积比1∶1充入恒容密闭容器中发生反应:
按体积比1∶1充入恒容密闭容器中发生反应: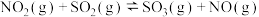
 ,
, ℃、
℃、 C时,物质的分压变化如图所示。
C时,物质的分压变化如图所示。
根据题意可知:

 (填“>”“<”或“=”),由平衡状态a到b,改变的条件是
(填“>”“<”或“=”),由平衡状态a到b,改变的条件是
更新时间:2023-10-13 16:04:45
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】甲醇既是重要的化工原料,可用于制备甲醛、醋酸等产品,又可作为清洁燃料。利用CO2与H2合成甲醇涉及的主要反应如下:
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
Ⅱ.CO2(g) +H2(g) CO(g)+H2O(g) ΔH2=+41 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41 kJ·mol-1
回答下列问题:
(1)已知CO(g)+2H2(g) CH3OH(g) ΔH3=-99 kJ·mol-1,则ΔH1=
CH3OH(g) ΔH3=-99 kJ·mol-1,则ΔH1=___________ kJ·mol-1,反应I在___________ 下易自发进行。
(2)向刚性容器中充入一定量的CO2和H2,在不同催化剂(Cat1,Cat2)下反应相同时间,CO2的转化率和甲醇的选择性[甲醇的选择性= ×100%随温度的变化如图所示:
×100%随温度的变化如图所示:

①由图可知,催化效果:Cat1___________ Cat2(填“>” “<”或“=”)。
②在210~270℃间,CH3OH的选择性随温度的升高而下降,请写出一条可能原因:___________ 。
(3)一定条件下,向刚性容器中充入物质的量之比为1:3的CO2和H2发生上述反应I与II。
①有利于提高甲醇平衡产率的条件是___________ (填标号)。
A.高温高压 B.低温高压 C.高温低压 D.低温低压
②可证明反应II达到平衡状态的标志是___________ (填标号)。
A.CO的浓度不再变化 B.混合气体的密度不再变化 C.体系的压强不再变化
③若达到平衡时CO2的转化率为20% ,CH3OH的选择性为75%,反应II的压强平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
I.CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1Ⅱ.CO2(g) +H2(g)
 CO(g)+H2O(g) ΔH2=+41 kJ·mol-1
CO(g)+H2O(g) ΔH2=+41 kJ·mol-1回答下列问题:
(1)已知CO(g)+2H2(g)
 CH3OH(g) ΔH3=-99 kJ·mol-1,则ΔH1=
CH3OH(g) ΔH3=-99 kJ·mol-1,则ΔH1=(2)向刚性容器中充入一定量的CO2和H2,在不同催化剂(Cat1,Cat2)下反应相同时间,CO2的转化率和甲醇的选择性[甲醇的选择性=
 ×100%随温度的变化如图所示:
×100%随温度的变化如图所示:
①由图可知,催化效果:Cat1
②在210~270℃间,CH3OH的选择性随温度的升高而下降,请写出一条可能原因:
(3)一定条件下,向刚性容器中充入物质的量之比为1:3的CO2和H2发生上述反应I与II。
①有利于提高甲醇平衡产率的条件是
A.高温高压 B.低温高压 C.高温低压 D.低温低压
②可证明反应II达到平衡状态的标志是
A.CO的浓度不再变化 B.混合气体的密度不再变化 C.体系的压强不再变化
③若达到平衡时CO2的转化率为20% ,CH3OH的选择性为75%,反应II的压强平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】以 为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇:
为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇: 。
。
已知:
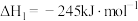
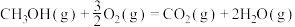
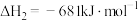
回答下列问题:
(1)计算上述合成甲醇反应的焓变
______  。
。
(2)科学研究中常用产物的时空收率(单位物质的量催化剂表面产物分子的平均生成速率)来衡量催化效果.在3 MPa, 时,不同Ni、Ga配比的Ni-Ga/
时,不同Ni、Ga配比的Ni-Ga/ 催化剂下,测定甲醇时空收率随温度的变化曲线如图所示.甲醇时空收率随温度变化先增大后减小的原因是
催化剂下,测定甲醇时空收率随温度的变化曲线如图所示.甲醇时空收率随温度变化先增大后减小的原因是______ 。催化剂的最佳配比和反应温度是______ 。 和
和 充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数
充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数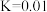 ,下列事实说明该反应已达平衡的是______。
,下列事实说明该反应已达平衡的是______。
(4)① 合成
合成 存在以下副反应:
存在以下副反应: 。5MPa,200℃时在1 L容器中投入1 mol
。5MPa,200℃时在1 L容器中投入1 mol  和3 mol
和3 mol  ,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率=
,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率=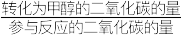 )。计算合成甲醇反应的化学平衡常数K(写出过程,结果列出计算表达式)
)。计算合成甲醇反应的化学平衡常数K(写出过程,结果列出计算表达式)________________________ 。
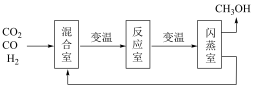
②已知200℃时有60%以上的原料未转化,为了提高转化率,设计如图流程分离甲醇和水,循环利用原料气。已知甲醇的沸点是64.7℃,根据信息判断反应室的温度______ 闪蒸室的温度(选填“<”、“=”或“>”).在原料气中通入CO的目的是________________________ 。
 为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇:
为原料在特定条件下可生产醇类、烷烃、碳酸酯等,实现二氧化碳资源化。科学家通过如下反应合成甲醇: 。
。已知:

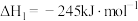
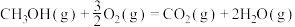
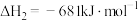
回答下列问题:
(1)计算上述合成甲醇反应的焓变

 。
。(2)科学研究中常用产物的时空收率(单位物质的量催化剂表面产物分子的平均生成速率)来衡量催化效果.在3 MPa,
 时,不同Ni、Ga配比的Ni-Ga/
时,不同Ni、Ga配比的Ni-Ga/ 催化剂下,测定甲醇时空收率随温度的变化曲线如图所示.甲醇时空收率随温度变化先增大后减小的原因是
催化剂下,测定甲醇时空收率随温度的变化曲线如图所示.甲醇时空收率随温度变化先增大后减小的原因是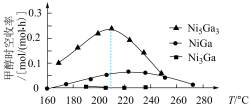
 和
和 充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数
充入恒温恒容密闭容器中反应合成甲醇,已知该温度下反应的化学平衡常数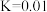 ,下列事实说明该反应已达平衡的是______。
,下列事实说明该反应已达平衡的是______。| A.气体密度保持不变 |
B. 与 与 的生成速率相等 的生成速率相等 |
C.某时刻容器中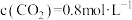 , ,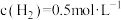 , , |
| D.混合气体的平均相对分子质量不变 |
 合成
合成 存在以下副反应:
存在以下副反应: 。5MPa,200℃时在1 L容器中投入1 mol
。5MPa,200℃时在1 L容器中投入1 mol  和3 mol
和3 mol  ,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率=
,达成平衡时,二氧化碳转化率为0.5,甲醇选择率为0.8(甲醇选择率=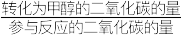 )。计算合成甲醇反应的化学平衡常数K(写出过程,结果列出计算表达式)
)。计算合成甲醇反应的化学平衡常数K(写出过程,结果列出计算表达式)②已知200℃时有60%以上的原料未转化,为了提高转化率,设计如图流程分离甲醇和水,循环利用原料气。已知甲醇的沸点是64.7℃,根据信息判断反应室的温度
您最近一年使用:0次
【推荐3】能源、材料、环保、健康等是当今社会重要的研究主题,化学与这些主题密切相关,在其研究与应用中发挥着重要作用。甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应I: CO2(g)+ 3H2(g)⇌CH3OH(g)+H2O(g) △H1=- 49.58kJ·mol-1
反应II: CO2(g)+H2(g)⇌CO(g)+ H2O(g) △H2=+41.19kJ·mol-1
反应III: CO(g)+ 2H2(g)⇌CH3OH(g) △H3
回答下列问题:
(1)反应III的△H3=_______ 。
(2)恒温,恒容密闭容器中,对于反应I,下列说法中不能说明该反应达到化学平衡状态的是_______。
(3)对于反应I,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法正确的是_______。

(4)若在2L密闭容器中充入3 mol H2和1 mol CO2发生反应I,250℃时反应的平衡常数K=____ (列出计算式)。
(5)甲醇燃料电池的工作原理如图所示,则Y电极为_______ (填“正极”或“负极”), X电极的电极反应式为_______ 。换膜若使用该电池完成铁制品镀银,当铁制品质量增加64.8g时,理论上消耗甲醇的质量为_______ g。

反应I: CO2(g)+ 3H2(g)⇌CH3OH(g)+H2O(g) △H1=- 49.58kJ·mol-1
反应II: CO2(g)+H2(g)⇌CO(g)+ H2O(g) △H2=+41.19kJ·mol-1
反应III: CO(g)+ 2H2(g)⇌CH3OH(g) △H3
回答下列问题:
(1)反应III的△H3=
(2)恒温,恒容密闭容器中,对于反应I,下列说法中不能说明该反应达到化学平衡状态的是_______。
| A.混合气体的密度不再变化 |
| B.混合气体的平均相对分子质量不再变化 |
| C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1。 |
| D.混合气体的压强不再变化 |

| A.其他条件不变,若不使用催化剂,则250°C时CO2的平衡转化率可能位于M1 |
| B.温度低于250°C时,随温度升高甲醇的产率增大 |
| C.M点时平衡常数比N点时平衡常数大 |
| D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率。 |
(5)甲醇燃料电池的工作原理如图所示,则Y电极为

您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐1】利用甲烷可以有效降低有害气体对大气的污染,成为当前科学研究的重点课题。
(1)利用CH4和CO2重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放。已知重整过程中涉及如下反应:
反应Ⅰ.
反应Ⅱ.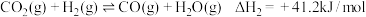
反应Ⅲ.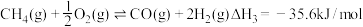
①已知: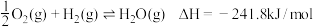 ,则△H1=
,则△H1=___________
②恒容密闭容器中CH4、CO2的分压分别为25kPa、20kPa,一定条件下发生反应Ⅰ。已知 ,某时刻测得
,某时刻测得 ,则该时刻
,则该时刻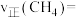
___________  。
。
(2)CH4(g)和H2S(g)反应可以生成化工原料CS2(g)和H2(g)。控制体系压强为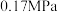 ,当原料初始组成n(CH4):n(H2S)=1:2,反应达到平衡时,四种组分的物质的量分数随温度的变化如图甲。
,当原料初始组成n(CH4):n(H2S)=1:2,反应达到平衡时,四种组分的物质的量分数随温度的变化如图甲。
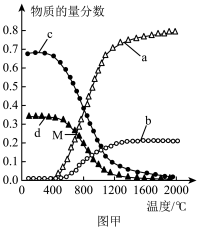
①图中表示CS2、CH4变化的曲线分别是_______ 、______ (填字母序号)。
②M点对应温度下,H2S的转化率是_____ ,反应的Kp=______  (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。
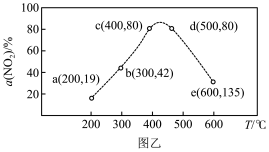
(3)在恒容密闭容器中,通入一定量CH4和NO2发生反应,相同时间内测得NO2的转化率与温度的关系如图乙。下列叙述正确的是___________。
(4)CH4燃料电池(NaOH溶液作电解质溶液)的正极反应式为___________ 。
(1)利用CH4和CO2重整不仅可以获得合成气(主要成分为CO、H2),还可减少温室气体的排放。已知重整过程中涉及如下反应:
反应Ⅰ.

反应Ⅱ.
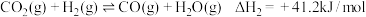
反应Ⅲ.
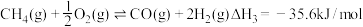
①已知:
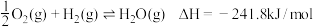 ,则△H1=
,则△H1=②恒容密闭容器中CH4、CO2的分压分别为25kPa、20kPa,一定条件下发生反应Ⅰ。已知
 ,某时刻测得
,某时刻测得 ,则该时刻
,则该时刻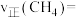
 。
。(2)CH4(g)和H2S(g)反应可以生成化工原料CS2(g)和H2(g)。控制体系压强为
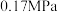 ,当原料初始组成n(CH4):n(H2S)=1:2,反应达到平衡时,四种组分的物质的量分数随温度的变化如图甲。
,当原料初始组成n(CH4):n(H2S)=1:2,反应达到平衡时,四种组分的物质的量分数随温度的变化如图甲。
①图中表示CS2、CH4变化的曲线分别是
②M点对应温度下,H2S的转化率是
 (以分压表示,分压=总压×物质的量分数)。
(以分压表示,分压=总压×物质的量分数)。(3)在恒容密闭容器中,通入一定量CH4和NO2发生反应,相同时间内测得NO2的转化率与温度的关系如图乙。下列叙述正确的是___________。

| A.200℃NO2的平衡转化率大于300℃NO2的平衡转化率 |
| B.b点的v(逆)大于e点的v(逆) |
| C.c点和d点均处于平衡状态 |
| D.适当升温或增大c(CH4)可提高C点时NO2的转化率和反应速率 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】环氧乙烷(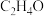 )被广泛地应用于洗涤、制药、印染等行业。工业上通常采用乙烯(
)被广泛地应用于洗涤、制药、印染等行业。工业上通常采用乙烯( )直接氧化法制取环氧乙烷,体系中发生的反应如下:
)直接氧化法制取环氧乙烷,体系中发生的反应如下:
主反应:


副反应: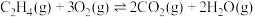

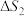
回答下列问题:
(1)已知几种化学键的键能如表所示:
试计算
___________ 。
(2)主反应与副反应的吉布斯自由能变( )与温度T的关系如图所示,则副反应的
)与温度T的关系如图所示,则副反应的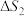
___________ (填“>”“<”或“=”)0,
___________ (填“>”“<”或“=”)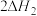 。
。

(3)在250℃、101kPa下,向某密闭容器中充入一定量的 和
和 ,同时发生上述两个反应,充分反应后,体系中含碳组分含量最高的是
,同时发生上述两个反应,充分反应后,体系中含碳组分含量最高的是 ,增大压强,
,增大压强, 的含量将
的含量将___________ (填“增大”“减小”或“不变”)。工业生产中常采用的反应条件为250℃、2.0MPa,并选择Ag作催化剂,充分反应后体系中含碳组分含量最高的是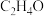 ,则Ag所起的作用可能为
,则Ag所起的作用可能为___________ 。
(4)一定条件下,用富氧空气(只含 和
和 ,且
,且 的体积分数为55%)代替
的体积分数为55%)代替 ,将
,将 、
、 、
、 按物质的量之比为11:11:1通入某恒容密闭容器中,发生上述两个反应,平衡时测得容器内总压为2.0MPa,
按物质的量之比为11:11:1通入某恒容密闭容器中,发生上述两个反应,平衡时测得容器内总压为2.0MPa, 的体积分数为31.25%,
的体积分数为31.25%,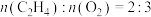 ,则
,则 和
和 的平衡转化率之比为
的平衡转化率之比为___________ ,该条件下主反应的压强平衡常数
___________  (
( 为用分压代替浓度的平衡常数,各组分分压=各组分物质的量分数×总压)。
为用分压代替浓度的平衡常数,各组分分压=各组分物质的量分数×总压)。
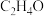 )被广泛地应用于洗涤、制药、印染等行业。工业上通常采用乙烯(
)被广泛地应用于洗涤、制药、印染等行业。工业上通常采用乙烯( )直接氧化法制取环氧乙烷,体系中发生的反应如下:
)直接氧化法制取环氧乙烷,体系中发生的反应如下:主反应:



副反应:
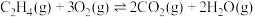

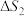
回答下列问题:
(1)已知几种化学键的键能如表所示:
| 化学键 | C-H | C=C | C-C | C-O | O=O |
键能 | 423 | 682 | 368 | 335 | 498 |

(2)主反应与副反应的吉布斯自由能变(
 )与温度T的关系如图所示,则副反应的
)与温度T的关系如图所示,则副反应的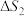

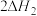 。
。
(3)在250℃、101kPa下,向某密闭容器中充入一定量的
 和
和 ,同时发生上述两个反应,充分反应后,体系中含碳组分含量最高的是
,同时发生上述两个反应,充分反应后,体系中含碳组分含量最高的是 ,增大压强,
,增大压强, 的含量将
的含量将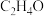 ,则Ag所起的作用可能为
,则Ag所起的作用可能为(4)一定条件下,用富氧空气(只含
 和
和 ,且
,且 的体积分数为55%)代替
的体积分数为55%)代替 ,将
,将 、
、 、
、 按物质的量之比为11:11:1通入某恒容密闭容器中,发生上述两个反应,平衡时测得容器内总压为2.0MPa,
按物质的量之比为11:11:1通入某恒容密闭容器中,发生上述两个反应,平衡时测得容器内总压为2.0MPa, 的体积分数为31.25%,
的体积分数为31.25%,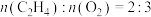 ,则
,则 和
和 的平衡转化率之比为
的平衡转化率之比为
 (
( 为用分压代替浓度的平衡常数,各组分分压=各组分物质的量分数×总压)。
为用分压代替浓度的平衡常数,各组分分压=各组分物质的量分数×总压)。
您最近一年使用:0次
【推荐3】中石化重庆涪陵建成我国的个国家级页岩气示范区,页岩气的主要成分为CH4.请回答下列问题:
(1)已知甲烷的燃烧热为890kJ/mol;N2与O2反应生成NO的过程如下:

则CH4(g)+4NO(g)=2N2(g)+ CO2(g)+2H2O(l) △H=______ kJ/mol。
(2) 页岩气可用于生产合成气(CO和H2) 其反应的热化学方程式为
CH4(g)+H2O(g) CO(g)+3H2(g) △H=206.2kJ/mol。
CO(g)+3H2(g) △H=206.2kJ/mol。
①对于气相反应,用各组分的平衡压强(p)表示平衡常教(记作Kp),则生产合成气的Kp=_____ ,你认为可同时提高化学反应速率和CH4转化率的措施是______ 或______ 。
②在某一给定进料比的情况下,温度、压强对平衡时H2物质的量分数的影响如图所示。
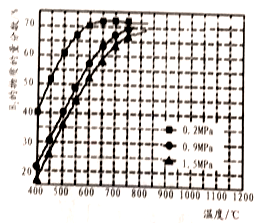
由图可知,在相同温度下,CH4的转化率随压强的增大而______ (填“增大”“减小”或“不变”),原因是_______________ 。若要达到H2的物质的量分数>65%,以下条件中最合适的是_____ (填序号)。
a.600℃,0.2MPa b.600℃,0.9MPa c.700℃,0.9 MPa d.800℃,1.5MPa
(1)已知甲烷的燃烧热为890kJ/mol;N2与O2反应生成NO的过程如下:

则CH4(g)+4NO(g)=2N2(g)+ CO2(g)+2H2O(l) △H=
(2) 页岩气可用于生产合成气(CO和H2) 其反应的热化学方程式为
CH4(g)+H2O(g)
 CO(g)+3H2(g) △H=206.2kJ/mol。
CO(g)+3H2(g) △H=206.2kJ/mol。①对于气相反应,用各组分的平衡压强(p)表示平衡常教(记作Kp),则生产合成气的Kp=
②在某一给定进料比的情况下,温度、压强对平衡时H2物质的量分数的影响如图所示。

由图可知,在相同温度下,CH4的转化率随压强的增大而
a.600℃,0.2MPa b.600℃,0.9MPa c.700℃,0.9 MPa d.800℃,1.5MPa
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】氢能是极具发展潜力的清洁能源,以氢燃料为代表的绿色燃料有良好的应用前景。回答下列问题:
(1)在载人航天器中,可以利用CO2与H2反应生成H2O,通过电解水,从而实现O2的再生。
①CO2(g)+4H2(g)=CH4(g)+2H2O(l) △H1=-252.9kJ•mol-1
②2H2O(l)=2H2(g)+O2(g) △H1=+534kJ•mol-1
甲烷与氧气反应生成二氧化碳和液态水的热化学方程式为________ 。
(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
I.CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
II.CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ•mol-1
CO2(g)+H2(g) △H=-41.2kJ•mol-1
①下列操作中,能提高反应I中CH4(g)平衡转化率的是________ (填标号)。
A.增加CH4(g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②在恒温恒压下,按水碳比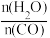 =12:5投料,总压强为1.70MPa,达到平衡时CO2、H2和CH4的分压(某成分分压=总压×该成分的物质的量分数)如表:
=12:5投料,总压强为1.70MPa,达到平衡时CO2、H2和CH4的分压(某成分分压=总压×该成分的物质的量分数)如表:
则反应II的平衡常数Kc=________ 。
(3)水煤气反应II需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。

①在催化剂活性温度范围内,图2中b~c段对应降温操作的过程,实现该过程的操作方法是________ 。
A.喷入冷水(蒸气) B.通过热交换器换热 C.按原水碳比通入冷的原料气
②若采用喷入冷水(蒸气)的方式降温,在图3中作出CO平衡转化率随温度变化的曲线________ 。
(1)在载人航天器中,可以利用CO2与H2反应生成H2O,通过电解水,从而实现O2的再生。
①CO2(g)+4H2(g)=CH4(g)+2H2O(l) △H1=-252.9kJ•mol-1
②2H2O(l)=2H2(g)+O2(g) △H1=+534kJ•mol-1
甲烷与氧气反应生成二氧化碳和液态水的热化学方程式为
(2)工业上常用甲烷水蒸气重整制备氢气,体系中发生如下反应。
I.CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)II.CO(g)+H2O(g)
 CO2(g)+H2(g) △H=-41.2kJ•mol-1
CO2(g)+H2(g) △H=-41.2kJ•mol-1①下列操作中,能提高反应I中CH4(g)平衡转化率的是
A.增加CH4(g)用量 B.恒温恒压下通入惰性气体
C.移除CO(g) D.加入催化剂
②在恒温恒压下,按水碳比
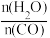 =12:5投料,总压强为1.70MPa,达到平衡时CO2、H2和CH4的分压(某成分分压=总压×该成分的物质的量分数)如表:
=12:5投料,总压强为1.70MPa,达到平衡时CO2、H2和CH4的分压(某成分分压=总压×该成分的物质的量分数)如表:| p(CO2)/MPa | 0.30 | p(H2)/MPa | 0.30 | p(CH4)/MPa | 0 |
(3)水煤气反应II需在多个催化剂反应层间进行降温操作以“去除”反应过程中的余热(如图1所示),保证反应在最适宜温度附近进行。

①在催化剂活性温度范围内,图2中b~c段对应降温操作的过程,实现该过程的操作方法是
A.喷入冷水(蒸气) B.通过热交换器换热 C.按原水碳比通入冷的原料气
②若采用喷入冷水(蒸气)的方式降温,在图3中作出CO平衡转化率随温度变化的曲线
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减少温室效应具有重要的意义。工业上CO2与CH4发生反应I:CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g) △H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
则△Hl =____ kJ/mol,反应Ⅰ在一定条件下能够自发进行的原因是____ ,该反应工业生产适宜的温度和压强为____ (填标号)。
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。

①923K时CO2的平衡转化率大于CH4的原因是________________________
②计算923K时反应II的化学平衡常数K=______ (计算结果保留小数点后两位)。
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是____ 。
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺入O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。

①随着O2进入量的增加,热负荷下降的原因是____ 。
②掺入O2可使CH4的平衡转化率____ (填“增大”、“减小”或“不变”。下同),CO2的平衡转化率________
在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g) △H2=+41kJ/mol
(l)已知部分化学键的键能数据如下表所示:
| 化学键 | C—H | H—H | C=O |  |
| 键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则△Hl =
A.高温高压 B.高温低压 C.低温高压 D.低温低压
(2)工业上将CH4与CO2按物质的量1:1投料制取CO2和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。

①923K时CO2的平衡转化率大于CH4的原因是
②计算923K时反应II的化学平衡常数K=
③1200K以上CO2和CH4的平衡转化率趋于相等的原因可能是
(3)工业上CH4和CO2反应时通常会掺入O2发生反应
III: CH4+2O2=CO2+2H2O,掺入O2可消除反应产生的积碳和减小反应器的热负荷(单位时间内维持反应发生所需供给的热量),O2的进气量与反应的热负荷的关系如图所示。

①随着O2进入量的增加,热负荷下降的原因是
②掺入O2可使CH4的平衡转化率
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】尿素是一种很好用的保湿成分,它存在于肌肤的角质层当中,属于肌肤天然保湿因子NMF的主要成分。工业上以氨气和二氧化碳为原料合成尿素,反应分为如下两步:
反应①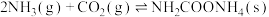
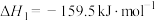
反应②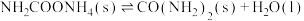

(1)下列反应与反应②的热效应相同的是___________。
(2)下图能表示上述两步反应能量变化的是___________。
(3)恒温恒容时,将2mol 和1mol
和1mol  充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时,
充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时, 的平均反应速率
的平均反应速率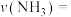
___________ (写出计算过程)。
(4)若将2mol 和1mol
和1mol  充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时,
充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时, 随时间变化如图所示:
随时间变化如图所示:
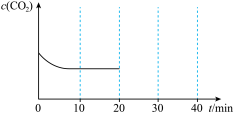
20min时压缩容器,使体积变为0.5V并保持不变,30min时达到新平衡,请在图中大致画出20min~40min内 随时间t变化的曲线
随时间t变化的曲线___________ 。
(5)实际生产中,为节约成本并提高反应②的生产效率,尿素合成工厂通常将反应②的发生场所设置在反应①的发生场所附近,请说明理由:___________ 。
反应①
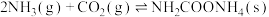
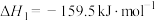
反应②
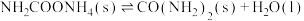

(1)下列反应与反应②的热效应相同的是___________。
| A.木炭与高温水蒸气反应 | B.镁条与稀盐酸反应 |
| C.小苏打与柠檬酸钠反应 | D.氢气与氯气反应 |
(2)下图能表示上述两步反应能量变化的是___________。
A.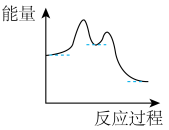 | B.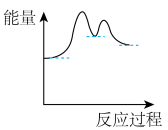 | C. | D.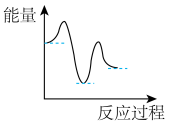 |
(3)恒温恒容时,将2mol
 和1mol
和1mol  充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时,
充入2L反应器中合成尿素,经10min测得反应器内气体压强变为起始的80%(已知此时尿素为固态。水为液态),则从反应开始至10min时, 的平均反应速率
的平均反应速率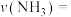
(4)若将2mol
 和1mol
和1mol  充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时,
充入一容积可变的容器中进行,初始体积固定为V,10min后达到平衡时, 随时间变化如图所示:
随时间变化如图所示:
20min时压缩容器,使体积变为0.5V并保持不变,30min时达到新平衡,请在图中大致画出20min~40min内
 随时间t变化的曲线
随时间t变化的曲线(5)实际生产中,为节约成本并提高反应②的生产效率,尿素合成工厂通常将反应②的发生场所设置在反应①的发生场所附近,请说明理由:
您最近一年使用:0次



