氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示:_____ 。
(2)关于这两种晶体的说法,正确的是______ 。(填序号)
a.立方相氮化硼含有 键和
键和 键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的 键均为共价键 d.两种晶体均为分子晶体
键均为共价键 d.两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为_______ ,其结构与石墨相似却不导电,原因是_______ 。
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为_____ 。该晶体的天然矿物在青藏高原地下约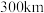 的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是
的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是_______ 。
(5)单质硼有无定形和晶体两种,参考下列数据:
①晶体硼的晶体类型属于________ 晶体。
②已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图所示),各正二十面体之间以 键相互联结,在每个正二十面体中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由
键相互联结,在每个正二十面体中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由______ 个硼原子构成,其中 键之间的键角是
键之间的键角是_____ 。

(2)关于这两种晶体的说法,正确的是
a.立方相氮化硼含有
 键和
键和 键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软
键,所以硬度大 b.六方相氮化硼层间作用力小,所以质地软c.两种晶体中的
 键均为共价键 d.两种晶体均为分子晶体
键均为共价键 d.两种晶体均为分子晶体(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为
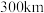 的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是
的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是(5)单质硼有无定形和晶体两种,参考下列数据:
| 晶体 | 金刚石 | 晶体硅 | 晶体硼 |
熔点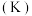 | 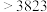 | 1683 | 2573 |
沸点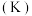 | 5100 | 2628 | 2823 |
硬度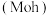 | 10 | 7.0 | 9.5 |
②已知晶体硼的基本结构单元是由硼原子组成的正二十面体(如图所示),各正二十面体之间以
 键相互联结,在每个正二十面体中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由
键相互联结,在每个正二十面体中有二十个等边三角形的面和一定数目的顶角,每个顶点各有一个硼原子。通过观察图形及推算,得出此基本结构单元是由 键之间的键角是
键之间的键角是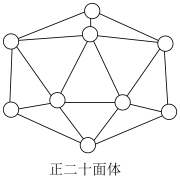
更新时间:2024-05-07 22:24:14
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】中国传统绘画颜料迄今已有七千多年的历史。古代艺术作品色彩艳丽,璀璨夺目,与所使用矿物颜料有很大关系。回答下列问题:
(1)石青,又名蓝矿石,化学式为Cu3(CO3)2(OH)2,基态Cu2+核外电子的空间运动状态有_______ 种。原子轨道中电子有两种相反的自旋状态,分别用+  和-
和- 表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为_______ 。 中C原子的杂化方式为
中C原子的杂化方式为_______ 。
(2)亚铁氰化钾,化学式为K4[Fe(CN)6],呈黄色结晶性粉末。[Fe(CN)6]4-中配体CN-的配位原子是_______ (填元素符号),[Fe(CN)6]4-中。σ键和π键的数目之比为_______ 。
(3)宜德时期青花瓷使用的颜料“苏勃泥青”是从一种钴矿[主要成分为(FeCo)x AsS]中提取出来的。无水CoCl2的熔点是735℃ ,沸点1049℃ ,CoCl2属于_______ 晶体;砷酸根离子( )的空间构型为
)的空间构型为_______ 。
(4)ZnS可用于制白色颜料等。ZnS的晶胞如图所示。
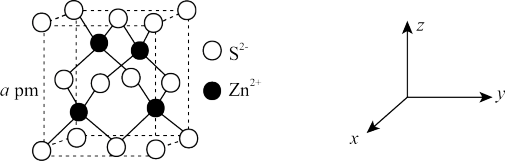
①图中S2-的坐标有(0,0,0)、(0, ,
, ),与(0,0,0)距离最近的S2-还有
),与(0,0,0)距离最近的S2-还有_______ (填坐标)。
②Zn2+占据_______ (填“八面体”或“四面体”)空隙,空隙利用率为_______ %。
③ZnS的密度为_______ g·cm-3(设NA为阿伏加德罗常数的值)。
(1)石青,又名蓝矿石,化学式为Cu3(CO3)2(OH)2,基态Cu2+核外电子的空间运动状态有
 和-
和- 表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则Cu2+中电子自旋磁量子数的代数和为 中C原子的杂化方式为
中C原子的杂化方式为(2)亚铁氰化钾,化学式为K4[Fe(CN)6],呈黄色结晶性粉末。[Fe(CN)6]4-中配体CN-的配位原子是
(3)宜德时期青花瓷使用的颜料“苏勃泥青”是从一种钴矿[主要成分为(FeCo)x AsS]中提取出来的。无水CoCl2的熔点是735℃ ,沸点1049℃ ,CoCl2属于
 )的空间构型为
)的空间构型为(4)ZnS可用于制白色颜料等。ZnS的晶胞如图所示。

①图中S2-的坐标有(0,0,0)、(0,
 ,
, ),与(0,0,0)距离最近的S2-还有
),与(0,0,0)距离最近的S2-还有②Zn2+占据
③ZnS的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】磷和砷的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)红磷是巨型共价分子,无定型结构,下列方法能证明红磷是非晶体的是_____ 。
A.质谱法 B.原子发射光谱法 C.核磁共振谱法 D.X射线衍射法
(2)基态As原子的核外电子排布式为_____ ,As原子的逐级电离能数据如下:
为什么第五电离能与第六电离能相差较大_____ 。
(3)黑磷是新型二维半导体材料,具有片层结构(如下图所示),P原子的杂化形式为_____ ,层与层之间的相互作用为_____ 。
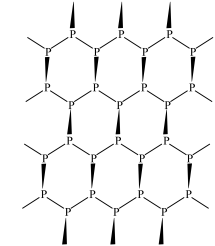
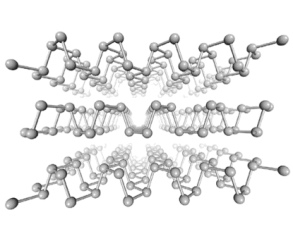
(4)GaAs的熔点为1238℃,且熔融状态不导电,其晶胞结构如下图所示,该晶体的类型为_____ ,每个As原子周围最近的As原子数目为_____ ,与同一个Ga原子距离最近的As原子构成的空间构型为_____ ,一个GaAs晶胞中配位键的数目为_____ 。
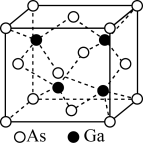
(5)已知GaAs的密度为dg/cm3,摩尔质量为Mg/mol,阿伏加 德罗常数用NA表示,则晶胞中最近的As和Ga原子核间距为_____ nm(列式表示)。
(1)红磷是巨型共价分子,无定型结构,下列方法能证明红磷是非晶体的是
A.质谱法 B.原子发射光谱法 C.核磁共振谱法 D.X射线衍射法
(2)基态As原子的核外电子排布式为
| 第一电离能 | 第二电离能 | 第三电离能 | 第四电离能 | 第五电离能 | 第六电离能 |
| 947.0 | 1798 | 2735 | 4837 | 6043 | 12310 |
为什么第五电离能与第六电离能相差较大
(3)黑磷是新型二维半导体材料,具有片层结构(如下图所示),P原子的杂化形式为


(4)GaAs的熔点为1238℃,且熔融状态不导电,其晶胞结构如下图所示,该晶体的类型为

(5)已知GaAs的密度为dg/cm3,摩尔质量为Mg/mol,阿伏加 德罗常数用NA表示,则晶胞中最近的As和Ga原子核间距为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A、C原子的L能层中都有两对未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对的电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号________ ,该能层具有的原子轨道数为_________ 。
(2)E2+离子的价层电子排布图是__________ ,F原子的电子排布式是__________ 。
(3)A元素的最高价氧化物对应的水化物中心原子采用的轨道杂化方式为______ ,B元素的气态氢化物的VSEPR模型为___________ 。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们的结构相似,DAB-的电子式为_____________
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为________________________
(6)某种化合物由D、E、F三种元素组成,其晶胞如图所示,其化学式为_____ 。
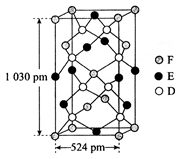
(1)基态D原子中,电子占据的最高能层符号
(2)E2+离子的价层电子排布图是
(3)A元素的最高价氧化物对应的水化物中心原子采用的轨道杂化方式为
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们的结构相似,DAB-的电子式为
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为
(6)某种化合物由D、E、F三种元素组成,其晶胞如图所示,其化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】B、N、Co均为新型材料的重要组成元素。请回答下列问题:
(1)基态Co原子核外电子占据_______ 种不同的能级,其中有_______ 个未成对电子。
(2)Co能形成 。
。
①1mol该离子中含有σ键的数目为_______ 。
②相同压强下,CO晶体的熔点高于 晶体的原因是
晶体的原因是_______ 。
(3)氟硼酸铵( )用作铝、铜和铝合金焊接助熔剂、镁铸件防氧化添加剂、阻燃剂、农用杀虫、杀菌剂、树脂黏结剂等。是合成氮化硼纳米管的原料之一。
)用作铝、铜和铝合金焊接助熔剂、镁铸件防氧化添加剂、阻燃剂、农用杀虫、杀菌剂、树脂黏结剂等。是合成氮化硼纳米管的原料之一。
①1mol 含有
含有_______ mol配位键。
②第一电离能大小介于B和N之间的基态原子第一电离能由大到小的顺序为_______ (用元素符号表示)。
③ 的空间立体构型为
的空间立体构型为_______ ,其中硼原子的杂化轨道类型为_______ 。
(1)基态Co原子核外电子占据
(2)Co能形成
 。
。①1mol该离子中含有σ键的数目为
②相同压强下,CO晶体的熔点高于
 晶体的原因是
晶体的原因是(3)氟硼酸铵(
 )用作铝、铜和铝合金焊接助熔剂、镁铸件防氧化添加剂、阻燃剂、农用杀虫、杀菌剂、树脂黏结剂等。是合成氮化硼纳米管的原料之一。
)用作铝、铜和铝合金焊接助熔剂、镁铸件防氧化添加剂、阻燃剂、农用杀虫、杀菌剂、树脂黏结剂等。是合成氮化硼纳米管的原料之一。①1mol
 含有
含有②第一电离能大小介于B和N之间的基态原子第一电离能由大到小的顺序为
③
 的空间立体构型为
的空间立体构型为
您最近一年使用:0次
【推荐2】回答下列问题:
(1)基态硫原子电子占据的最高能层符号为_______ ,核外有_______ 种能量不同的电子,硫原子核外电子有_______ 种空间运动状态。与S同主族的第4种元素的符号是_______ ,其价电子排布式为_______ 。
(2)已知有下列转化:
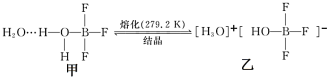
H3O+的VSEPR模型为_______ 。化学物乙中微粒间不存在的作用力有_______ (填序号)。
A.离子键 B.共价键 C.配位键 D.σ键 E.金属键
(3)向 CuSO4溶液中加入过量氨水可生成[Cu(NH3)4]2+,不考虑空间构型,该配离子的结构示意图为_______ 。1mol[Cu(NH3)4]2+中σ键的数目为_______ 。
(4)已知胆矾的结构式如下,则胆矾的化学式用配合物的形式表示为_______ 。

(1)基态硫原子电子占据的最高能层符号为
(2)已知有下列转化:

H3O+的VSEPR模型为
A.离子键 B.共价键 C.配位键 D.σ键 E.金属键
(3)向 CuSO4溶液中加入过量氨水可生成[Cu(NH3)4]2+,不考虑空间构型,该配离子的结构示意图为
(4)已知胆矾的结构式如下,则胆矾的化学式用配合物的形式表示为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】X、Y、Z、Q为短周期非金属元素,R是长周期元素。X原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍;Y的基态原子有7种不同运动状态的电子;Z元素在地壳中含量最多;Q是电负性最大的元素;R+只有三个电子层且完全充满电子。请回答下列问题:(答题时,X、Y、Z、Q、R用所对应的元素符号表示)
(1)R的基态原子的电子排布式为__________ 。
(2)X、Y、Z三种元素第一电离能从大到小顺序为____________ 。
(3)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键):
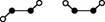
①该分子中两个Y原子之间的键型组合正确的是________ 。
A.仅1个σ键
B.1个σ键和2个π键
C.1个σ键和1个π键
D.仅2个σ键
②该分子中Y原子的杂化方式是______________ 。
(4)X与Y元素可以形成一种超硬新材料,其晶体部分结构如下图所示,有关该晶体的说法正确的是_______ 。

A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时共价键被破坏,没有克服范德华力和氢键
(1)R的基态原子的电子排布式为
(2)X、Y、Z三种元素第一电离能从大到小顺序为
(3)已知Y2Q2分子存在如下所示的两种结构(球棍模型,短线不一定代表单键):
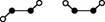
①该分子中两个Y原子之间的键型组合正确的是
A.仅1个σ键
B.1个σ键和2个π键
C.1个σ键和1个π键
D.仅2个σ键
②该分子中Y原子的杂化方式是
(4)X与Y元素可以形成一种超硬新材料,其晶体部分结构如下图所示,有关该晶体的说法正确的是

A.该晶体属于分子晶体
B.此晶体的硬度比金刚石还大
C.晶体的化学式是X3Y4
D.晶体熔化时共价键被破坏,没有克服范德华力和氢键
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】 、
、 、
、 均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ ,基态 、
、 、
、 原子的轨道中未成对电子数目最多的是
原子的轨道中未成对电子数目最多的是___________ (填元素符号)。
(2)一种 的配离子
的配离子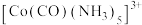 中,
中, 的配位数是
的配位数是___________ ,设 为阿伏加德罗常数的值,
为阿伏加德罗常数的值, 该配离子中所含
该配离子中所含 键的数目为
键的数目为___________ 。
(3)在 催化下,烯烃、炔烃、醛可与
催化下,烯烃、炔烃、醛可与 发生加成反应。如①
发生加成反应。如① ;②
;② ;③
;③ ;④
;④ 。其中碳原子采取
。其中碳原子采取 杂化的分子有
杂化的分子有___________ (填物质序号), 分子的空间构型为
分子的空间构型为___________ 。
(4)铁氰化钾 是检验
是检验 的重要试剂。
的重要试剂。
①铁氰化钾中,其组成元素的第一电离能由大到小的顺序为_____ (用元素符号表示)。
②铁氰化钾中,存在的化学键为_____ (填标号)。
A.离子键 B. 键 C.
键 C. 键 D.分子间作用力 E.金属键
键 D.分子间作用力 E.金属键
(5)一种 合金的立方晶胞如图所示,其沿x轴、y轴、z轴的投影完全相同。
合金的立方晶胞如图所示,其沿x轴、y轴、z轴的投影完全相同。
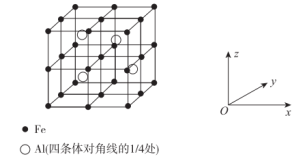
该合金的化学式可表示为_____ 。若此合金中最近的两个 原子核中心之间的距离为
原子核中心之间的距离为 ,则此合金的密度
,则此合金的密度
___________  (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 )
)
 、
、 、
、 均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。(1)基态
 原子的价电子排布式为
原子的价电子排布式为 、
、 、
、 原子的轨道中未成对电子数目最多的是
原子的轨道中未成对电子数目最多的是(2)一种
 的配离子
的配离子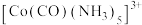 中,
中, 的配位数是
的配位数是 为阿伏加德罗常数的值,
为阿伏加德罗常数的值, 该配离子中所含
该配离子中所含 键的数目为
键的数目为(3)在
 催化下,烯烃、炔烃、醛可与
催化下,烯烃、炔烃、醛可与 发生加成反应。如①
发生加成反应。如① ;②
;② ;③
;③ ;④
;④ 。其中碳原子采取
。其中碳原子采取 杂化的分子有
杂化的分子有 分子的空间构型为
分子的空间构型为(4)铁氰化钾
 是检验
是检验 的重要试剂。
的重要试剂。①铁氰化钾中,其组成元素的第一电离能由大到小的顺序为
②铁氰化钾中,存在的化学键为
A.离子键 B.
 键 C.
键 C. 键 D.分子间作用力 E.金属键
键 D.分子间作用力 E.金属键(5)一种
 合金的立方晶胞如图所示,其沿x轴、y轴、z轴的投影完全相同。
合金的立方晶胞如图所示,其沿x轴、y轴、z轴的投影完全相同。
该合金的化学式可表示为
 原子核中心之间的距离为
原子核中心之间的距离为 ,则此合金的密度
,则此合金的密度
 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 )
)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】竺可桢是我国著名的气象学家、地理学家,由浙江大学饶灿教授课题组发现的一种组成为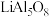 的新矿物被国际矿物学协会命名为“竺可桢石”。回答下列问题:
的新矿物被国际矿物学协会命名为“竺可桢石”。回答下列问题:
(1)基态铝原子核外电子排布式为___________  基态氧原子中自旋方向相反的两类电子数目相差
基态氧原子中自旋方向相反的两类电子数目相差___________  第二周期中第一电离能介于铍与氮元素之间的元素是
第二周期中第一电离能介于铍与氮元素之间的元素是___________ 。
(2) 的熔点为
的熔点为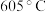 、沸点为
、沸点为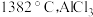 的熔点为
的熔点为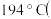 加压
加压 、沸点为
、沸点为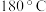 ,LiCl和
,LiCl和 熔点、沸点相差很多的主要原因是
熔点、沸点相差很多的主要原因是___________ 。
(3)氢化铝钠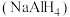 是有机合成中的强还原剂,
是有机合成中的强还原剂, 是一种新型储氢材料,
是一种新型储氢材料, 的空间构型是
的空间构型是___________ , 中铝原子的杂化轨道类型为
中铝原子的杂化轨道类型为___________ , 晶体中不存在的作用力类型是
晶体中不存在的作用力类型是___________  填字母
填字母 。
。
A.离子键 B.分子间作用力 C. 键 D.配位键
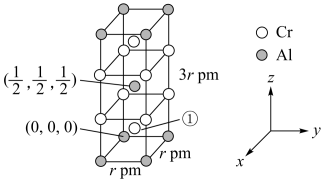
键 D.配位键
(4)铝与铬可形成如图所示的晶胞,则该合金的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可表示晶胞中各原子的位置,称为原子分数坐标。则 铬原子的原子分数坐标为
铬原子的原子分数坐标为___________ ,若该合金密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
___________ mol-1 用含
用含 、r的式子表示
、r的式子表示 。
。
 的新矿物被国际矿物学协会命名为“竺可桢石”。回答下列问题:
的新矿物被国际矿物学协会命名为“竺可桢石”。回答下列问题:(1)基态铝原子核外电子排布式为
 基态氧原子中自旋方向相反的两类电子数目相差
基态氧原子中自旋方向相反的两类电子数目相差 第二周期中第一电离能介于铍与氮元素之间的元素是
第二周期中第一电离能介于铍与氮元素之间的元素是(2)
 的熔点为
的熔点为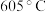 、沸点为
、沸点为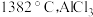 的熔点为
的熔点为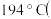 加压
加压 、沸点为
、沸点为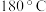 ,LiCl和
,LiCl和 熔点、沸点相差很多的主要原因是
熔点、沸点相差很多的主要原因是(3)氢化铝钠
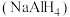 是有机合成中的强还原剂,
是有机合成中的强还原剂, 是一种新型储氢材料,
是一种新型储氢材料, 的空间构型是
的空间构型是 中铝原子的杂化轨道类型为
中铝原子的杂化轨道类型为 晶体中不存在的作用力类型是
晶体中不存在的作用力类型是 填字母
填字母 。
。A.离子键 B.分子间作用力 C.
 键 D.配位键
键 D.配位键(4)铝与铬可形成如图所示的晶胞,则该合金的化学式为
 铬原子的原子分数坐标为
铬原子的原子分数坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数
 用含
用含 、r的式子表示
、r的式子表示 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】回答下列问题:
(1)对具有下列价电子排布的Ni或As进行光谱实验,用光谱仪一定能摄取到原子发射光谱的是____ (填字母)。
(2)Fe成为阳离子时首先失去____ 轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为____ 。
(3)羟基磷灰石[Ca(PO4)3OH]是牙齿中的重要矿物质,其中羟基(—OH)中氧原子的杂化方式为___ ,PO 的空间构型为
的空间构型为____ ,该化合物所含元素电负性最大的是____ 。
(4)向胆矾溶液中滴加氨水至过量,最终得到深蓝色的透明溶液,再加入乙醇后析出深蓝色晶体,写出生成深蓝色透明溶液的离子方程式___ 。
(5)H2O与CH3CH2OH可以任意比例互溶,原因是____ 、____ (回答两点)。
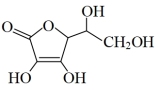
(6)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为____ ,分子中有____ 个手性碳原子。
(1)对具有下列价电子排布的Ni或As进行光谱实验,用光谱仪一定能摄取到原子发射光谱的是
| A.Ni:3d10 | B.As:4s24p 4p 4p 4p 4p |
C.As: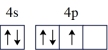 | D.Ni: |
(3)羟基磷灰石[Ca(PO4)3OH]是牙齿中的重要矿物质,其中羟基(—OH)中氧原子的杂化方式为
 的空间构型为
的空间构型为(4)向胆矾溶液中滴加氨水至过量,最终得到深蓝色的透明溶液,再加入乙醇后析出深蓝色晶体,写出生成深蓝色透明溶液的离子方程式
(5)H2O与CH3CH2OH可以任意比例互溶,原因是
(6)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】I.钠元素和氯元素是两种重要的短周期元素,按要求完成问题。
(1)下列说法错误的是___________(填序号)
(2)常温下氯化钠晶体是绝缘体,温度升高导电性增强,导电的原因是钠离子迁移到空位造成(如下图所示)。已知:常温常压下NaCl晶胞参数a=564pm,r(Na+)=102pm,r(Cl-)=181pm。
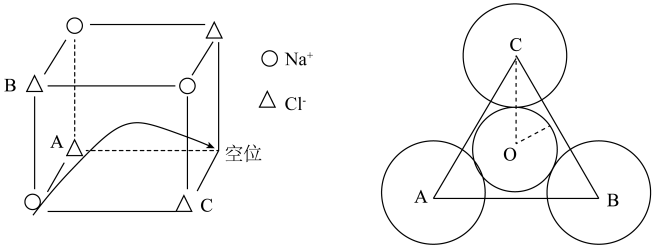
在氯化钠晶胞中钠离子的配位数为________ ,这些配位的氯离子形成的空间构型是_________ 。钠离子迁移时需穿过A、B、C3个氯离子形成的孔O,其平面位置关系如上图,孔O的半径___________ pm( =1.4,
=1.4, =1.7,结果取小数点后1位),试从半径大小的角度分析氯化钠晶体常温下是绝缘体的可能原因
=1.7,结果取小数点后1位),试从半径大小的角度分析氯化钠晶体常温下是绝缘体的可能原因___________ 。
II.
(3)一种晶体(属于立方晶系)中含有3种离子,其中A、B是阳离子,下图是这种晶体晶胞的中的八分之一,按要求回答问题。

若B是带有4个单位正电荷的阳离子,则A带的正电荷数是___________ ,若B在晶胞中的分数坐标是(0,0,0),则A的分数坐标是___________ ,A、B两种阳离子配位数之比为___________ ,晶胞参数为apm,O2-半径为bpm,两种阳离子均和O2-相切,B离子的半径为___________ pm。
(1)下列说法错误的是___________(填序号)
| A.第三周期元素中氯元素的第一电离能最大 |
| B.基态氯原子未成对电子数与基态钠原子相同 |
| C.短周期主族元素简单离子中钠离子的半径最大 |
| D.氯化钠的熔点高于溴化钠的熔点 |

在氯化钠晶胞中钠离子的配位数为
 =1.4,
=1.4, =1.7,结果取小数点后1位),试从半径大小的角度分析氯化钠晶体常温下是绝缘体的可能原因
=1.7,结果取小数点后1位),试从半径大小的角度分析氯化钠晶体常温下是绝缘体的可能原因II.
(3)一种晶体(属于立方晶系)中含有3种离子,其中A、B是阳离子,下图是这种晶体晶胞的中的八分之一,按要求回答问题。

若B是带有4个单位正电荷的阳离子,则A带的正电荷数是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】自然界存在丰富的碳、氮、硅、磷、铁等元素,它们可形成单质及许多化合物。按要求回答下列问题:
(1)铁能与CO形成配合物Fe(CO)5,其熔点为-20.50C,沸点为1020C,易溶于CCl4,据此判断Fe(CO)5晶体属于___________ (填晶体类型)。
(2)铁在元素周期表中位置是________________ ,亚铁离子具有强还原性,从电子排布的角度解释,其原因是______________________ 。
(3)南海海底蕴藏着大量的天然气水化合物,俗称“可燃冰”。可燃冰是一种晶体,晶体中平均每46个H2O分子通过氢键构成8个笼,每个笼内可容纳1个CH4分子或1个游离的H2O分子。若晶体中每8个笼有6个容纳了CH4分子,另外2个笼被游离的H2O分子填充。可燃冰的平均组成可表示为_______________ 。
(4)亚磷酸(H3PO3与过量NaOH反应充分反应生成亚磷酸氢二钠(Na2HPO3),则亚磷酸氢二钠属于_______ 盐(填“正”、“酸式”)。
(5)金刚石晶胞结构模型如右图,立方BN结构与金刚石相似,硬度与金刚石相当。在立方BN晶体中,B原子与N原子之间共价键与配位键的数目比为__________ ;每个N原子周围最近且等距离的N原子数为_______ ;如果阿伏加德罗常数近似取6×1023/mol,立方BN的密度为a g·cm-3,摩尔质量为b g·mol-1,计算晶体中最近的两个N原子间距离是__________ nm(用含a、b代数式表示)。

(1)铁能与CO形成配合物Fe(CO)5,其熔点为-20.50C,沸点为1020C,易溶于CCl4,据此判断Fe(CO)5晶体属于
(2)铁在元素周期表中位置是
(3)南海海底蕴藏着大量的天然气水化合物,俗称“可燃冰”。可燃冰是一种晶体,晶体中平均每46个H2O分子通过氢键构成8个笼,每个笼内可容纳1个CH4分子或1个游离的H2O分子。若晶体中每8个笼有6个容纳了CH4分子,另外2个笼被游离的H2O分子填充。可燃冰的平均组成可表示为
(4)亚磷酸(H3PO3与过量NaOH反应充分反应生成亚磷酸氢二钠(Na2HPO3),则亚磷酸氢二钠属于
(5)金刚石晶胞结构模型如右图,立方BN结构与金刚石相似,硬度与金刚石相当。在立方BN晶体中,B原子与N原子之间共价键与配位键的数目比为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
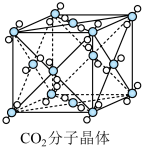
【推荐3】如图为干冰的晶胞结构:
(1)观察图形,确定在干冰中每个CO2分子周围有_______ 个与之紧邻且等距离的CO2分子,该结构单元平均占有_______ 个CO2分子。
(2)在干冰中撒入镁粉,用红热的铁棒引燃后,再盖上另一块干冰,出现的现象为_______ ,反应的化学方程式是_______ 。_______ CS2,填“>”或“<”),其原因是_______ 。
(4)在40GPa高压下,用激光器加热到1800K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是_______ 。
A.原子晶体干冰易升华,可用作制冷剂
B.原子晶体干冰有很高的熔点和沸点
C.原子晶体干冰的硬度小,不能用作耐磨材料
D.原子晶体干冰在一定条件下可与氢氧化钠反应
E.每摩尔原子晶体干冰中含有4molC—O键
(1)观察图形,确定在干冰中每个CO2分子周围有
(2)在干冰中撒入镁粉,用红热的铁棒引燃后,再盖上另一块干冰,出现的现象为
(4)在40GPa高压下,用激光器加热到1800K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是
A.原子晶体干冰易升华,可用作制冷剂
B.原子晶体干冰有很高的熔点和沸点
C.原子晶体干冰的硬度小,不能用作耐磨材料
D.原子晶体干冰在一定条件下可与氢氧化钠反应
E.每摩尔原子晶体干冰中含有4molC—O键
您最近一年使用:0次



