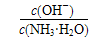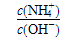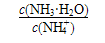在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示,下列判断正确的是

| A.冰醋酸不导电,所以冰醋酸不是电解质 |
B.A、B、 三点对应的溶液中, 三点对应的溶液中, 由小到大的顺序是 由小到大的顺序是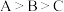 |
C.A、B、C三点对应的溶液中, 电离程度最大的B 电离程度最大的B |
D.若使B点对应的溶液中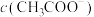 增大、 增大、 增大,可行的方法是加热 增大,可行的方法是加热 |
更新时间:2024-05-09 14:30:28
|
相似题推荐
单选题
|
适中
(0.65)
【推荐1】下列有关说法正确的是
| A.反应SiO2(s)+3C(s)=SiC+2CO(g)室温下不能自发进行,则该反应的△H<0 |
| B.铅蓄电池放电过程中,正极质量增加,负极质量减小 |
C.25℃下,在NH3·H2O稀溶液中,加水, 的值不变 的值不变 |
| D.在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-水解程度增大,pH增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】常温下,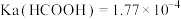 ,
, ,
,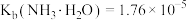 ,下列说法正确的是
,下列说法正确的是
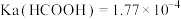 ,
, ,
,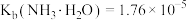 ,下列说法正确的是
,下列说法正确的是A.将 溶液从30℃降温至20℃, 溶液从30℃降温至20℃, 溶液中减小 溶液中减小 |
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和 溶液至终点,消耗NaOH溶液的体积相等 溶液至终点,消耗NaOH溶液的体积相等 |
C.向HCOOH稀溶液中滴加同浓度氨水至恰好反应,滴加过程中 与 与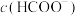 之和始终保持不变 之和始终保持不变 |
| D.向HCOOH稀溶液中滴加同浓度氨水至恰好反应,此过程中水的电离程度始终增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列说法中不正确的是( )
| A.浓度均为0.1 mol⋅L-1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) |
| B.pH相同的盐酸和硫酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH相等,则m>n |
| C.常温下,0.1 mol⋅L-1某一元酸HA在水中有0.1%发生电离,则该温度下HA的电离常数约为10-7 |
D.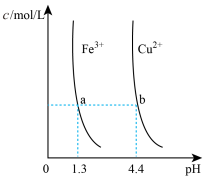 某温度下,Fe(OH)3,Cu(OH)2分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图。由图可知:Ksp[Fe(OH)3]<Ksp[Cu(OH)2] 某温度下,Fe(OH)3,Cu(OH)2分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图。由图可知:Ksp[Fe(OH)3]<Ksp[Cu(OH)2] |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法中,不正确的是
| A.室温下,HClO分子不可能存在于pH>7的溶液中 |
| B.在c(H+)=c(OH-)的溶液中,AlO2-不可能大量存在 |
| C.在NaAlO2溶液中,HCO3-不可能大量存在 |
| D.在水溶液中石炭酸比碳酸更难电离 |
您最近一年使用:0次