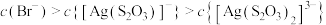t℃时,将一定浓度的 溶液分别滴加到一定浓度的KOH、
溶液分别滴加到一定浓度的KOH、 溶液中,所得沉淀的溶解平衡曲线如图所示。已知
溶液中,所得沉淀的溶解平衡曲线如图所示。已知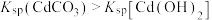 ,
,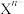 代表
代表 或
或 。下列说法错误的是
。下列说法错误的是
 溶液分别滴加到一定浓度的KOH、
溶液分别滴加到一定浓度的KOH、 溶液中,所得沉淀的溶解平衡曲线如图所示。已知
溶液中,所得沉淀的溶解平衡曲线如图所示。已知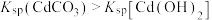 ,
,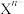 代表
代表 或
或 。下列说法错误的是
。下列说法错误的是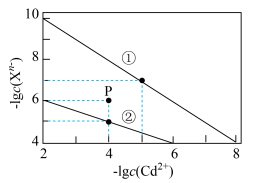
A.曲线②对应的沉淀是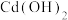 |
B.P点: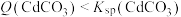 |
C.向浓度均为0.001 的KOH与 的KOH与 混合溶液中滴加 混合溶液中滴加 溶液,先析出 溶液,先析出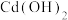 |
D.t℃时,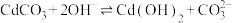 的K=100 的K=100 |
更新时间:2024-05-12 08:47:38
|
相似题推荐
多选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列说法正确的是
| A.在一定温度下的AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数 |
| B.AgCl的Ksp=1.8×10-10 mol2·L-2在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10 mol2·L-2 |
| C.温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp时,此溶液为AgCl的饱和溶液 |
| D.向饱和AgCl水溶液中充入HCl,AgCl(s)⇌Ag+(aq)+Cl-(aq)平衡逆向移动 |
您最近一年使用:0次
【推荐2】利用平衡移动原理,分析一定温度下Mg2+在不同pH的Na2CO3体系中的可能产物。
已知:ⅰ、图1中曲线表示Na2CO3体系中各含碳粒子的物质的量分数与pH的关系。
ⅱ、图2中曲线Ⅰ的离子浓度关系符合c(Mg2+)·c2(OH-)=Ksp[Mg(OH)2];曲线Ⅱ的离子浓度关系符合c(Mg2+)·c( )=Ksp(MgCO3);
)=Ksp(MgCO3);
[注:起始c(Na2CO3)=0.1mol·L−1,不同pH下c( )由图1得到]。
)由图1得到]。
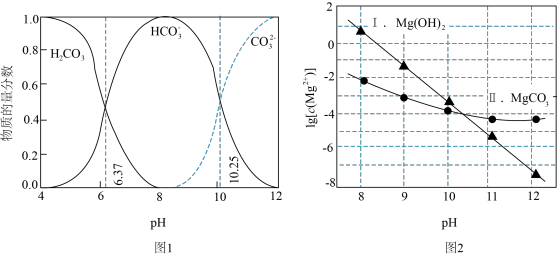
下列说法正确的是
已知:ⅰ、图1中曲线表示Na2CO3体系中各含碳粒子的物质的量分数与pH的关系。
ⅱ、图2中曲线Ⅰ的离子浓度关系符合c(Mg2+)·c2(OH-)=Ksp[Mg(OH)2];曲线Ⅱ的离子浓度关系符合c(Mg2+)·c(
 )=Ksp(MgCO3);
)=Ksp(MgCO3);[注:起始c(Na2CO3)=0.1mol·L−1,不同pH下c(
 )由图1得到]。
)由图1得到]。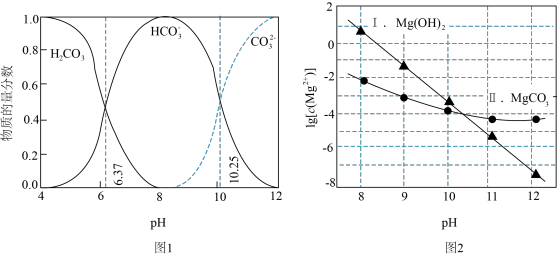
下列说法正确的是
A.由图1,pH=10.25,c( )=c( )=c( ) ) |
| B.由图2,初始状态pH=11、lg[c(Mg2+)]=-6,有沉淀生成 |
C.由图2,初始状态pH=9、lg[c(Mg2+)]=-2,平衡后溶液中存在:c(H2CO3)+c( )+c( )+c( )=0.1mol·L−1 )=0.1mol·L−1 |
D.由图1和图2,初始状态pH=8、lg[c(Mg2+)]=-1,发生反应:Mg2++2 =MgCO3↓+CO2↑+H2O =MgCO3↓+CO2↑+H2O |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
【推荐3】根据下列实验操作和现象所得到的结论不正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向苯酚浊液中加入Na2CO3溶液,溶液变澄清 | 酸性:苯酚>HCO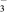 |
| B | 用pH计测定等浓度的Na2CO3和NaClO溶液的pH | 后者pH比前者的大 |
| C | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH<H2O |
| D | 在2 mL 0.01 mol·L-1的Na2S溶液中先滴入几滴0.01 mol·L-1 ZnSO4溶液有白色沉淀生成,再滴入0.01 mol·L-1 CuSO4溶液,又出现黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
多选题
|
适中
(0.65)
名校
解题方法
【推荐1】室温时下列有关说法正确的是
A.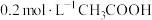 与 与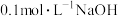 等体积混合后的溶液中: 等体积混合后的溶液中: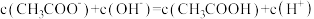 |
B.浓度均为 的 的 和 和 的混合溶液, 的混合溶液, 为10,则 为10,则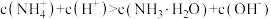 |
C.已知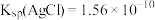 , ,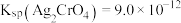 ,浓度均为 ,浓度均为 的 的 和 和 混合溶液中滴加 混合溶液中滴加 , , 先析出 先析出 |
D. 相同的① 相同的① 、② 、② 、③ 、③ 三种溶液,其中的 三种溶液,其中的 :②>①>③ :②>①>③ |
您最近一年使用:0次
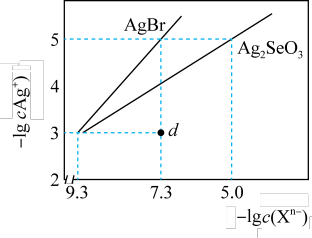
【推荐2】常温下,将AgNO3溶液分别滴加到浓度均为0.01 mol·L-1的NaBr、Na2SeO3溶液中,所得的沉淀溶解平衡曲线如图所示(Br-、SeO 用Xn-表示,不考虑SeO
用Xn-表示,不考虑SeO 的水解)。下列叙述正确的是
的水解)。下列叙述正确的是
 用Xn-表示,不考虑SeO
用Xn-表示,不考虑SeO 的水解)。下列叙述正确的是
的水解)。下列叙述正确的是
| A.Ksp(Ag2SeO3)的数量级为10-15 |
| B.d点对应的AgBr溶液为不饱和溶液 |
| C.若向0.01 mol·L-1NaCl溶液中滴加等浓度的AgNO3溶液,所得沉淀溶解平衡曲线在AgBr曲线上方 |
D.反应Ag2SeO3(s)+2Br-(aq)=2AgBr(s)+SeO (aq)的平衡常数K=1×109.6 (aq)的平衡常数K=1×109.6 |
您最近一年使用:0次

 溶液,发生反应
溶液,发生反应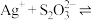
 和
和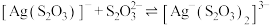 ,pM、pN与
,pM、pN与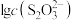 的关系如图所示。其中M代表
的关系如图所示。其中M代表 或
或 ,N代表
,N代表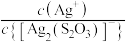 或
或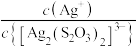 ,
,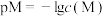 。下列说法错误的是
。下列说法错误的是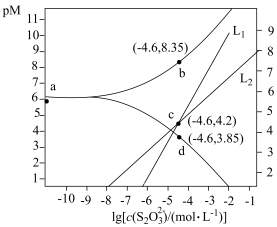
 表示
表示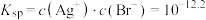
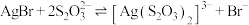 的平衡常数为
的平衡常数为
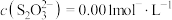 时,溶液中
时,溶液中