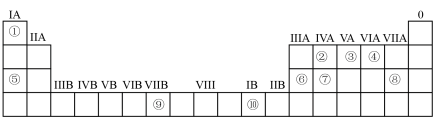
下表为元素周期表的一部分,请参照元素①—⑩在表中的位置,回答下列问题:___________ (用元素符号表示)。
(2)④、⑤、⑥的原子半径由大到小的顺序为___________ (用元素符号表示);
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是___________ (用化学式表示)。
(4)①、④、⑤、⑧中的某些 元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___________ 。
(5)第一电离能 :
: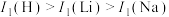 ,原因是
,原因是___________ 。
(6)基态⑧原子占据的最高能级的电子云轮廓图的形状是___________ 形;基态⑨原子的价层电子排布的轨道表示式为___________ ;元素⑩属于___________ 区(填“s”、“d”、“ds”或“p”)。
(7)由④元素形成的常见物质有很多,例如: 、
、 、
、 等,基态④原子的核外电子排布式是
等,基态④原子的核外电子排布式是___________ ,对 分子结构的研究,曾有以下推测:
分子结构的研究,曾有以下推测: 分子中
分子中___________ (填字母序号),确定其结构一定不是甲。
a. 键长 b.
键长 b. 键能 c.
键能 c. 键角
键角
(2)④、⑤、⑥的原子半径由大到小的顺序为
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(4)①、④、⑤、⑧中的
(5)第一电离能
 :
: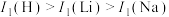 ,原因是
,原因是(6)基态⑧原子占据的最高能级的电子云轮廓图的形状是
(7)由④元素形成的常见物质有很多,例如:
 、
、 、
、 等,基态④原子的核外电子排布式是
等,基态④原子的核外电子排布式是 分子结构的研究,曾有以下推测:
分子结构的研究,曾有以下推测: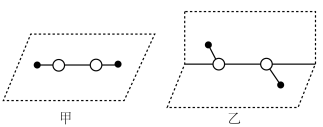
 分子中
分子中a.
 键长 b.
键长 b. 键能 c.
键能 c. 键角
键角
更新时间:2024-05-12 17:12:08
|
相似题推荐
填空题
|
容易
(0.94)
【推荐1】(1)表中的实线是元素周期表部分边界,请在表中用实线补全元素周期表边界________ 。
(2)元素甲是第三周期ⅥA族元素,请在方框中按氦元素的式样(如图)
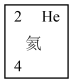
写出元素甲的原子序数、元素符号、元素名称、相对原子质量。
(3)元素乙的M层上有3个电子,则乙原子半径与甲原子半径比较:________ >________ (用元素符号表示),甲、乙的最高价氧化物水化物相互反应的离子方程式为:________
(4)元素周期表体现了元素周期律,即元素的性质随着_________ 的递增呈现____ 的变化。

(2)元素甲是第三周期ⅥA族元素,请在方框中按氦元素的式样(如图)

写出元素甲的原子序数、元素符号、元素名称、相对原子质量。
(3)元素乙的M层上有3个电子,则乙原子半径与甲原子半径比较:
(4)元素周期表体现了元素周期律,即元素的性质随着
您最近一年使用:0次
填空题
|
容易
(0.94)
解题方法
【推荐2】某研究小组对下列元素周期表(部分)进行研究,回答下列问题。
(1)钙元素位于周期表第___________ 期___________ 族。
(2)组成化合物最多的元素是___________ 。地壳中含量最多的金属元素是___________ 。
(3)原子半径最小的元素是___________ 。非金属性最强的元素是___________ 。
(4)锂、硫、硅三种单质中,适合作半导体材料的是___________ 。
(5)钠、镁、铝三种单质中,与冷水反应最剧烈的是___________ 。
(6) 和
和 中,酸性较强的是
中,酸性较强的是___________ 。
(7) 和
和 中,热稳定性较强的是
中,热稳定性较强的是___________ 。
(8)KOH和 中,碱性较弱的是
中,碱性较弱的是___________ 。
(9)原子核外电子排布中,最外层电子数是内层电子数3倍的元素是___________ 。
(10)能证明Cl元素比S元素非金属性更强的化学反应,其化学方程式为___________ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | H | ||||||
| 2 | Li | C | N | O | F | ||
| 3 | Na | Mg | Al | Si | S | Cl | |
| 4 | K | Ca |
(2)组成化合物最多的元素是
(3)原子半径最小的元素是
(4)锂、硫、硅三种单质中,适合作半导体材料的是
(5)钠、镁、铝三种单质中,与冷水反应最剧烈的是
(6)
 和
和 中,酸性较强的是
中,酸性较强的是(7)
 和
和 中,热稳定性较强的是
中,热稳定性较强的是(8)KOH和
 中,碱性较弱的是
中,碱性较弱的是(9)原子核外电子排布中,最外层电子数是内层电子数3倍的元素是
(10)能证明Cl元素比S元素非金属性更强的化学反应,其化学方程式为
您最近一年使用:0次
填空题
|
容易
(0.94)
【推荐3】下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题。
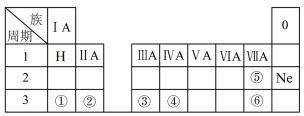
(1)元素⑤的符号是___________ 。
(2)③的最高价氧化物对应的水化物的化学式为___________ (填化学式)。
(3)④和⑥两种元素原子半径的大小关系:④___________ ⑥(填“>”或“<”)。
(4)①和②两种元素金属性强弱关系:①___________ ②(填“>”或“<”)。
(5)⑥的氢化物的电子式为___________ 。
(6)①的最高价氧化物对应的水化物与单质③的反应方程式:___________ 。

(1)元素⑤的符号是
(2)③的最高价氧化物对应的水化物的化学式为
(3)④和⑥两种元素原子半径的大小关系:④
(4)①和②两种元素金属性强弱关系:①
(5)⑥的氢化物的电子式为
(6)①的最高价氧化物对应的水化物与单质③的反应方程式:
您最近一年使用:0次
填空题
|
容易
(0.94)
解题方法
【推荐1】FeSO4•7H2O失水后可转为FeSO4•H2O,与FeS2可联合制备铁粉精(FexOy)和H2SO4。FeSO4•H2O结构如图所示。

(1)Fe2+价层电子排布式为_________ 。
(2)比较SO 和H2O分子中的键角大小并给出相应解释:
和H2O分子中的键角大小并给出相应解释:________ 。
(3)H2O与Fe2+、SO 和H2O的作用分别为
和H2O的作用分别为________ 。

(1)Fe2+价层电子排布式为
(2)比较SO
 和H2O分子中的键角大小并给出相应解释:
和H2O分子中的键角大小并给出相应解释:(3)H2O与Fe2+、SO
 和H2O的作用分别为
和H2O的作用分别为
您最近一年使用:0次
填空题
|
容易
(0.94)
【推荐2】Se在元素周期表中的位置是___________ 。基态Se原子的最外层电子排布式为___________ 。
您最近一年使用:0次
填空题
|
容易
(0.94)
解题方法
【推荐1】(1)写出与N同主族的As的基态原子的核外电子排布式:___________________ 从原子结构的角度分析B、N和O的第一电离能由大到小的顺序为_______________
(2)写出Fe2+的核外电子排布式:_____________________
(3)Zn2+的核外电子排布式为___________________
(2)写出Fe2+的核外电子排布式:
(3)Zn2+的核外电子排布式为
您最近一年使用:0次
填空题
|
容易
(0.94)
解题方法
【推荐2】尿素 分子中N、O元素的第一电离能:
分子中N、O元素的第一电离能: ,原因是
,原因是_______ 。
 分子中N、O元素的第一电离能:
分子中N、O元素的第一电离能: ,原因是
,原因是
您最近一年使用:0次
填空题
|
容易
(0.94)
解题方法
【推荐1】CaTiO3的组成元素的电负性大小顺序是___________ 。
您最近一年使用:0次
填空题
|
容易
(0.94)
【推荐2】电负性的意义:元素的电负性越大,其原子在化合物中吸引电子的能力_____ ;元素的电负性越小,其原子在化合物中吸引电子的能力_____ 。
您最近一年使用:0次


 、H2O、 HBr中,含有配位键的微粒有
、H2O、 HBr中,含有配位键的微粒有


