过渡元素在材料和化工生产中占有重要地位。
(1) 中的化学键具有明显的共价性,蒸气状态下以双聚分子存在(
中的化学键具有明显的共价性,蒸气状态下以双聚分子存在(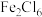 ),写出氯化铁双聚分子的结构式
),写出氯化铁双聚分子的结构式___________ 。
(2)元素Mn和Fe的部分电离能如下表所示,发现Mn元素的第三电离能( )要大于Fe元素的第三电离能,原因是
)要大于Fe元素的第三电离能,原因是___________ 。
(3)Mn的一种配合物化学式为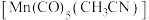 ,下列说法正确的是___________。
,下列说法正确的是___________。
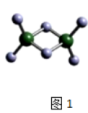
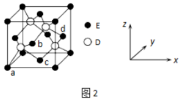
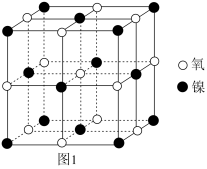
(4)某晶体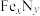 的晶胞如图1所示,Cu可以完全取代该晶体中a位置Fe或b位置Fe,
的晶胞如图1所示,Cu可以完全取代该晶体中a位置Fe或b位置Fe,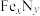 转化为两种Cu替代型产物的能量变化如图2所示。
转化为两种Cu替代型产物的能量变化如图2所示。___________ 。
②下列关于晶体的说法正确的是___________ 。
A.晶体的形成与晶体的自范性有关
B.测定某一固体是否属于晶体可以用X-射线衍射仪进行实验
C.晶体和非晶体的根本区别在于固体是否有规则的几何外形
D.由玻璃制成规则的玻璃球体现了晶体的自范性
E.晶胞是晶体结构中最小的重复单元
(1)
 中的化学键具有明显的共价性,蒸气状态下以双聚分子存在(
中的化学键具有明显的共价性,蒸气状态下以双聚分子存在(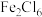 ),写出氯化铁双聚分子的结构式
),写出氯化铁双聚分子的结构式(2)元素Mn和Fe的部分电离能如下表所示,发现Mn元素的第三电离能(
 )要大于Fe元素的第三电离能,原因是
)要大于Fe元素的第三电离能,原因是| 元素 | Mn | Fe | |
| 电离能 (  ) ) |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 | |
(3)Mn的一种配合物化学式为
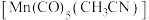 ,下列说法正确的是___________。
,下列说法正确的是___________。A. 与Mn原子配位时,提供孤电子对的是C原子 与Mn原子配位时,提供孤电子对的是C原子 |
| B.电负性:H<C<N<O |
C. 中两个C原子的杂化类型均为 中两个C原子的杂化类型均为 |
D. 中σ键与π键数目之比为5:2 中σ键与π键数目之比为5:2 |
(4)某晶体
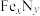 的晶胞如图1所示,Cu可以完全取代该晶体中a位置Fe或b位置Fe,
的晶胞如图1所示,Cu可以完全取代该晶体中a位置Fe或b位置Fe,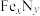 转化为两种Cu替代型产物的能量变化如图2所示。
转化为两种Cu替代型产物的能量变化如图2所示。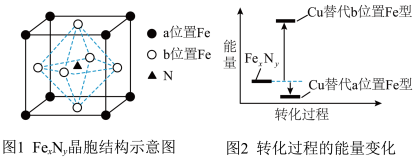
②下列关于晶体的说法正确的是
A.晶体的形成与晶体的自范性有关
B.测定某一固体是否属于晶体可以用X-射线衍射仪进行实验
C.晶体和非晶体的根本区别在于固体是否有规则的几何外形
D.由玻璃制成规则的玻璃球体现了晶体的自范性
E.晶胞是晶体结构中最小的重复单元
更新时间:2024-05-16 18:33:39
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜钢镓硒 (CIS中掺入
(CIS中掺入 )等化合物薄膜太阳能电池以及薄膜
)等化合物薄膜太阳能电池以及薄膜 系太阳能电池。
系太阳能电池。
(1)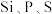 第一电离能由大到小的顺序是
第一电离能由大到小的顺序是___________ 。
(2) 和
和 键角较小的是
键角较小的是 ,原因是
,原因是___________ 。
(3) 晶体的堆积方式是
晶体的堆积方式是___________ (填堆积名称),其配位数为___________ ;往 的硫酸盐溶液中加入过量氨水,可得到晶体
的硫酸盐溶液中加入过量氨水,可得到晶体 ,下列说法正确的是
,下列说法正确的是___________ 。
A. 中所含的化学键有离子键、极性键和配位键
中所含的化学键有离子键、极性键和配位键
B.在 中
中 给出孤电子对,
给出孤电子对, 提供空轨道
提供空轨道
C. 组成元素中第一电离能最大的是氧元素
组成元素中第一电离能最大的是氧元素
D. 与
与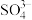 互为等电子体,空间构型均为正四面体形
互为等电子体,空间构型均为正四面体形
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸( )溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。
)溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。
① 中B的原子杂化类型为
中B的原子杂化类型为___________ 杂化。
②写出硼酸在水溶液中的电离方程式___________
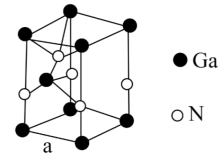
(5) 晶胞结构如图所示,已知六棱柱底边边长为acm。
晶胞结构如图所示,已知六棱柱底边边长为acm。
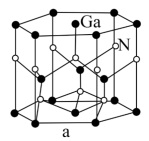
①晶胞中 原子采用六方最密堆积方式,每个
原子采用六方最密堆积方式,每个 原子周围距离最近的
原子周围距离最近的 原子数目为
原子数目为___________ ﹔
②从 晶体中分割出的平行六面体如图。若该平行六面体的体积为
晶体中分割出的平行六面体如图。若该平行六面体的体积为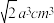 ,
, 晶体的密度为
晶体的密度为___________  (用a、
(用a、 表示)。
表示)。
 (CIS中掺入
(CIS中掺入 )等化合物薄膜太阳能电池以及薄膜
)等化合物薄膜太阳能电池以及薄膜 系太阳能电池。
系太阳能电池。(1)
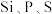 第一电离能由大到小的顺序是
第一电离能由大到小的顺序是(2)
 和
和 键角较小的是
键角较小的是 ,原因是
,原因是(3)
 晶体的堆积方式是
晶体的堆积方式是 的硫酸盐溶液中加入过量氨水,可得到晶体
的硫酸盐溶液中加入过量氨水,可得到晶体 ,下列说法正确的是
,下列说法正确的是A.
 中所含的化学键有离子键、极性键和配位键
中所含的化学键有离子键、极性键和配位键B.在
 中
中 给出孤电子对,
给出孤电子对, 提供空轨道
提供空轨道C.
 组成元素中第一电离能最大的是氧元素
组成元素中第一电离能最大的是氧元素D.
 与
与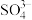 互为等电子体,空间构型均为正四面体形
互为等电子体,空间构型均为正四面体形(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(
 )溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。
)溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。①
 中B的原子杂化类型为
中B的原子杂化类型为②写出硼酸在水溶液中的电离方程式
(5)
 晶胞结构如图所示,已知六棱柱底边边长为acm。
晶胞结构如图所示,已知六棱柱底边边长为acm。
①晶胞中
 原子采用六方最密堆积方式,每个
原子采用六方最密堆积方式,每个 原子周围距离最近的
原子周围距离最近的 原子数目为
原子数目为②从
 晶体中分割出的平行六面体如图。若该平行六面体的体积为
晶体中分割出的平行六面体如图。若该平行六面体的体积为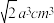 ,
, 晶体的密度为
晶体的密度为 (用a、
(用a、 表示)。
表示)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】镍铜合金由60%镍、33%铜、7%铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐蚀性高,耐磨性好,容易加工,可作为航空发动机的结构材料。
(1)铁元素在元素周期表中的位置为_______ ,基态镍原子的价电子排布式为_______ 。
(2)已知 、
、 属于离子晶体,则熔点
属于离子晶体,则熔点
_______  (填“<”或“>”),原因是
(填“<”或“>”),原因是_______ 。
(3) 与
与 的第二电离能较大的是
的第二电离能较大的是_______ ,主要原因是_______ 。
(4) 可与4-甲基咪唑(
可与4-甲基咪唑(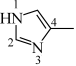 )形成配合物。4-甲基咪唑中,1号N原子的孤电子对因参与形成大
)形成配合物。4-甲基咪唑中,1号N原子的孤电子对因参与形成大 键,电子云密度降低。
键,电子云密度降低。
①4-甲基咪唑中,C原子的杂化轨道类型有_______ 。
②4-甲基咪唑中,_______ (填“1”或“3”)号N原子更容易与 形成配位键。
形成配位键。
(5)已知 的立方晶胞结构如图所示。
的立方晶胞结构如图所示。
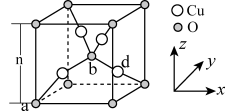
已知a、b的分数坐标依次为 、
、 ,则d的分数坐标为
,则d的分数坐标为_______ 。
(1)铁元素在元素周期表中的位置为
(2)已知
 、
、 属于离子晶体,则熔点
属于离子晶体,则熔点
 (填“<”或“>”),原因是
(填“<”或“>”),原因是(3)
 与
与 的第二电离能较大的是
的第二电离能较大的是(4)
 可与4-甲基咪唑(
可与4-甲基咪唑( )形成配合物。4-甲基咪唑中,1号N原子的孤电子对因参与形成大
)形成配合物。4-甲基咪唑中,1号N原子的孤电子对因参与形成大 键,电子云密度降低。
键,电子云密度降低。①4-甲基咪唑中,C原子的杂化轨道类型有
②4-甲基咪唑中,
 形成配位键。
形成配位键。(5)已知
 的立方晶胞结构如图所示。
的立方晶胞结构如图所示。
已知a、b的分数坐标依次为
 、
、 ,则d的分数坐标为
,则d的分数坐标为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】铁在人类物质文明的发展进程中起到重要的作用。回答下列问题:
(1)人体血液中含有铁元素,其存在形式的基态电子排布式为_______ 。
(2)FeCl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在,其中Fe采取的杂化类型为_______ ,固态FeCl3的晶体类型为_______ 。
(3)Fe能与CO形成配合物Fe(CO)5。该配合物分子中有_______ 个σ键和_______ 个π键,所含三种元素原子的第一电离能从大到小的顺序为:_______ ,CH4的键角比H2O大的原因是:_______ 。
(4)Fe3+离子和K4[Fe(CN)6]反应生成蓝色沉淀,被称为普鲁士蓝,普鲁士蓝颜色很深,原因是_______ ,其晶体部分结构如图所示(每两个立方体中,一个K+在其中一个立方体中心,另一个则无K+),Fe3+在晶体中的配位数是_______ ,已知图示立方体边长为a pm,则该晶体密度为_______ g·cm-3(写出表达式,用NA表示阿伏加德罗常数的值)。
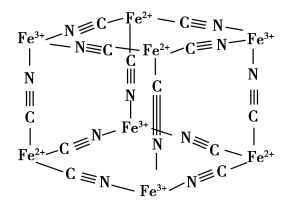
(1)人体血液中含有铁元素,其存在形式的基态电子排布式为
(2)FeCl3中的化学键具有明显的共价性,蒸气状态下以双聚分子存在,其中Fe采取的杂化类型为
(3)Fe能与CO形成配合物Fe(CO)5。该配合物分子中有
(4)Fe3+离子和K4[Fe(CN)6]反应生成蓝色沉淀,被称为普鲁士蓝,普鲁士蓝颜色很深,原因是

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】VCU研发的锂超离子导体Li3SBF4,提升了固态电解质导电性,其制备反应为LiBF4+Li2S=Li3SBF4。
回答下列问题:
(1)基态硫原子中核外电子有____ 种运动状态;组成锂超离子导体的四种元素中,电负性最大的元素的价层电子排布式为____ 。
(2)S的常见含氧酸有H2SO3和H2SO4,其中酸根离子呈三角锥形结构的酸是____ (填化学式),该分子的中心原子的价层电子对数是____ ;含F有机酸CF3COOH比CCl3COOH的酸性____ (填“强”或“弱”),原因为____ 。
(3)BF3与F-形成 时,二者形成的化学键为
时,二者形成的化学键为____ 键,提供电子对的原子为____ (填元素符号), 中B的杂化方式为
中B的杂化方式为____ 。
(4)另一种含锂电极材料LiFePO4的晶胞结构如图所示,晶胞参数分别为anm、bnm、cnm,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构,每个晶胞中含Fe和P的数目分别为___ 、___ ;设NA为阿伏加德罗常数的值,LiFePO4的密度ρ=___ g•cm-3(用含a、b、c、NA的代数式表示)。
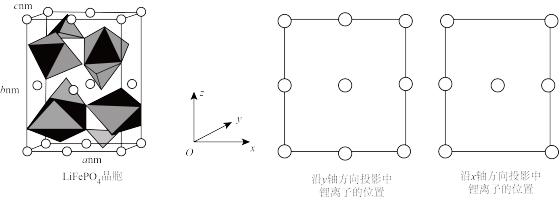
回答下列问题:
(1)基态硫原子中核外电子有
(2)S的常见含氧酸有H2SO3和H2SO4,其中酸根离子呈三角锥形结构的酸是
(3)BF3与F-形成
 时,二者形成的化学键为
时,二者形成的化学键为 中B的杂化方式为
中B的杂化方式为(4)另一种含锂电极材料LiFePO4的晶胞结构如图所示,晶胞参数分别为anm、bnm、cnm,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构,每个晶胞中含Fe和P的数目分别为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】铜、铁及其化合物在生产生活中有着广泛的应用。回答下列问题:
(1)基态铜原子的价层电子排布式为______ 。
(2)下列现代分析手段中,可用于检验水中痕量铜元素的是______ (填标号)。
A.原子光谱 B.质谱 C.红外光谱
(3)石青的化学式为Cu3(CO3)2(OH)2,其中CO 的空间构型为
的空间构型为______ 。
(4)已知NH3分子中H-N-H的键角为107.3°,则配合物[Cu(NH3)4]SO4中H-N-H的键角______ 107.3°(填“大于”“小于”“等于”)。
(5)含铜废液可以利用铜萃取剂M,通过如图反应实现铜离子的富集,进行回收。
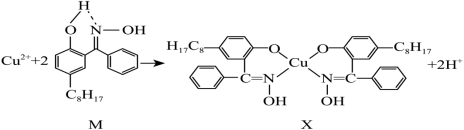
①M所含元素的第一电离能由大到小顺序是______ (用元素符号表示)。
②X化合物中中心原子铜的配位数是______ 。
(6)FeCl3与K4[Fe(CN)6]溶液混合生成Fe4[Fe(CN)6]3沉淀。配体CN-中C原子的杂化方式为______ ,CH2=CHCH2CN分子中σ键与π键的数目之比为_______ 。
(7)用邻二氮菲(phen,结构为 )与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
①[Fe(phen)3]2+中,存在的化学键有______ (填字母)。
a.配位键 b.离子键 c.π键 d.氢键
②用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因:______ 。
(1)基态铜原子的价层电子排布式为
(2)下列现代分析手段中,可用于检验水中痕量铜元素的是
A.原子光谱 B.质谱 C.红外光谱
(3)石青的化学式为Cu3(CO3)2(OH)2,其中CO
 的空间构型为
的空间构型为(4)已知NH3分子中H-N-H的键角为107.3°,则配合物[Cu(NH3)4]SO4中H-N-H的键角
(5)含铜废液可以利用铜萃取剂M,通过如图反应实现铜离子的富集,进行回收。

①M所含元素的第一电离能由大到小顺序是
②X化合物中中心原子铜的配位数是
(6)FeCl3与K4[Fe(CN)6]溶液混合生成Fe4[Fe(CN)6]3沉淀。配体CN-中C原子的杂化方式为
(7)用邻二氮菲(phen,结构为
 )与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。①[Fe(phen)3]2+中,存在的化学键有
a.配位键 b.离子键 c.π键 d.氢键
②用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因:
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】过渡金属元素铬(Cr)是不锈钢重要成分,在工农业生产和国防建设中有广泛应用。回答下列问题:
(1)对于基态Cr原子,下列叙述正确的是_______ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是_______ ,中心离子的配位数为_______ 。
(3) 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应键角如图所示。
的空间结构和相应键角如图所示。
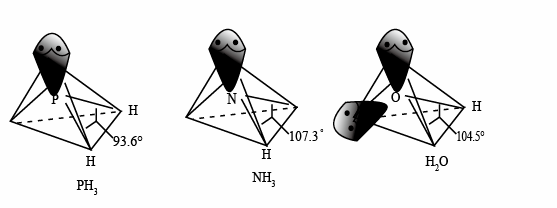
 中P的杂化类型是
中P的杂化类型是_______ 。 的沸点比
的沸点比 的
的_______ (填写“高”或“低”),原因是_______ , 的键角小于
的键角小于 的键角,分析原因
的键角,分析原因_______ 。
(4) 和NaClO均可作化工生产的氧化剂或氯化剂.制备
和NaClO均可作化工生产的氧化剂或氯化剂.制备 的反应为
的反应为 。
。
①上述描述中涉及的非金属元素电负性由大到小的顺序是_______ (用元素符号表示)。
②常温时 是一种易溶于
是一种易溶于 的液体,则
的液体,则 分子属于
分子属于_______ 分子。
③配合物 中心离子
中心离子 的配位数为6,向含
的配位数为6,向含 的溶液中滴加
的溶液中滴加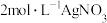 溶液,反应完全后共消耗
溶液,反应完全后共消耗 溶液50mL,则配合物的化学式应该写为
溶液50mL,则配合物的化学式应该写为_______ 。
(1)对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为

B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。
 中提供电子对形成配位键的原子是
中提供电子对形成配位键的原子是(3)
 中配体分子
中配体分子 、
、 以及分子
以及分子 的空间结构和相应键角如图所示。
的空间结构和相应键角如图所示。
 中P的杂化类型是
中P的杂化类型是 的沸点比
的沸点比 的
的 的键角小于
的键角小于 的键角,分析原因
的键角,分析原因(4)
 和NaClO均可作化工生产的氧化剂或氯化剂.制备
和NaClO均可作化工生产的氧化剂或氯化剂.制备 的反应为
的反应为 。
。①上述描述中涉及的非金属元素电负性由大到小的顺序是
②常温时
 是一种易溶于
是一种易溶于 的液体,则
的液体,则 分子属于
分子属于③配合物
 中心离子
中心离子 的配位数为6,向含
的配位数为6,向含 的溶液中滴加
的溶液中滴加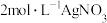 溶液,反应完全后共消耗
溶液,反应完全后共消耗 溶液50mL,则配合物的化学式应该写为
溶液50mL,则配合物的化学式应该写为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】(1)如图为一个金属铜的晶胞,请完成以下各题。
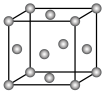
①该晶胞“实际”拥有的铜原子数是_________ 个。
②该晶胞称为________ (填序号)。
A 六方晶胞 B 体心立方晶胞 C 面心立方晶胞 D 简单立方晶胞
③此晶胞立方体的边长为 ,
, 的摩尔质量为
的摩尔质量为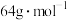 ,金属铜的密度为
,金属铜的密度为 ,则阿伏加 德罗常数为
,则阿伏加 德罗常数为________ (用a、 表示)
表示) 。
。
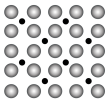
(2)洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,如图为氮原子在铁的品面上的单层附着局部示意图(图中小黑色球代表氮原子,大灰色球代表铁原子)。则在图示状况下,铁颗粒表面上 的原子数的比值为
的原子数的比值为____________ 。
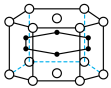
(3)硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。如图示意的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面各有一个镁原子,6个硼原子位于棱柱内,则该化合物的化学式可表示为_______ 。
(4)若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的微粒间的相互作用依次是_______ 。
A 氢键:分子间作用力:非极性键 B 氢键;分子间作用力:极性键
C 氢键;极性键;分子间作用力 D 分子间作用力;氢键:非极性键

①该晶胞“实际”拥有的铜原子数是
②该晶胞称为
A 六方晶胞 B 体心立方晶胞 C 面心立方晶胞 D 简单立方晶胞
③此晶胞立方体的边长为
 ,
, 的摩尔质量为
的摩尔质量为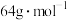 ,金属铜的密度为
,金属铜的密度为 ,则阿伏加 德罗常数为
,则阿伏加 德罗常数为 表示)
表示) 。
。(2)洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,如图为氮原子在铁的品面上的单层附着局部示意图(图中小黑色球代表氮原子,大灰色球代表铁原子)。则在图示状况下,铁颗粒表面上
 的原子数的比值为
的原子数的比值为
(3)硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。如图示意的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面各有一个镁原子,6个硼原子位于棱柱内,则该化合物的化学式可表示为

(4)若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的微粒间的相互作用依次是
A 氢键:分子间作用力:非极性键 B 氢键;分子间作用力:极性键
C 氢键;极性键;分子间作用力 D 分子间作用力;氢键:非极性键
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是_______ , 基态D原子价电子的轨道表达式为_______ , DA2分子的VSEPR模型是_______ 。
(2)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图1所示。
已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于_______ 晶体(填晶体类型),其中C原子的杂化轨道类型为_______ 杂化。
②[C(OH)4]-中存在的化学键有_______ 。
③C2Cl6与过量的NaOH溶液反应的化学方程式为_______ 。
(3)D与E所形成化合物晶体的晶胞如图2所示。
①在该晶胞中,E的配位数为_______ 。
②原子坐标参数可表示晶胞内部各原子的相对位置。图2晶胞中,原子坐标a为(0,0,0);b为( ,0,
,0, );c为(
);c为( ,
, ,0), 则d原子的坐标参数为
,0), 则d原子的坐标参数为_______ 。
③已知该晶胞的密度为 ρ g/cm3,则其中两个D原子之间的距离为_______ pm(列出计算式即可)
(1)B、C中第一电离能较大的是
(2)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图1所示。

已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
①C2Cl6属于
②[C(OH)4]-中存在的化学键有
③C2Cl6与过量的NaOH溶液反应的化学方程式为
(3)D与E所形成化合物晶体的晶胞如图2所示。
①在该晶胞中,E的配位数为
②原子坐标参数可表示晶胞内部各原子的相对位置。图2晶胞中,原子坐标a为(0,0,0);b为(
 ,0,
,0, );c为(
);c为( ,
, ,0), 则d原子的坐标参数为
,0), 则d原子的坐标参数为
③已知该晶胞的密度为 ρ g/cm3,则其中两个D原子之间的距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】依据物质结构与性质回答下列有关问题。
(1)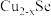 是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。
是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。

每个 晶胞中
晶胞中 个数为
个数为_______ (用x表示),1个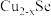 晶胞完全转化为
晶胞完全转化为 晶胞,转移电子数为
晶胞,转移电子数为_______ 。
(2)一些氧化物的熔点如表所示:
解释表中氧化物之间熔点显著差异的原因_______ .
(3)Pt的电子排布式为 ,则Pt在元素周期表中的位置是
,则Pt在元素周期表中的位置是_______ ,未成对电子数是_______ 。
(4) 常温下为液体,能与
常温下为液体,能与 、
、 等互溶,据此可判断
等互溶,据此可判断 是
是_______ (填“极性”或“非极性”)分子。
(5)图1为NiO晶胞,与 距离最近的
距离最近的 有
有_______ 个。一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为 作密置单层排列,
作密置单层排列, 填充其中(如图2),该“单分子层”面积密度为
填充其中(如图2),该“单分子层”面积密度为 ,则
,则 的半径为
的半径为_______ cm(用m、 表示)。
表示)。

(1)
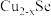 是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。
是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。
每个
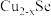 晶胞中
晶胞中 个数为
个数为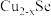 晶胞完全转化为
晶胞完全转化为 晶胞,转移电子数为
晶胞,转移电子数为(2)一些氧化物的熔点如表所示:
| 氧化物 |  | MgO | 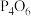 |  |
| 熔点/℃ | 1570 | 2800 | 23.8 | -75.5 |
(3)Pt的电子排布式为
 ,则Pt在元素周期表中的位置是
,则Pt在元素周期表中的位置是(4)
 常温下为液体,能与
常温下为液体,能与 、
、 等互溶,据此可判断
等互溶,据此可判断 是
是(5)图1为NiO晶胞,与
 距离最近的
距离最近的 有
有 作密置单层排列,
作密置单层排列, 填充其中(如图2),该“单分子层”面积密度为
填充其中(如图2),该“单分子层”面积密度为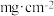 ,则
,则 的半径为
的半径为 表示)。
表示)。

您最近一年使用:0次



