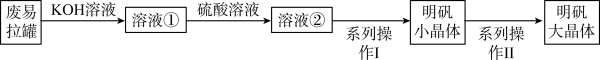
明矾[Ka1(SO4)2·12H2O]在工业上用作净水剂,医药上用作收敛剂。实验小组采用废弃的铝制易拉罐按如下流程制备明矾大晶体。
(1)废铝制易拉罐溶于KOH溶液发生的主要反应为_______ (用离子方程式表示)。
(2)下列说法不正确的是_______。
(3)“系列操作Ⅱ”的装置如图所示,烧杯上方所盖的纸片的作用是_______ 。
步骤①: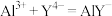
步骤②: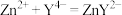
步骤③: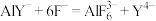
①NH4F溶液实验室_______ (填“能”或“不能”)盛装在玻璃细口瓶中。
②下列有关说法不正确的是_______ 。
A.天然水体样品中的Ca2+(CaY2-不与F-反应)不影响Al3+含量的测定
B.步骤①所加试剂EDTA,实验前不需要标定其浓度
C.如果步骤②所加Zn2+标准溶液偏少,会导致Al3+浓度的测定值小于真实值
③根据检测过程,请给出配合离子ZnY2-、AlY-、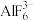 的稳定性由弱到强的顺序:
的稳定性由弱到强的顺序:_______ 。
④要准确计算水样中Al3+浓度,须利用水样1的体积以及步骤_______ 的实验数据(选填:①、②、③、④)
(1)废铝制易拉罐溶于KOH溶液发生的主要反应为
(2)下列说法不正确的是_______。
| A.可采取将废易拉罐剪碎、酒精灯加热等方式加快溶解速率 |
| B.加入KOH溶液至不再产生气泡后,趁热过滤,除去不溶物 |
| C.“系列操作Ⅰ”有:蒸发浓缩、冷却结晶、过滤、洗涤、灼烧 |
| D.制备明矾大晶体时,小晶体应悬挂在靠近烧杯底部的位置 |
(3)“系列操作Ⅱ”的装置如图所示,烧杯上方所盖的纸片的作用是


步骤①:
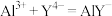
步骤②:
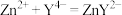
步骤③:
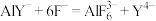
①NH4F溶液实验室
②下列有关说法不正确的是
A.天然水体样品中的Ca2+(CaY2-不与F-反应)不影响Al3+含量的测定
B.步骤①所加试剂EDTA,实验前不需要标定其浓度
C.如果步骤②所加Zn2+标准溶液偏少,会导致Al3+浓度的测定值小于真实值
③根据检测过程,请给出配合离子ZnY2-、AlY-、
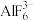 的稳定性由弱到强的顺序:
的稳定性由弱到强的顺序:④要准确计算水样中Al3+浓度,须利用水样1的体积以及步骤
更新时间:2024-05-24 12:48:37
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
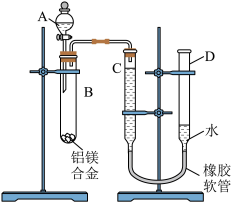
(1)A中试剂为NaOH溶液,实验前先检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;
②将B中剩余固体过滤,洗涤,干燥,称重;
③待B中不再有气体产生并恢复至室温后,记录C的液面位置;
④由A向B中滴加足量试剂。
上述操作的顺序是___________ (填序号);记录C的液面位置时,除平视外,还应___________ 。
(2)B中发生反应的化学方程式为___________ 。
(3)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将___________ (填“偏大”“偏小”或“不受影响”)。
(4)若实验用铝镁合金的质量为ag,测得氢气体积为bmL(已换算为标准状况),B中剩余固体的质量为cg,则铝的相对原子质量为___________ 。

(1)A中试剂为NaOH溶液,实验前先检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:
①记录C的液面位置;
②将B中剩余固体过滤,洗涤,干燥,称重;
③待B中不再有气体产生并恢复至室温后,记录C的液面位置;
④由A向B中滴加足量试剂。
上述操作的顺序是
(2)B中发生反应的化学方程式为
(3)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将
(4)若实验用铝镁合金的质量为ag,测得氢气体积为bmL(已换算为标准状况),B中剩余固体的质量为cg,则铝的相对原子质量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】铝镁合金已成为轮船制造、化工生产等行业的重要材料。某研究性学习小组的两位同学为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
Ⅰ.现需配制1mol/LNaOH溶液450mL,如图是某同学转移溶液的示意图,根据如图所示,

回答下列问题:
(1)①仪器c使用前必须___________ 。
②图中的错误是___________ 。
(2)根据计算得知,需用托盘天平称出NaOH的质量为___________ g。
(3)下列操作使配制的NaOH溶液浓度偏低的有___________。
Ⅱ.实验探究。
探究一:实验方案:铝镁合金 测定剩余固体质量。
测定剩余固体质量。
实验步骤:
(4)称取5.4 g铝镁合金粉末样品,投入体积为V、浓度为1.0 mol·L-1的NaOH溶液中,充分反应。为保证合金充分反应,NaOH溶液的体积V≥___________ 。
探究二:实验方案:铝镁合金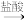 测定生成气体的体积(实验装置如图所示)。
测定生成气体的体积(实验装置如图所示)。

(5)某同学提出该实验装置不够完善,应在A、B之间添加一个除酸雾的装置。你的意见___________ (填“需要”或“不需要”)。
(6)为使测定结果尽可能精确,实验中应注意的问题:___________ 。
Ⅰ.现需配制1mol/LNaOH溶液450mL,如图是某同学转移溶液的示意图,根据如图所示,

回答下列问题:
(1)①仪器c使用前必须
②图中的错误是
(2)根据计算得知,需用托盘天平称出NaOH的质量为
(3)下列操作使配制的NaOH溶液浓度偏低的有___________。
| A.未冷却到室温就转移到容量瓶立即定容 |
| B.选用的容量瓶内有少量蒸馏水 |
| C.定容摇匀后,液面下降,又加水至刻度线 |
| D.定容时俯视刻度线 |
Ⅱ.实验探究。
探究一:实验方案:铝镁合金
 测定剩余固体质量。
测定剩余固体质量。实验步骤:
(4)称取5.4 g铝镁合金粉末样品,投入体积为V、浓度为1.0 mol·L-1的NaOH溶液中,充分反应。为保证合金充分反应,NaOH溶液的体积V≥
探究二:实验方案:铝镁合金
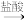 测定生成气体的体积(实验装置如图所示)。
测定生成气体的体积(实验装置如图所示)。
(5)某同学提出该实验装置不够完善,应在A、B之间添加一个除酸雾的装置。你的意见
(6)为使测定结果尽可能精确,实验中应注意的问题:
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐3】下表为元素周期表的一部分,用化学用语回答下列问题:

(1)写出⑤的最高价氧化物的水化物的电子式_______ 。
(2)⑥、⑦、⑧、③的简单离子的半径由大到小顺序为_______ 。(写离子符号)。
(3)用电子式表示④与⑨形成化合物的过程_______ 。
(4)元素③、⑤、⑧组成的化合物是84消毒液的主要成分,可以在碱性条件下处理CN-,将CN-氧化成 和N2,写出反应的离子方程式
和N2,写出反应的离子方程式_______ 。
(5)将⑤和⑥单质各1 mol投入足量水中,充分反应后,所得溶液体积为 ,则该过程可得标况下气体体积
,则该过程可得标况下气体体积_______ L。最终获得溶液的物质的量浓度为_______ mol/L。

(1)写出⑤的最高价氧化物的水化物的电子式
(2)⑥、⑦、⑧、③的简单离子的半径由大到小顺序为
(3)用电子式表示④与⑨形成化合物的过程
(4)元素③、⑤、⑧组成的化合物是84消毒液的主要成分,可以在碱性条件下处理CN-,将CN-氧化成
 和N2,写出反应的离子方程式
和N2,写出反应的离子方程式(5)将⑤和⑥单质各1 mol投入足量水中,充分反应后,所得溶液体积为
 ,则该过程可得标况下气体体积
,则该过程可得标况下气体体积
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】碘化钠可用于医学和摄影.实验室制备 的基本实验步骤为①检查装置气密性;②关闭K,向B中滴入
的基本实验步骤为①检查装置气密性;②关闭K,向B中滴入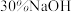 溶液,制得
溶液,制得 ;③打开K,通入
;③打开K,通入 至饱和制得
至饱和制得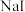 ,同时有黄色沉淀产生;④关闭K,向所得溶液中加入稀硫酸,水浴加热,充分逸出
,同时有黄色沉淀产生;④关闭K,向所得溶液中加入稀硫酸,水浴加热,充分逸出 ;
;
⑤把B中的混合液倒入烧杯,加入足量碳酸钡除去稀硫酸再经过一系列操作得到 成品.
成品.
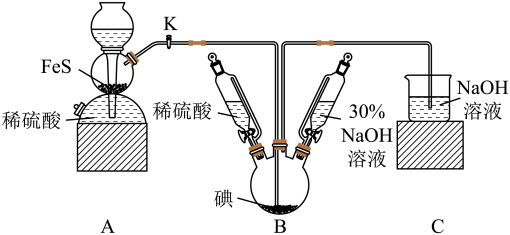
回答下列问题:
(1)盛稀硫酸和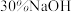 溶液的仪器,若换成分液漏斗,其缺点是
溶液的仪器,若换成分液漏斗,其缺点是_________ .
(2)A装置中发生反应的离子方程式为________ ,C装置的作用为_________ .
(3)步骤②可观察到的现象是_________ .
(4)制得 的离子方程式为
的离子方程式为_________ .通入 至饱和,与
至饱和,与 反应制得
反应制得 的离子方程式为
的离子方程式为________ .
(5)步骤⑤中的“一系列操作”包括过滤、洗涤、合并滤液和洗涤液、________ 等操作.
(6)三颈烧瓶加入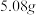 碘单质,若期望反应的产率为88%则最终得到产品的质量为
碘单质,若期望反应的产率为88%则最终得到产品的质量为______ .
 的基本实验步骤为①检查装置气密性;②关闭K,向B中滴入
的基本实验步骤为①检查装置气密性;②关闭K,向B中滴入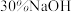 溶液,制得
溶液,制得 ;③打开K,通入
;③打开K,通入 至饱和制得
至饱和制得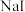 ,同时有黄色沉淀产生;④关闭K,向所得溶液中加入稀硫酸,水浴加热,充分逸出
,同时有黄色沉淀产生;④关闭K,向所得溶液中加入稀硫酸,水浴加热,充分逸出 ;
;⑤把B中的混合液倒入烧杯,加入足量碳酸钡除去稀硫酸再经过一系列操作得到
 成品.
成品.
回答下列问题:
(1)盛稀硫酸和
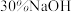 溶液的仪器,若换成分液漏斗,其缺点是
溶液的仪器,若换成分液漏斗,其缺点是(2)A装置中发生反应的离子方程式为
(3)步骤②可观察到的现象是
(4)制得
 的离子方程式为
的离子方程式为 至饱和,与
至饱和,与 反应制得
反应制得 的离子方程式为
的离子方程式为(5)步骤⑤中的“一系列操作”包括过滤、洗涤、合并滤液和洗涤液、
(6)三颈烧瓶加入
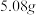 碘单质,若期望反应的产率为88%则最终得到产品的质量为
碘单质,若期望反应的产率为88%则最终得到产品的质量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】铜转炉烟灰主要含有 [还有少量的
[还有少量的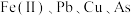 等元素]的硫酸盐和氧化物,少量为砷酸盐。制备重要化工原料活性氧化锌的工艺流程如图所示。请回答以下问题:
等元素]的硫酸盐和氧化物,少量为砷酸盐。制备重要化工原料活性氧化锌的工艺流程如图所示。请回答以下问题:

已知:活性炭净化主要是除去有机杂质。
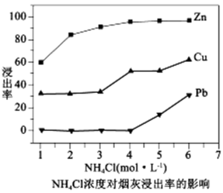
(1)反应温度为50℃,反应时间为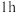 时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,则氯化铵适宜的浓度为
时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,则氯化铵适宜的浓度为______  。浸出液中锌元素以
。浸出液中锌元素以______ 形式存在(填离子符号)。
(2) 溶液的作用是
溶液的作用是______ ,“滤渣II”的成分为______ (填化学式)。
(3)除杂3是置换除杂过程,试剂a是______ (填化学式)。
(4)写出“沉锌”时发生反应的离子方程式______ 。
(5)取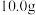 活性氧化锌样品配成待测液,加入3、4滴指示剂,再加入适量六亚甲基四胺,用
活性氧化锌样品配成待测液,加入3、4滴指示剂,再加入适量六亚甲基四胺,用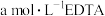 标准液进行滴定,消耗标准液
标准液进行滴定,消耗标准液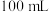 。已知:与
。已知:与 标准液
标准液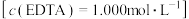 相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为
相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为______ (用含a的代数式表示)。
 [还有少量的
[还有少量的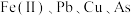 等元素]的硫酸盐和氧化物,少量为砷酸盐。制备重要化工原料活性氧化锌的工艺流程如图所示。请回答以下问题:
等元素]的硫酸盐和氧化物,少量为砷酸盐。制备重要化工原料活性氧化锌的工艺流程如图所示。请回答以下问题:
已知:活性炭净化主要是除去有机杂质。
(1)反应温度为50℃,反应时间为
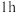 时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,则氯化铵适宜的浓度为
时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,则氯化铵适宜的浓度为 。浸出液中锌元素以
。浸出液中锌元素以
(2)
 溶液的作用是
溶液的作用是(3)除杂3是置换除杂过程,试剂a是
(4)写出“沉锌”时发生反应的离子方程式
(5)取
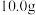 活性氧化锌样品配成待测液,加入3、4滴指示剂,再加入适量六亚甲基四胺,用
活性氧化锌样品配成待测液,加入3、4滴指示剂,再加入适量六亚甲基四胺,用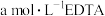 标准液进行滴定,消耗标准液
标准液进行滴定,消耗标准液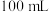 。已知:与
。已知:与 标准液
标准液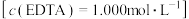 相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为
相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】“侯氏制碱法”是我国化工专家侯德榜为世界制碱工业作出的突出贡献。模拟“侯氏制碱法”以粗盐水为原料制备纯碱的流程如图所示。
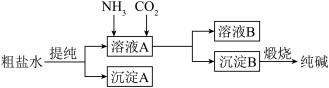
回答下列问题:
(1)粗盐水中含有 杂质,提纯过程应加试剂为
杂质,提纯过程应加试剂为___________ ;沉淀A___________ 电解质(填“是”或“不是”)。
(2)向溶液A中先通入___________ 至饱和(填“ ”或“
”或“ ”,下同),再向溶液中通入
”,下同),再向溶液中通入___________ ,此时观察到溶液中有晶体析出,该反应的化学方程式为___________ 。
(3)溶液B中主要溶质的电离方程式为___________ 。
(4)此流程中可以循环利用的物质是___________ 。

回答下列问题:
(1)粗盐水中含有
 杂质,提纯过程应加试剂为
杂质,提纯过程应加试剂为(2)向溶液A中先通入
 ”或“
”或“ ”,下同),再向溶液中通入
”,下同),再向溶液中通入(3)溶液B中主要溶质的电离方程式为
(4)此流程中可以循环利用的物质是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】氯化铍(BeCl2)是一种无色针状或板状晶体,易潮解,易升华。已知氯气、碳和氧化铍高温条件下反应生成氯化铍和一氧化碳,某实验小组利用下图所示装置制备 。请回答下列问题:
。请回答下列问题:

已知:①铍和铝在元素周期表中处于对角线位置,其单质及化合物的结构与性质具有相似性。
② 熔融可离子化。
熔融可离子化。
(1)装置A中仪器X的名称是___________ ,装置C中的试剂M为___________ (填名称)。
(2)按气流从左到右的方向,上述装置的合理连接顺序为___________ (填仪器接口的小写字母,装置可重复使用),装置A中反应的离子方程式为___________ 。
(3)装置E中反应的化学方程式为___________ ,两仪器连接处使用粗导气管,而不用细导气管的原因是___________ 。
(4)装置B的作用是___________ 。
(5)工业上电解 熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应式为
熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应式为___________ 。
 。请回答下列问题:
。请回答下列问题:
已知:①铍和铝在元素周期表中处于对角线位置,其单质及化合物的结构与性质具有相似性。
②
 熔融可离子化。
熔融可离子化。(1)装置A中仪器X的名称是
(2)按气流从左到右的方向,上述装置的合理连接顺序为
(3)装置E中反应的化学方程式为
(4)装置B的作用是
(5)工业上电解
 熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应式为
熔融混合物制备金属铍,可选用镍坩埚作电解槽的阴极材料,电解时阴极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】氮化铬(CrN,黑色粉末)具有优异的力学性能、高温稳定性和耐腐蚀性,在航空航天领域有重要应用。实验室用氨气和无水 (紫色晶体,易潮解)制取CrN的装置如下图所示(夹持仪器略)。
(紫色晶体,易潮解)制取CrN的装置如下图所示(夹持仪器略)。____________ 。
(2)试剂m的名称是______ ,仪器b的名称是______ 。
(3)检查A装置气密性的操作为:将A装置右侧导管连接到盛水的水槽中,____________ ,则气密性良好。
(4)装置E的主要作用是____________ ;制取CrN的反应是非氧化还原反应,则反应过程中D中玻璃管内(小瓷舟外)产生的现象是____________ 。
(5)在制得的CrN中含有少量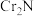 杂质,写出反应生成
杂质,写出反应生成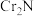 的化学方程式
的化学方程式____________ 。
(6)取样品(只含有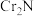 杂质)38.9g在空气中充分加热,得固体残渣(
杂质)38.9g在空气中充分加热,得固体残渣( )的质量为45.6g,则样品中CrN的质量分数为
)的质量为45.6g,则样品中CrN的质量分数为______ %(保留一位小数)。
 (紫色晶体,易潮解)制取CrN的装置如下图所示(夹持仪器略)。
(紫色晶体,易潮解)制取CrN的装置如下图所示(夹持仪器略)。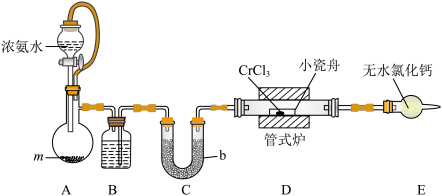
(2)试剂m的名称是
(3)检查A装置气密性的操作为:将A装置右侧导管连接到盛水的水槽中,
(4)装置E的主要作用是
(5)在制得的CrN中含有少量
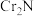 杂质,写出反应生成
杂质,写出反应生成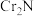 的化学方程式
的化学方程式(6)取样品(只含有
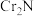 杂质)38.9g在空气中充分加热,得固体残渣(
杂质)38.9g在空气中充分加热,得固体残渣( )的质量为45.6g,则样品中CrN的质量分数为
)的质量为45.6g,则样品中CrN的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】绿矾(FeSO4•7H2O)是一种重要的食品和饲料添加剂。在实验室里可以通过下列流程用废铁屑制备绿矾,完成下列填空:

(1)试剂a是_____________ (填写化学式);
(2)酸溶时发生的主要反应的化学方程式为____________________________ ;
(3)上述过程中的过滤操作所用的主要玻璃仪器有玻璃棒、__________ 、烧杯。
(4)利用下图装置对所获产品(FeSO4•nH2O)中结晶水的含量进行测定。

反应前称量C中的硬质玻璃管(80g)、装入晶体后的硬质玻璃管(93g)、D的质量(78g)。反应后称得C中硬质玻璃管的质量为87.6g,D的质量为87g。产品硫酸亚铁晶体(FeSO4•nH2O)中n=_________ 。

(1)试剂a是
(2)酸溶时发生的主要反应的化学方程式为
(3)上述过程中的过滤操作所用的主要玻璃仪器有玻璃棒、
(4)利用下图装置对所获产品(FeSO4•nH2O)中结晶水的含量进行测定。

反应前称量C中的硬质玻璃管(80g)、装入晶体后的硬质玻璃管(93g)、D的质量(78g)。反应后称得C中硬质玻璃管的质量为87.6g,D的质量为87g。产品硫酸亚铁晶体(FeSO4•nH2O)中n=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】无水四氯化锡( )可用于制作导电玻璃,导电玻璃广泛用于液晶显示屏、薄膜太阳能电池基底等。可用如图装置制备四氯化锡(部分夹持装置已略去):
)可用于制作导电玻璃,导电玻璃广泛用于液晶显示屏、薄膜太阳能电池基底等。可用如图装置制备四氯化锡(部分夹持装置已略去):

已知:
①氧化性: ;
;
②有关信息如表:
回答下列问题:
(1)仪器A的名称为_______ ,仪器A中发生反应的离子方程式为_______ 。
(2)将装置如图连接好之后,首先应进行的操作为_______ ,而后慢慢滴入浓盐酸,待观察到丁装置中充满黄绿色气体后,开始加热丁装置,锡熔化后适当增大氯气流量并继续加热丁装置。
(3)戊装置中球形冷凝管的冷水进口为_______ (填“a”或“b”)。
(4)己装置中碱石灰的作用是_______ 。
(5) 和
和 的反应产物可能会有
的反应产物可能会有 和
和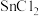 ,为防止产品中带入
,为防止产品中带入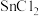 ,除了通入过量氯气外,应控制温度在
,除了通入过量氯气外,应控制温度在_______ ~_______ ℃范围内。
(6)碘氧化法滴定分析产品中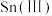 的含量。准确称取
的含量。准确称取 产品于锥形瓶中,用适量浓盐酸溶解,淀粉溶液作指示剂,用
产品于锥形瓶中,用适量浓盐酸溶解,淀粉溶液作指示剂,用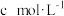 碘标准溶液滴定。实验中达到滴定终点的颜色变化为
碘标准溶液滴定。实验中达到滴定终点的颜色变化为_______ ,若此时消耗碘标准溶液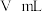 ,则产品中
,则产品中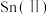 的质量分数为
的质量分数为_______ (用字母表示)。
 )可用于制作导电玻璃,导电玻璃广泛用于液晶显示屏、薄膜太阳能电池基底等。可用如图装置制备四氯化锡(部分夹持装置已略去):
)可用于制作导电玻璃,导电玻璃广泛用于液晶显示屏、薄膜太阳能电池基底等。可用如图装置制备四氯化锡(部分夹持装置已略去):
已知:
①氧化性:
 ;
;②有关信息如表:
| 化学式 |  | 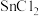 |  |
| 熔点/℃ | 232 | 246 | -33 |
| 沸点/℃ | 2260 | 652 | 114 |
| 其他性质 | 银白色固体金属 | 无色晶体,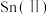 易被 易被 、 、 等氧化成 等氧化成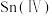 | 无色液体、易水解 |
(1)仪器A的名称为
(2)将装置如图连接好之后,首先应进行的操作为
(3)戊装置中球形冷凝管的冷水进口为
(4)己装置中碱石灰的作用是
(5)
 和
和 的反应产物可能会有
的反应产物可能会有 和
和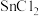 ,为防止产品中带入
,为防止产品中带入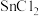 ,除了通入过量氯气外,应控制温度在
,除了通入过量氯气外,应控制温度在(6)碘氧化法滴定分析产品中
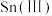 的含量。准确称取
的含量。准确称取 产品于锥形瓶中,用适量浓盐酸溶解,淀粉溶液作指示剂,用
产品于锥形瓶中,用适量浓盐酸溶解,淀粉溶液作指示剂,用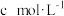 碘标准溶液滴定。实验中达到滴定终点的颜色变化为
碘标准溶液滴定。实验中达到滴定终点的颜色变化为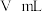 ,则产品中
,则产品中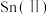 的质量分数为
的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】过氧化钠能与二氧化碳反应生成氧气,在潜水艇中可用作制氧剂。某学生为了验证这一实验,以足量的大理石、足量的盐酸和过氧化钠为原料制取 ,设计出如下图所示的实验装置。请回答下列问题。
,设计出如下图所示的实验装置。请回答下列问题。
(1)A中是制取 的装置,应选择下图中的
的装置,应选择下图中的___________ (填序号)。

A装置中发生反应的离子方程式为___________ 。
(2)B装置的作用是___________ ,C装置内可能出现的现象是___________ 。为了检验E中收集到的气体,在取出集气瓶后,___________ (简要表述操作过程及结论)。
(3)若E中的石灰水出现轻微白色浑浊,请说明原因:___________ (用离子方程式及简要文字描述)。
 ,设计出如下图所示的实验装置。请回答下列问题。
,设计出如下图所示的实验装置。请回答下列问题。
(1)A中是制取
 的装置,应选择下图中的
的装置,应选择下图中的
A装置中发生反应的离子方程式为
(2)B装置的作用是
(3)若E中的石灰水出现轻微白色浑浊,请说明原因:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
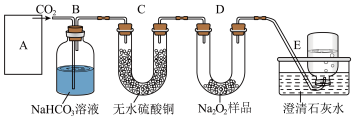
【推荐3】实验室用下图装置(夹持装置已省略)制备氨基甲酸铵(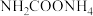 )。已知:
)。已知:
①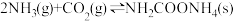 ,
, ;
;
副反应: ,
,
②常压下, 沸点
沸点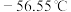 ,熔点
,熔点 。氨基甲酸铵沸点58.76℃,熔点59.61℃。
。氨基甲酸铵沸点58.76℃,熔点59.61℃。
③ 、
、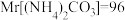
请回答:

(1)①装置A中发生的反应方程式是___________ 。装置B内盛放的试剂是___________ 。
②装置C用干冰产气的优点是___________ 。
A.干冰气化生成二氧化碳气体,提供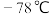 低温环境 B.避免了二氧化碳气体的干燥
低温环境 B.避免了二氧化碳气体的干燥
C.增大了反应物氨气的转化率 D.加快了氨基甲酸铵的生成速率
(2)装置 的作用是①
的作用是①___________ ;②防止空气中的 进入,使产品水解。若E中有气泡产生,接下来的具体操作是
进入,使产品水解。若E中有气泡产生,接下来的具体操作是___________ 。
(3)产品分析:称取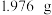 样品(内含杂质
样品(内含杂质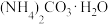 ),溶于
),溶于 容量瓶,用蒸馏水定容到刻度,每次取
容量瓶,用蒸馏水定容到刻度,每次取 试样于锥形瓶中进行滴定。已知:
试样于锥形瓶中进行滴定。已知:

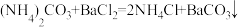

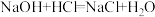 ,为避免碳酸钡的溶解,采用盐酸回滴过量的氢氧化钠标准液,然后计算氨基甲酸铵的氨含量。
,为避免碳酸钡的溶解,采用盐酸回滴过量的氢氧化钠标准液,然后计算氨基甲酸铵的氨含量。
实验数据如下表:
氨基甲酸铵纯度为___________ 。
(4)氨基甲酸铵(易分解)固体分解的标准平衡常数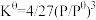 ,其中P为系统总压,
,其中P为系统总压,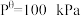 。针对测定实验装置图,从下列选项选择合适操作(操作不能重复使用)并排序:
。针对测定实验装置图,从下列选项选择合适操作(操作不能重复使用)并排序:

___________ 
___________ 
___________ 
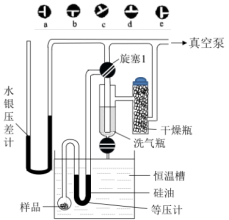
a.将少量样品装入等压计中,在U形管中加入适量的硅油作液封
b.记录压差计两臂读数、恒温槽读数
c.开动真空泵,使体系呈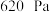 负压,恒温10分钟
负压,恒温10分钟
d.调整活塞1处于d位置,通过毛细管放入空气,使等压计U形管左臂压力始终略大于右臂压力,以保证反应向正方向进行。
e.反复操作,接近分解平衡时,调整等压计两边液面相平
f.将等压计接到真空系统,调整活塞1处于b位置,调节恒温槽温度为30.0℃
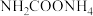 )。已知:
)。已知:①
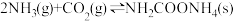 ,
, ;
;副反应:
 ,
,
②常压下,
 沸点
沸点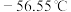 ,熔点
,熔点 。氨基甲酸铵沸点58.76℃,熔点59.61℃。
。氨基甲酸铵沸点58.76℃,熔点59.61℃。③
 、
、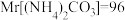
请回答:

(1)①装置A中发生的反应方程式是
②装置C用干冰产气的优点是
A.干冰气化生成二氧化碳气体,提供
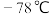 低温环境 B.避免了二氧化碳气体的干燥
低温环境 B.避免了二氧化碳气体的干燥C.增大了反应物氨气的转化率 D.加快了氨基甲酸铵的生成速率
(2)装置
 的作用是①
的作用是① 进入,使产品水解。若E中有气泡产生,接下来的具体操作是
进入,使产品水解。若E中有气泡产生,接下来的具体操作是(3)产品分析:称取
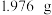 样品(内含杂质
样品(内含杂质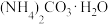 ),溶于
),溶于 容量瓶,用蒸馏水定容到刻度,每次取
容量瓶,用蒸馏水定容到刻度,每次取 试样于锥形瓶中进行滴定。已知:
试样于锥形瓶中进行滴定。已知:
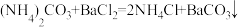

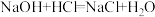 ,为避免碳酸钡的溶解,采用盐酸回滴过量的氢氧化钠标准液,然后计算氨基甲酸铵的氨含量。
,为避免碳酸钡的溶解,采用盐酸回滴过量的氢氧化钠标准液,然后计算氨基甲酸铵的氨含量。实验数据如下表:
加入 物质的量( 物质的量(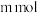 ) ) | 25.000 |
回滴消耗盐酸物质的量(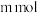 ) ) | 12.925 |
(4)氨基甲酸铵(易分解)固体分解的标准平衡常数
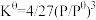 ,其中P为系统总压,
,其中P为系统总压,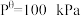 。针对测定实验装置图,从下列选项选择合适操作(操作不能重复使用)并排序:
。针对测定实验装置图,从下列选项选择合适操作(操作不能重复使用)并排序:
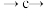



a.将少量样品装入等压计中,在U形管中加入适量的硅油作液封
b.记录压差计两臂读数、恒温槽读数
c.开动真空泵,使体系呈
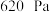 负压,恒温10分钟
负压,恒温10分钟d.调整活塞1处于d位置,通过毛细管放入空气,使等压计U形管左臂压力始终略大于右臂压力,以保证反应向正方向进行。
e.反复操作,接近分解平衡时,调整等压计两边液面相平
f.将等压计接到真空系统,调整活塞1处于b位置,调节恒温槽温度为30.0℃
您最近一年使用:0次



