向一定量MgCl2、AlCl3溶液中滴加常用试剂NaOH与盐酸(t时刻之前滴加的试剂a,t时刻之后改滴试剂b),沉淀的物质的量y (mol)与试剂体积x (mL)间的关系曲线如图所示。试回答:
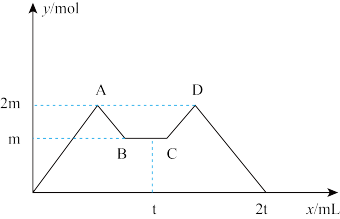
(1)AB段所表示的反应的离子方程式是________________________________________________ ;
CD段所表示的反应的离子方程式是_____________________________________ 。
(2)若向B处生成的溶液中通入足量二氧化碳气体,反应的离子方程式是________________________ 。
(3)a是______________ ,且c(a)∶c(b)=_______________
(4)原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=_____________________
(5)纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到。取4.53 g硫酸铝铵晶体【Al2(NH4)2(SO4)n·24H2O,相对分子质量为906】加热分解,最终剩余0.51 gAl2O3固体。加热过程中,固体质量随时间的变化如下图所示。
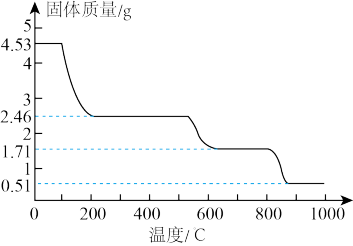
试通过计算确定400℃剩余固体成分的化学式_____________________________ 。(写出计算过程)

(1)AB段所表示的反应的离子方程式是
CD段所表示的反应的离子方程式是
(2)若向B处生成的溶液中通入足量二氧化碳气体,反应的离子方程式是
(3)a是
(4)原混合液中,c(Al3+)∶c(Mg2+)∶c(Cl-)=
(5)纳米氧化铝在陶瓷材料、电子工业、生物医药等方面有广阔的应用前景,它可通过硫酸铝铵晶体热分解得到。取4.53 g硫酸铝铵晶体【Al2(NH4)2(SO4)n·24H2O,相对分子质量为906】加热分解,最终剩余0.51 gAl2O3固体。加热过程中,固体质量随时间的变化如下图所示。

试通过计算确定400℃剩余固体成分的化学式
更新时间:2016-12-09 07:21:19
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】聚合硫酸铁铝[AlFe(OH)6-2n(SO4)n](简称PAFS或PFAS)在处理废水方面有重要的应用。某化工厂利用硫铁矿烧渣[主要成分为Fe3O4、FeO、SiO2(不溶于水和酸溶液)等]和粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为原料生产聚合硫酸铁铝的流程如下:
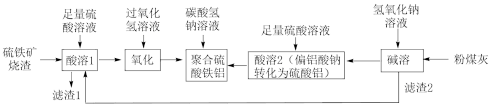
回答下列问题:
(1)滤渣2中主要物质的化学式是___________ 。
(2)“碱溶”步骤中发生反应的化学方程式为___________ 。
(3)“酸溶1”所得溶液中主要离子有___________ 。
(4)“氧化”步骤中发生反应的离子方程式为___________ 。
(5)控制一定条件,若将含84 kg碳酸氢钠的溶液加入1000 L硫酸铁溶液和硫酸铝溶液的混合溶液中,恰好完全反应生成难溶的AlFe(OH)2(SO4)2、Na2SO4和二氧化碳。通过计算(写出计算过程)求:
①准状况下,产生二氧化碳的体积___________ 。
②反应后溶液中Na2SO4的物质的量浓度___________ (假定溶液体积不变)。

回答下列问题:
(1)滤渣2中主要物质的化学式是
(2)“碱溶”步骤中发生反应的化学方程式为
(3)“酸溶1”所得溶液中主要离子有
(4)“氧化”步骤中发生反应的离子方程式为
(5)控制一定条件,若将含84 kg碳酸氢钠的溶液加入1000 L硫酸铁溶液和硫酸铝溶液的混合溶液中,恰好完全反应生成难溶的AlFe(OH)2(SO4)2、Na2SO4和二氧化碳。通过计算(写出计算过程)求:
①准状况下,产生二氧化碳的体积
②反应后溶液中Na2SO4的物质的量浓度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】亚硫酰氯(SOCl2)又名氯化亚砜,是一种无色或淡黄色发烟液体,有强烈刺激性气味,常用作脱水剂,遇水剧烈水解,受热易分解。某实验小组设计实验制备氯化亚砜并探究其性质。
已知:①实验室制备原理为 。
。
实验一:制备并探究SOCl2的性质,制备SOCl2的装置如图(夹持装置已略去)。
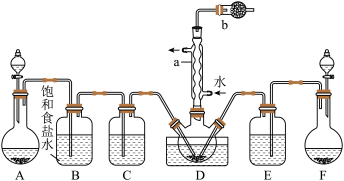
(1)a仪器的名称为_______ ,b装置的作用是_______ 。
(2) 可通过
可通过 固体与70%浓
固体与70%浓 反应制取,
反应制取, 可通过
可通过 固体与浓盐酸反应制取,则上图中制取
固体与浓盐酸反应制取,则上图中制取 的装置为
的装置为_______ (填字母)。
(3)将上述装置制得的SOCl2通过蒸馏方法提取出来(加热及夹持装置略),装置安装顺序为①⑨⑧_______ (填序号)。

(4)甲同学认为SOCl2可用作热分解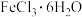 制取无水
制取无水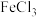 的脱水剂,反应的化学方程式为
的脱水剂,反应的化学方程式为_______ ;但乙同学认为该实验可能发生副反应使产品不纯,所以乙同学取少量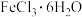 在不断通入SOCl2蒸气的条件下加热,充分反应后通入N2,加水溶解,取溶解后的溶液少许,加入
在不断通入SOCl2蒸气的条件下加热,充分反应后通入N2,加水溶解,取溶解后的溶液少许,加入_______ (填写试剂和实验现象),说明发生了副反应。
实验二:测定某SOCl2样品中SOCl2的纯度。
①准确称量称量瓶和盖的总质量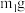 ,迅速加入
,迅速加入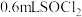 样品,立即盖紧,称量,质量为
样品,立即盖紧,称量,质量为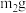 。
。
②将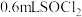 样品溶于
样品溶于 溶液中,发生反应:SOCl2 +4 NaOH = Na2SO3+2NaCl+2H2O,将反应后的溶液稀释到
溶液中,发生反应:SOCl2 +4 NaOH = Na2SO3+2NaCl+2H2O,将反应后的溶液稀释到 。
。
③准确量取100ml上面溶液于碘量瓶中,加入两滴指示剂,用适量稀盐酸中和过量的 溶液至恰好完全。
溶液至恰好完全。
④准确加入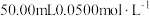 碘标准溶液,充分反应后,用淀粉溶液作指示剂,用
碘标准溶液,充分反应后,用淀粉溶液作指示剂,用 的
的 溶液滴定过量的碘,反应为
溶液滴定过量的碘,反应为 。平行测定两次,反应消耗
。平行测定两次,反应消耗 溶液的平均体积为
溶液的平均体积为 。
。
(5)判断滴定终点的方法为_______ ,样品中SOCl2的质量分数为_______ ;下列情况会导致测定的SOCl2的质量分数偏高的是_______ (填标号)。
A.实际碘标准溶液浓度偏低
B.实际 溶液浓度偏低
溶液浓度偏低
C.将0.6mlSOCl2样品溶解于300mlNaOH溶液中时,气体吸收不充分,有部分气体逸出
已知:①实验室制备原理为
 。
。实验一:制备并探究SOCl2的性质,制备SOCl2的装置如图(夹持装置已略去)。

(1)a仪器的名称为
(2)
 可通过
可通过 固体与70%浓
固体与70%浓 反应制取,
反应制取, 可通过
可通过 固体与浓盐酸反应制取,则上图中制取
固体与浓盐酸反应制取,则上图中制取 的装置为
的装置为(3)将上述装置制得的SOCl2通过蒸馏方法提取出来(加热及夹持装置略),装置安装顺序为①⑨⑧

(4)甲同学认为SOCl2可用作热分解
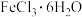 制取无水
制取无水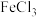 的脱水剂,反应的化学方程式为
的脱水剂,反应的化学方程式为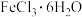 在不断通入SOCl2蒸气的条件下加热,充分反应后通入N2,加水溶解,取溶解后的溶液少许,加入
在不断通入SOCl2蒸气的条件下加热,充分反应后通入N2,加水溶解,取溶解后的溶液少许,加入实验二:测定某SOCl2样品中SOCl2的纯度。
①准确称量称量瓶和盖的总质量
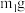 ,迅速加入
,迅速加入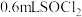 样品,立即盖紧,称量,质量为
样品,立即盖紧,称量,质量为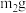 。
。②将
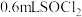 样品溶于
样品溶于 溶液中,发生反应:SOCl2 +4 NaOH = Na2SO3+2NaCl+2H2O,将反应后的溶液稀释到
溶液中,发生反应:SOCl2 +4 NaOH = Na2SO3+2NaCl+2H2O,将反应后的溶液稀释到 。
。③准确量取100ml上面溶液于碘量瓶中,加入两滴指示剂,用适量稀盐酸中和过量的
 溶液至恰好完全。
溶液至恰好完全。④准确加入
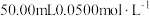 碘标准溶液,充分反应后,用淀粉溶液作指示剂,用
碘标准溶液,充分反应后,用淀粉溶液作指示剂,用 的
的 溶液滴定过量的碘,反应为
溶液滴定过量的碘,反应为 。平行测定两次,反应消耗
。平行测定两次,反应消耗 溶液的平均体积为
溶液的平均体积为 。
。(5)判断滴定终点的方法为
A.实际碘标准溶液浓度偏低
B.实际
 溶液浓度偏低
溶液浓度偏低C.将0.6mlSOCl2样品溶解于300mlNaOH溶液中时,气体吸收不充分,有部分气体逸出
您最近一年使用:0次
【推荐3】Co3O4在磁性材料、电化学领域应用广泛,实验室中可以用CoCO3或CoC2O4煅烧后制得。利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的流程如图所示:
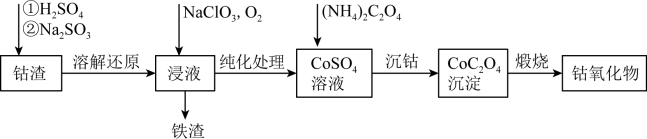
已知:Ksp[Co(OH)2]=1.6×10-15,Ksp(CoC2O4)=6.3×10-8,CoCO3煅烧300°C~600°C生成Co3O4,1100°C以上生成Co2O3。
(1)“溶解还原”过程中Co(OH)3发生反应的离子方程式为___________ 。
(2)“沉钴”时,不能用Na2C2O4溶液代替(NH4)C2O4溶液,原因是_______ 。
(3)为测定草酸钻样品中草酸钴晶体(CoC2O4·2H2O)的质量分数进行如下实验:
①取草酸钴(CoC2O4·2H2O)样品3.050g,加入100.00mL0.1000mol/L酸性KMnO4溶液,加热(该条件下Co2+不被氧化)。
②充分反应后将溶液冷却至室温,加入250mL容量瓶中,定容。
③取25.00mL溶液,用0.1000mol/LFeSO4溶液滴定,消耗FeSO4溶液18.00mL。
计算样品中草酸钴晶体(CoC2O4·2H2O)的质量分数:___________ (写出计算过程)。

已知:Ksp[Co(OH)2]=1.6×10-15,Ksp(CoC2O4)=6.3×10-8,CoCO3煅烧300°C~600°C生成Co3O4,1100°C以上生成Co2O3。
(1)“溶解还原”过程中Co(OH)3发生反应的离子方程式为
(2)“沉钴”时,不能用Na2C2O4溶液代替(NH4)C2O4溶液,原因是
(3)为测定草酸钻样品中草酸钴晶体(CoC2O4·2H2O)的质量分数进行如下实验:
①取草酸钴(CoC2O4·2H2O)样品3.050g,加入100.00mL0.1000mol/L酸性KMnO4溶液,加热(该条件下Co2+不被氧化)。
②充分反应后将溶液冷却至室温,加入250mL容量瓶中,定容。
③取25.00mL溶液,用0.1000mol/LFeSO4溶液滴定,消耗FeSO4溶液18.00mL。
计算样品中草酸钴晶体(CoC2O4·2H2O)的质量分数:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】硫氰化钾( )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
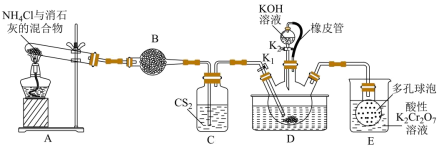
已知:① 不溶于水,密度比水的大;
不溶于水,密度比水的大;
② 不溶于
不溶于 ;
;
③三颈烧瓶内盛放有 、水和催化剂。
、水和催化剂。
回答下列问题:
(1)制备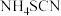 溶液:
溶液:
①实验前,经检验装置的气密性良好。其中装置B中的试剂是___________ 。
②实验开始时,打开K,加热装置A、D,使A中产生的气体缓缓通入D中,发生反应
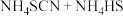 该反应比较缓慢),当看到
该反应比较缓慢),当看到___________ 现象时说明该反应接近完全。
(2)制备 溶液:
溶液:
①熄灭A处的酒精灯,关闭 ,移开水浴,将装置D继续加热至105℃,当
,移开水浴,将装置D继续加热至105℃,当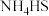 完全分解后(
完全分解后(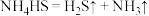 ),打开
),打开 ,继续保持液温105℃,缓缓滴入适量的
,继续保持液温105℃,缓缓滴入适量的 溶液,发生反应的化学方程式为
溶液,发生反应的化学方程式为___________ 。
②装置E中多孔球泡的作用是___________ 。
(3)制备 晶体:先滤去三颈烧瓶中的固体催化剂,
晶体:先滤去三颈烧瓶中的固体催化剂,___________ 、___________ 、过滤、洗涤、干燥,得到硫氰化钾晶体。
(4)测定晶体中 的含量:称取10.0g样品,配成
的含量:称取10.0g样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴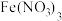 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。
①滴定时发生的反应: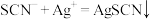 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是________ 。
②晶体中 的质量分数为
的质量分数为___________ (结果精确至0.1%)。
 )俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
)俗称玫瑰红酸钾,是一种用途广泛的化学药品。实验室模拟工业制备硫氰化钾的实验装置如下图所示:
已知:①
 不溶于水,密度比水的大;
不溶于水,密度比水的大;②
 不溶于
不溶于 ;
;③三颈烧瓶内盛放有
 、水和催化剂。
、水和催化剂。回答下列问题:
(1)制备
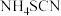 溶液:
溶液:①实验前,经检验装置的气密性良好。其中装置B中的试剂是
②实验开始时,打开K,加热装置A、D,使A中产生的气体缓缓通入D中,发生反应

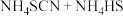 该反应比较缓慢),当看到
该反应比较缓慢),当看到(2)制备
 溶液:
溶液:①熄灭A处的酒精灯,关闭
 ,移开水浴,将装置D继续加热至105℃,当
,移开水浴,将装置D继续加热至105℃,当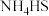 完全分解后(
完全分解后(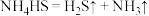 ),打开
),打开 ,继续保持液温105℃,缓缓滴入适量的
,继续保持液温105℃,缓缓滴入适量的 溶液,发生反应的化学方程式为
溶液,发生反应的化学方程式为②装置E中多孔球泡的作用是
(3)制备
 晶体:先滤去三颈烧瓶中的固体催化剂,
晶体:先滤去三颈烧瓶中的固体催化剂,(4)测定晶体中
 的含量:称取10.0g样品,配成
的含量:称取10.0g样品,配成 溶液。量取
溶液。量取 溶液于锥形瓶中,加入适量稀硝酸,再加入几滴
溶液于锥形瓶中,加入适量稀硝酸,再加入几滴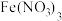 溶液作指示剂,用
溶液作指示剂,用
 标准溶液滴定,达到滴定终点时消耗
标准溶液滴定,达到滴定终点时消耗 标准溶液
标准溶液 。
。①滴定时发生的反应:
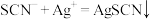 (白色)。则判断到达滴定终点的方法是
(白色)。则判断到达滴定终点的方法是②晶体中
 的质量分数为
的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】用如图所示装置测定氮肥[NH4HCO3中含(NH4)2CO3]中NH4HCO3的质量分数(不考虑铵盐溶液分解)。
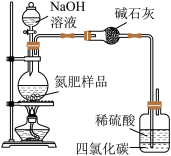
(1)实验时,若需配制100mL 5.0 mol∙L−1的NaOH溶液,则所需NaOH固体的质量是___________ 。
(2)为提高实验的准确性,待充分反应后需继续向烧瓶中鼓入空气一段时间,其目的是_______ 。
(3)取7.59g样品与NaOH溶液混合,完全溶解后,加热充分反应,并使生成的氨气全部被稀硫酸吸收,测得稀硫酸增重1.7g。
①样品中 的物质的量为
的物质的量为___________ mol。
②NH4HCO3的质量分数___________ 。

(1)实验时,若需配制100mL 5.0 mol∙L−1的NaOH溶液,则所需NaOH固体的质量是
(2)为提高实验的准确性,待充分反应后需继续向烧瓶中鼓入空气一段时间,其目的是
(3)取7.59g样品与NaOH溶液混合,完全溶解后,加热充分反应,并使生成的氨气全部被稀硫酸吸收,测得稀硫酸增重1.7g。
①样品中
 的物质的量为
的物质的量为②NH4HCO3的质量分数
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】已知A、B、C、D是中学化学中常见的四种不同粒子,它们之间存在如下图所示的转化关系:

(1)如果A、B、C、D均是10电子的粒子,请写出:
A的电子式_____________ ;D的电子式____________ ;
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式:____________________________________
②根据上述离子方程式,可判断C与B结合质子的能力大小是(用化学式或离子符号表示)________ >________ 。

(1)如果A、B、C、D均是10电子的粒子,请写出:
A的电子式
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,请写出:
①A与B在溶液中反应的离子方程式:
②根据上述离子方程式,可判断C与B结合质子的能力大小是(用化学式或离子符号表示)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】铝是一种轻金属,被称为金属界的“万金油”,应用范围极其广阔,含铝的化合物如氧化铝、氢氧化铝等在工业上用途十分广泛。
(1)写出金属铝与NaOH反应的化学方程式,并标出电子转移数目和方向:_______________________________________________________________________ 。
将一滴汞滴在已除去表面氧化膜的铝片上,放置在空气中等待片刻,滴在汞的地方会较快地长出“白毛”,其成分为_______________ 。
a. Al2O3 b . Al(OH)3 c. HgO d.铝汞齐
(2)某兴趣小组尝试分离Fe2O3和Al2O3的混合物,流程图,写出下列操作的名称及物质的化学式:
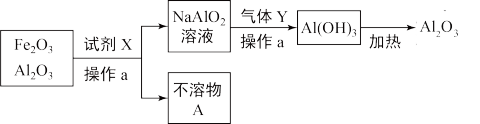
操作a的名称为_____________ ;
试剂X__________ ;不溶物A__________ ;
气体Y__________ ;
(3)写出Al(OH)3的电离方程式____________________________________________ 。实验室通常用AlCl3溶液作为制备Al(OH)3的原料,写出在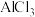 溶液中滴加过量NaOH溶液的化学方程式:
溶液中滴加过量NaOH溶液的化学方程式:_________________________________________________ 。
(4)在100mL 2mol/L AlCl3溶液中滴加NaOH溶液,过滤、洗涤、烘干后得到7.8g Al(OH)3沉淀,则加入的NaOH的物质的量为__________ mol。
(5)氢氧化铝是应用广泛的无机阻燃添加剂,阻燃时发生的化学反应为:2 Al(OH)3 Al2O3+3H2O根据方程式解释氢氧化铝能做阻燃剂的原因:
Al2O3+3H2O根据方程式解释氢氧化铝能做阻燃剂的原因:_______________________________________________________________________ 。
(1)写出金属铝与NaOH反应的化学方程式,并标出电子转移数目和方向:
将一滴汞滴在已除去表面氧化膜的铝片上,放置在空气中等待片刻,滴在汞的地方会较快地长出“白毛”,其成分为
a. Al2O3 b . Al(OH)3 c. HgO d.铝汞齐
(2)某兴趣小组尝试分离Fe2O3和Al2O3的混合物,流程图,写出下列操作的名称及物质的化学式:
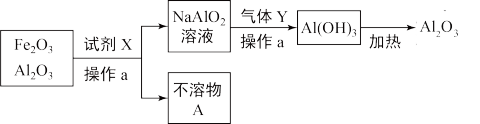
操作a的名称为
试剂X
气体Y
(3)写出Al(OH)3的电离方程式
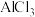 溶液中滴加过量NaOH溶液的化学方程式:
溶液中滴加过量NaOH溶液的化学方程式:(4)在100mL 2mol/L AlCl3溶液中滴加NaOH溶液,过滤、洗涤、烘干后得到7.8g Al(OH)3沉淀,则加入的NaOH的物质的量为
(5)氢氧化铝是应用广泛的无机阻燃添加剂,阻燃时发生的化学反应为:2 Al(OH)3
 Al2O3+3H2O根据方程式解释氢氧化铝能做阻燃剂的原因:
Al2O3+3H2O根据方程式解释氢氧化铝能做阻燃剂的原因:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】填空
(1)有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 的
的 溶液中,乙同学将电极放入6
溶液中,乙同学将电极放入6 的NaOH溶液中,如图所示。
的NaOH溶液中,如图所示。
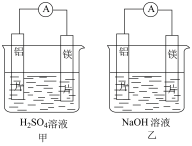
①写出甲中正极的电极反应式___________ 。
②写出乙中负极的电极反应式___________ 。
③将5.1g镁铝合金溶于60mL 5.0 mol/LH2SO4溶液中,完全溶解后再加入65mL 10.0 mol/L
的NaOH溶液,得到沉淀的质量为9.7g,继续滴加NaOH溶液时沉淀会减少。当加入___________ mL NaOH溶液时,可使溶解在硫酸的 和
和 恰好完全沉淀;合金溶于硫酸时所产生的氢气在标准状况下的体积为
恰好完全沉淀;合金溶于硫酸时所产生的氢气在标准状况下的体积为___________ L。
(2)酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。
①该电池的负极材料为___________
②该电池的正极反应式为___________
③电池反应的离子方程式为___________
(1)有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6
 的
的 溶液中,乙同学将电极放入6
溶液中,乙同学将电极放入6 的NaOH溶液中,如图所示。
的NaOH溶液中,如图所示。
①写出甲中正极的电极反应式
②写出乙中负极的电极反应式
③将5.1g镁铝合金溶于60mL 5.0 mol/LH2SO4溶液中,完全溶解后再加入65mL 10.0 mol/L
的NaOH溶液,得到沉淀的质量为9.7g,继续滴加NaOH溶液时沉淀会减少。当加入
 和
和 恰好完全沉淀;合金溶于硫酸时所产生的氢气在标准状况下的体积为
恰好完全沉淀;合金溶于硫酸时所产生的氢气在标准状况下的体积为(2)酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是由碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物。该电池放电过程产生MnOOH。
①该电池的负极材料为
②该电池的正极反应式为
③电池反应的离子方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
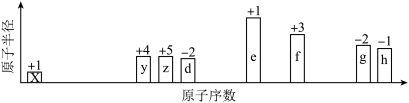
根据判断出的元素回答问题:
(1)f在元素周期表的位置是_____________ 。
(2)比较d、e常见离子的半径大小(用化学式表示,下同)_______ >_________ ;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______ >__________ 。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________ 。
(4)已知1 mol e的单质在足量d2中燃烧,恢复至室温,放出255.5 kJ热量,写出该反应的热化学方程式:_____________________________ 。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL1 mol/LR溶液的烧杯中滴加1 mol/LNaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
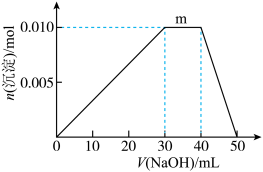
①写出m点反应的离子方程式____________________ 。
②若R溶液改加20 mL1.2 mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_______ mol。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是
(2)比较d、e常见离子的半径大小(用化学式表示,下同)
(3)任选上述元素组成一种四原子共价化合物,写出其电子式
(4)已知1 mol e的单质在足量d2中燃烧,恢复至室温,放出255.5 kJ热量,写出该反应的热化学方程式:
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL1 mol/LR溶液的烧杯中滴加1 mol/LNaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:

①写出m点反应的离子方程式
②若R溶液改加20 mL1.2 mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】A是单质,D是A单质所含元素的最高价氧化物的水化物,甲、乙、丙、丁四种化合物间除甲与丁、丙与乙外,两两均能发生中和反应。已知有如下转化关系(部分产物和反应条件已略去):

试回答:
(1)写出B在工业生产中的一种用途:____________ ,用化学方程式表示A物质在工业生产中的一种用途:____________ 。
(2)写出B转化为C的可能的离子方程式____________ ;_____________ 。
(3)若C的溶液显酸性,用离子方程式表示其净水的原理___________________ 。
(4)若C为钠盐,用含m mol C的溶液与1Lnmol/L的盐酸充分反应,已知m/n=1/2,则生成D的物质的量为__________ mol。

试回答:
(1)写出B在工业生产中的一种用途:
(2)写出B转化为C的可能的离子方程式
(3)若C的溶液显酸性,用离子方程式表示其净水的原理
(4)若C为钠盐,用含m mol C的溶液与1Lnmol/L的盐酸充分反应,已知m/n=1/2,则生成D的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】完成下列问题
(1)下列各组离子,在所给条件下一定能够大量共存的是_______
①pH=7的溶液中:Fe3+、Mg2+、 、
、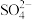
②加入苯酚显紫色的溶液中:Na+、Mg2+、Cl-、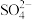 :
:
③能和Ca2+生成沉淀的溶液中:K+、Ba2+、CH3COO-、Cl-
④加入铝粉能放出氢气的溶液中: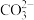 、
、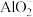 、I-、
、I-、
⑤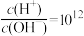 的溶液中:
的溶液中: 、Al3+、Ca2+、Cl-
、Al3+、Ca2+、Cl-
⑥常温下,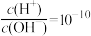 的溶液中:Ca2+、Mg2+、ClO-、I-
的溶液中:Ca2+、Mg2+、ClO-、I-
⑦在含有大量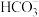 的溶液中:K+、Na+、
的溶液中:K+、Na+、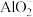 、Br-
、Br-
⑧在使pH试纸变红的溶液中:Fe2+、Na+、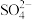 、
、
(2)向NaOH、Na2CO3、NaAlO2溶液中(假设各1mol),逐滴加入HCl溶液,产生沉淀的物质的量随HCl溶液体积变化的图象如下:
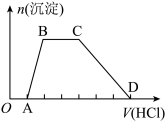
分析图象的变化情况,写出各阶段的离子方程式:
①OA:_______ 。
②AB:_______ 。
③BC:_______ 。
④CD:_______ 。
(3)将xgFe、FeO和Fe2O3混合物分成两等份,向其中一份中滴加500mL稀硝酸,固体恰好完全溶解并产生标准状况下NO气体aL,溶液中Fe元素均以+3价形式存在,另一份固体与足量H2反应质量减少yg。根据以上数据计算稀硝酸的浓度为_______ mol/L。(列式即可,无需化简)
(1)下列各组离子,在所给条件下一定能够大量共存的是
①pH=7的溶液中:Fe3+、Mg2+、
 、
、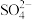
②加入苯酚显紫色的溶液中:Na+、Mg2+、Cl-、
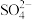 :
:③能和Ca2+生成沉淀的溶液中:K+、Ba2+、CH3COO-、Cl-
④加入铝粉能放出氢气的溶液中:
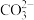 、
、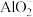 、I-、
、I-、
⑤
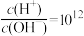 的溶液中:
的溶液中: 、Al3+、Ca2+、Cl-
、Al3+、Ca2+、Cl-⑥常温下,
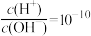 的溶液中:Ca2+、Mg2+、ClO-、I-
的溶液中:Ca2+、Mg2+、ClO-、I-⑦在含有大量
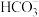 的溶液中:K+、Na+、
的溶液中:K+、Na+、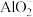 、Br-
、Br-⑧在使pH试纸变红的溶液中:Fe2+、Na+、
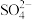 、
、
(2)向NaOH、Na2CO3、NaAlO2溶液中(假设各1mol),逐滴加入HCl溶液,产生沉淀的物质的量随HCl溶液体积变化的图象如下:

分析图象的变化情况,写出各阶段的离子方程式:
①OA:
②AB:
③BC:
④CD:
(3)将xgFe、FeO和Fe2O3混合物分成两等份,向其中一份中滴加500mL稀硝酸,固体恰好完全溶解并产生标准状况下NO气体aL,溶液中Fe元素均以+3价形式存在,另一份固体与足量H2反应质量减少yg。根据以上数据计算稀硝酸的浓度为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】某无色溶液中含有的金属阳离子为Mg2+、Al3+,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的物质的量与加入NaOH的物质的量的关系如图所示。

(1)由此确定原溶液中一定还大量含有某阳离子,它可能是________ 。
(2)若溶质为MgCl2和Al2(SO4)3,则原溶液中铝离子的物质的量为______________ 。
(3)下列图像中,横坐标表示加入试剂或通入气体的物质的量,纵坐标表示产生沉淀的质量,用图像的序号或文字回答下列问题:

Ⅰ.表示向AlCl3溶液中逐渐滴加NaOH溶液的是______ ;
Ⅱ.表示向NaAlO2溶液中逐渐滴加稀盐酸的是________ ;
Ⅲ.表示向NaAlO2溶液中通入CO2的是________ ;
Ⅳ.③图____________ (填“能”或“不能”)代表向含NaOH的澄清石灰水中通入CO2。

(1)由此确定原溶液中一定还大量含有某阳离子,它可能是
(2)若溶质为MgCl2和Al2(SO4)3,则原溶液中铝离子的物质的量为
(3)下列图像中,横坐标表示加入试剂或通入气体的物质的量,纵坐标表示产生沉淀的质量,用图像的序号或文字回答下列问题:

Ⅰ.表示向AlCl3溶液中逐渐滴加NaOH溶液的是
Ⅱ.表示向NaAlO2溶液中逐渐滴加稀盐酸的是
Ⅲ.表示向NaAlO2溶液中通入CO2的是
Ⅳ.③图
您最近一年使用:0次



