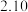制备多晶硅(硅单质的一种)的副产物以SiCl4为主,其对环境污染很大,遇水强烈水解,放出大量热量。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,含有钙、铁、镁等离子)制备BaCl2·2H2O,流程为:
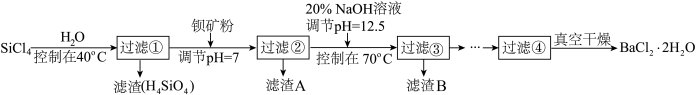
已知常温下Fe3+、Mg2+完全沉淀的pH分别是3.4和12.4;
(1)①SiCl4水解控制在40℃以下的原因是____________________ 。
②已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) ΔH1=47 kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g) ΔH2=189 kJ/mol
则SiCl4被H2还原制备硅的热化学方程式____________________ 。
(2)加钡矿粉时生成BaCl2的离子反应方程式____________________ 。
(3)过滤②的滤渣A的成分化学式为_______________ ;接着往滤液中加20% NaOH调节pH=12.5,控制温度70℃时,滤渣B的主要成分的化学式_______________ ,控制温度70℃的目的____________________ 。
(4)滤液③经、过滤__________________ 等操作,再经真空干燥后得到BaCl2·2H2O。

已知常温下Fe3+、Mg2+完全沉淀的pH分别是3.4和12.4;
(1)①SiCl4水解控制在40℃以下的原因是
②已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) ΔH1=47 kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g) ΔH2=189 kJ/mol
则SiCl4被H2还原制备硅的热化学方程式
(2)加钡矿粉时生成BaCl2的离子反应方程式
(3)过滤②的滤渣A的成分化学式为
(4)滤液③经、过滤
更新时间:2016-12-09 07:49:11
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】工业上冶炼钛主要以钛铁矿、金红石(含TiO2大于96%)等为原料生产。

(1)由金红石为原料采用亨特(Hunter)法生产钛的流程如下:
①沸腾氯化炉中反应的化学方程式为:_____________ ;
②已知:Ti(s) +2Cl2(g) = TiCl4(l) △H =-804.2kJ/mol;
2Na(s) +Cl2(g) = 2NaCl(s) △H =-882.0kJ/mol
Na(s) =Na(l) △H =+2.6kJ/mol
请写出用液态钠与四氯化钛置换出钛的热化学方程式_____________ ;
③海绵钛破碎后用0.5%~1.5%的盐酸洗涤,再用蒸馏水洗涤至中性,用盐酸洗涤的目的是______________ 。
(2)科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺。试回答下列有关问题。
①TiO2直接电解法(剑桥法)生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示,在阴极,被还原的Ca进一步还原TiO2获得钛,则在阴极所发生的反应为:____________ 。
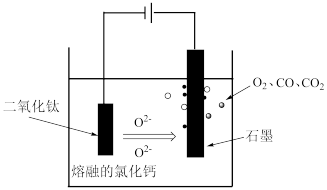
②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两极产物隔开,只允许氧离子通过,在电解过程中阳极通入某种还原性气体,可防止CO、CO2污染物产生,通入的气体若是H2,则阳极电解反应式为________ 。

(1)由金红石为原料采用亨特(Hunter)法生产钛的流程如下:
①沸腾氯化炉中反应的化学方程式为:
②已知:Ti(s) +2Cl2(g) = TiCl4(l) △H =-804.2kJ/mol;
2Na(s) +Cl2(g) = 2NaCl(s) △H =-882.0kJ/mol
Na(s) =Na(l) △H =+2.6kJ/mol
请写出用液态钠与四氯化钛置换出钛的热化学方程式
③海绵钛破碎后用0.5%~1.5%的盐酸洗涤,再用蒸馏水洗涤至中性,用盐酸洗涤的目的是
(2)科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺。试回答下列有关问题。
①TiO2直接电解法(剑桥法)生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如图所示,在阴极,被还原的Ca进一步还原TiO2获得钛,则在阴极所发生的反应为:

②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两极产物隔开,只允许氧离子通过,在电解过程中阳极通入某种还原性气体,可防止CO、CO2污染物产生,通入的气体若是H2,则阳极电解反应式为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】甲醇是一种重要的有机原料,在催化剂的作用下, 和
和 反应可生成甲醇
反应可生成甲醇 和副产物
和副产物 ,反应如下:
,反应如下:
反应①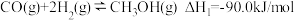
反应②
反应③
反应④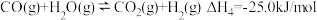
 、
、 、
、 、
、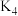 分别表示反应①、②、③、④的平衡常数.
分别表示反应①、②、③、④的平衡常数.
回答下列问题:
(1)反应②的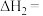
_____  ,
, 与
与 和
和 的关系为
的关系为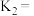
______ .
(2)图1中能正确表示反应①的平衡常数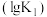 随温度变化的曲线为
随温度变化的曲线为________ (填曲线字母),其判断理由为____________ .
(3)为探究不同催化剂对 和
和 生成
生成 的选择性效果,某实验室控制
的选择性效果,某实验室控制 和
和 的初始投料比为
的初始投料比为 进行实验,得到如下表1数据:
进行实验,得到如下表1数据:
①由表1可知,反应Ⅰ的最佳催化剂为_______________ .
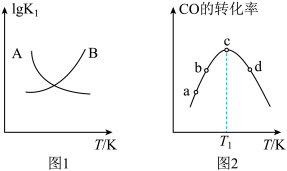
②图2中, 时
时 转化率最大的原因是
转化率最大的原因是_________________ .
③有利于提高 转化为
转化为 的平衡转化率的措施有
的平衡转化率的措施有__________ .
A.使用催化剂
B.适当降低反应温度
C.增大 和
和 的初始投料比
的初始投料比
D.恒容下,再充入 和
和
(4)已知 ,反应
,反应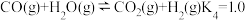 .该温度下,在某时刻体系中
.该温度下,在某时刻体系中 、
、 、
、 、
、 的浓度分别为
的浓度分别为 、
、 、
、 、
、 ,则此时上述反应的
,则此时上述反应的
_______ 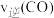 (填“>”、“<”或“=”)达到平衡时
(填“>”、“<”或“=”)达到平衡时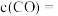
_____  .
.
 和
和 反应可生成甲醇
反应可生成甲醇 和副产物
和副产物 ,反应如下:
,反应如下:反应①
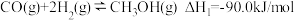
反应②

反应③

反应④
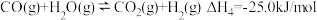
 、
、 、
、 、
、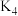 分别表示反应①、②、③、④的平衡常数.
分别表示反应①、②、③、④的平衡常数.回答下列问题:
(1)反应②的
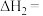
 ,
, 与
与 和
和 的关系为
的关系为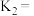
(2)图1中能正确表示反应①的平衡常数
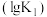 随温度变化的曲线为
随温度变化的曲线为
(3)为探究不同催化剂对
 和
和 生成
生成 的选择性效果,某实验室控制
的选择性效果,某实验室控制 和
和 的初始投料比为
的初始投料比为 进行实验,得到如下表1数据:
进行实验,得到如下表1数据: | 时间/ | 催化剂种类 | 甲醇的含量(%) |
| 450 | 10 |  | 78 |
| 450 | 10 | 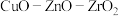 | 88 |
| 450 | 10 |  | 46 |
②图2中,
 时
时 转化率最大的原因是
转化率最大的原因是③有利于提高
 转化为
转化为 的平衡转化率的措施有
的平衡转化率的措施有A.使用催化剂
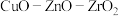
B.适当降低反应温度
C.增大
 和
和 的初始投料比
的初始投料比D.恒容下,再充入
 和
和
(4)已知
 ,反应
,反应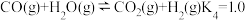 .该温度下,在某时刻体系中
.该温度下,在某时刻体系中 、
、 、
、 、
、 的浓度分别为
的浓度分别为 、
、 、
、 、
、 ,则此时上述反应的
,则此时上述反应的
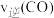 (填“>”、“<”或“=”)达到平衡时
(填“>”、“<”或“=”)达到平衡时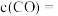
 .
.
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】氢能是一种极具发展潜力的清洁能源。
I.水煤气法制取氢气
煤气化装置中发生反应①:C(s)+H2O(g) CO(g)+H2(g) △H=+135kJ•mol-1;
CO(g)+H2(g) △H=+135kJ•mol-1;
水气变换装置中发生反应②:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41kJ•mol-1。
CO2(g)+H2(g) △H=-41kJ•mol-1。
(1)反应①发生前,需要通入一定量的氧气与碳发生燃烧反应,通入氧气的作用为_____ 。其他条件不变时,在相同时间内,向水气变换装置中投入一定量的CaO,H2的体积分数_____ (填“增大”“减小”或“不变”);如图所示,微米CaO和纳米CaO对平衡的影响力不同的原因为_____ 。

(2)一定量的煤和水蒸气经反应①后进入反应②装置且进料比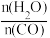 =0.8,反应一段时间后,达到平衡时
=0.8,反应一段时间后,达到平衡时 =3:1,CO的平衡转化率为
=3:1,CO的平衡转化率为_____ 。
II.水分解法制取氢气
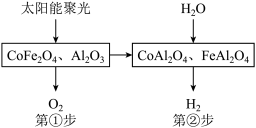
(3)将CoFe2O4负载在Al2O3上作为催化剂,反应分两步实现,产氧温度在1200℃,产氢温度在1000℃时,循环机理如图所示。
已知:H2O(g) H2(g)+
H2(g)+ O2(g) △H=(a+b)kJ•mol-1
O2(g) △H=(a+b)kJ•mol-1
第①步:CoFe2O4(s)+3Al2O3(s) CoAl2O4(s)+FeAl2O4(s)+
CoAl2O4(s)+FeAl2O4(s)+ O2(g) △H=akJ•mol-1;
O2(g) △H=akJ•mol-1;
第②步反应的热化学方程式为______ 。
(4)若第②步反应的平衡常数为K,则平衡常数的表达式为K=_____ 。
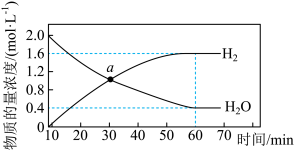
(5)已知对于反应aA(g)+bB(g) cC(g)+dD(g),v正=k正•ca(A)•cb(B),v逆=k逆•cc(C)•cd(D),其中k正、k逆分别为正、逆反应速率常数。1000℃时,第②步反应测得H2O(g)和H2物质的量浓度随时间的变化如图所示,a点时,v正:v逆=
cC(g)+dD(g),v正=k正•ca(A)•cb(B),v逆=k逆•cc(C)•cd(D),其中k正、k逆分别为正、逆反应速率常数。1000℃时,第②步反应测得H2O(g)和H2物质的量浓度随时间的变化如图所示,a点时,v正:v逆=_____ 。
I.水煤气法制取氢气
煤气化装置中发生反应①:C(s)+H2O(g)
 CO(g)+H2(g) △H=+135kJ•mol-1;
CO(g)+H2(g) △H=+135kJ•mol-1;水气变换装置中发生反应②:CO(g)+H2O(g)
 CO2(g)+H2(g) △H=-41kJ•mol-1。
CO2(g)+H2(g) △H=-41kJ•mol-1。(1)反应①发生前,需要通入一定量的氧气与碳发生燃烧反应,通入氧气的作用为

(2)一定量的煤和水蒸气经反应①后进入反应②装置且进料比
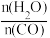 =0.8,反应一段时间后,达到平衡时
=0.8,反应一段时间后,达到平衡时 =3:1,CO的平衡转化率为
=3:1,CO的平衡转化率为II.水分解法制取氢气
(3)将CoFe2O4负载在Al2O3上作为催化剂,反应分两步实现,产氧温度在1200℃,产氢温度在1000℃时,循环机理如图所示。

已知:H2O(g)
 H2(g)+
H2(g)+ O2(g) △H=(a+b)kJ•mol-1
O2(g) △H=(a+b)kJ•mol-1第①步:CoFe2O4(s)+3Al2O3(s)
 CoAl2O4(s)+FeAl2O4(s)+
CoAl2O4(s)+FeAl2O4(s)+ O2(g) △H=akJ•mol-1;
O2(g) △H=akJ•mol-1;第②步反应的热化学方程式为
(4)若第②步反应的平衡常数为K,则平衡常数的表达式为K=
(5)已知对于反应aA(g)+bB(g)
 cC(g)+dD(g),v正=k正•ca(A)•cb(B),v逆=k逆•cc(C)•cd(D),其中k正、k逆分别为正、逆反应速率常数。1000℃时,第②步反应测得H2O(g)和H2物质的量浓度随时间的变化如图所示,a点时,v正:v逆=
cC(g)+dD(g),v正=k正•ca(A)•cb(B),v逆=k逆•cc(C)•cd(D),其中k正、k逆分别为正、逆反应速率常数。1000℃时,第②步反应测得H2O(g)和H2物质的量浓度随时间的变化如图所示,a点时,v正:v逆=
您最近一年使用:0次
【推荐1】信息时代产生的大量电子垃圾对环境造成了极大的威胁.某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含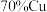 、
、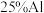 、
、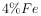 及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
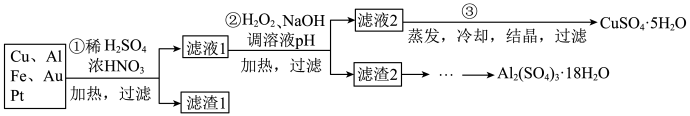
回答下列问题:
 第
第 步Cu与酸反应的离子方程式为
步Cu与酸反应的离子方程式为 ______ ;得到滤渣1的主要成分为 ______ .
 第
第 步加入
步加入 的作用是
的作用是 ______ ,使用 的优点是
的优点是 ______ ;调节pH的目的是使 ______ 生成沉淀.
 由滤渣2制取
由滤渣2制取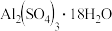 ,探究小组设计了三种方案:
,探究小组设计了三种方案:
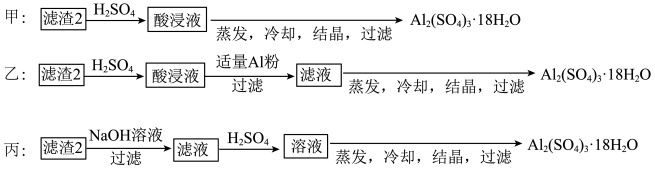
上述三种方案中,______ 方案不可行,原因是 ______ ;
 探究小组用滴定法测定
探究小组用滴定法测定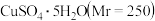 含量.取a g 试样配成100mL溶液,每次取
含量.取a g 试样配成100mL溶液,每次取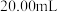 ,消除干扰离子后,用c
,消除干扰离子后,用c 
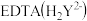 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b  滴定反应如下:
滴定反应如下: 写出计算
写出计算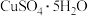 质量分数的表达式
质量分数的表达式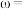
______ .
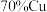 、
、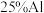 、
、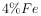 及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线: 
回答下列问题:
 第
第 步Cu与酸反应的离子方程式为
步Cu与酸反应的离子方程式为  第
第 步加入
步加入 的作用是
的作用是  的优点是
的优点是  由滤渣2制取
由滤渣2制取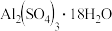 ,探究小组设计了三种方案:
,探究小组设计了三种方案: 
上述三种方案中,
 探究小组用滴定法测定
探究小组用滴定法测定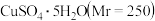 含量.取a g 试样配成100mL溶液,每次取
含量.取a g 试样配成100mL溶液,每次取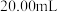 ,消除干扰离子后,用c
,消除干扰离子后,用c 
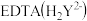 标准溶液滴定至终点,平均消耗EDTA溶液b
标准溶液滴定至终点,平均消耗EDTA溶液b  滴定反应如下:
滴定反应如下: 写出计算
写出计算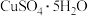 质量分数的表达式
质量分数的表达式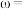
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
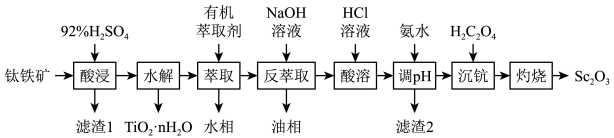
【推荐2】钪( )是一种功能强大但产量稀少的稀土金属、广泛用于航天、激光、导弹等尖端科学领域、针铁矿主要成分为钛酸亚铁(
)是一种功能强大但产量稀少的稀土金属、广泛用于航天、激光、导弹等尖端科学领域、针铁矿主要成分为钛酸亚铁( )、还含有少量
)、还含有少量 、
、 、
、 等杂质、从钛铁矿中提取钪的流程如图:
等杂质、从钛铁矿中提取钪的流程如图:
已知:①常温下, 完全沉淀的
完全沉淀的 为1.05,
为1.05, 完全沉淀的
完全沉淀的 为3.2
为3.2
②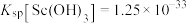 ,
,
回答下列问题:
(1)“酸浸”后钛主要以 的形式存在于溶液中,
的形式存在于溶液中, 中
中 元素的化合价为
元素的化合价为______ . 水解反应的化学方程式为
水解反应的化学方程式为__________________ .
(2)“滤渣1”的主要成分是______ .
(3)探讨影响钪的萃取率的因素:
温度对钪、钛的萃取率影响情况见上表,合适的萃取温度为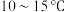 ,其理由是
,其理由是______ .
(4)常温下,“酸溶”后滤液中存在的金属阳离子 、
、 、
、 ,浓度均小于
,浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调
不沉淀,则调 应控制的范围,是
应控制的范围,是______ .
(5)“沉钪”得到草酸钪[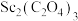 ],将其置于
],将其置于______ (填仪器名称)中,在空气中充分灼烧得到 和一种无毒气体,请写出反应的化学方程式
和一种无毒气体,请写出反应的化学方程式______ .
 )是一种功能强大但产量稀少的稀土金属、广泛用于航天、激光、导弹等尖端科学领域、针铁矿主要成分为钛酸亚铁(
)是一种功能强大但产量稀少的稀土金属、广泛用于航天、激光、导弹等尖端科学领域、针铁矿主要成分为钛酸亚铁( )、还含有少量
)、还含有少量 、
、 、
、 等杂质、从钛铁矿中提取钪的流程如图:
等杂质、从钛铁矿中提取钪的流程如图:
已知:①常温下,
 完全沉淀的
完全沉淀的 为1.05,
为1.05, 完全沉淀的
完全沉淀的 为3.2
为3.2②
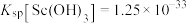 ,
,
回答下列问题:
(1)“酸浸”后钛主要以
 的形式存在于溶液中,
的形式存在于溶液中, 中
中 元素的化合价为
元素的化合价为 水解反应的化学方程式为
水解反应的化学方程式为(2)“滤渣1”的主要成分是
(3)探讨影响钪的萃取率的因素:
| 5 | 10 | 15 | 25 | 30 |
钪的萃取率/% |
|
|
|
|
|
钛的萃取率/% |
|
|
|
|
|
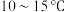 ,其理由是
,其理由是(4)常温下,“酸溶”后滤液中存在的金属阳离子
 、
、 、
、 ,浓度均小于
,浓度均小于 ,再用氨水调节溶液
,再用氨水调节溶液 使
使 、
、 沉淀完全而
沉淀完全而 不沉淀,则调
不沉淀,则调 应控制的范围,是
应控制的范围,是(5)“沉钪”得到草酸钪[
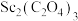 ],将其置于
],将其置于 和一种无毒气体,请写出反应的化学方程式
和一种无毒气体,请写出反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】工业上利用石煤矿粉(主要含 及少量
及少量 、
、 )为原料生产
)为原料生产 ,工艺流程如下:
,工艺流程如下:

已知:①“水溶”、“转沉”、“转化”后,所得含钒物质依次为 、
、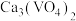 、
、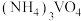 ;
;
②不同pH下,V元素在溶液中的主要存在形式见下表:
③25℃时,
回答下列问题:
(1)“焙烧”时, 发生反应的化学方程式为
发生反应的化学方程式为________ 。
(2)滤渣Ⅰ的成分为_________ (填化学式)。
(3)“转化”时,滤渣Ⅱ经高温煅烧后水浸,所得物质可导入到________ 操作单元中循环使用。
(4)“沉钒”中析出 晶体时,需要加入过量
晶体时,需要加入过量 ,其原因是①
,其原因是①_________ 。②________ ;25℃时,测得“转化”后,滤液中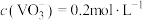 为使“沉钒”时,钒元素的沉降率达到96%,应调节溶液中
为使“沉钒”时,钒元素的沉降率达到96%,应调节溶液中 至少
至少______  。
。
(5)“煅烧”的, 制得产品
制得产品 。但反应体系中,若不及时分离气体Ⅱ,部分
。但反应体系中,若不及时分离气体Ⅱ,部分 会转化成
会转化成 ,反应中氧化剂与还原剂物质的量之比为
,反应中氧化剂与还原剂物质的量之比为 ,该反应的化学方程式为
,该反应的化学方程式为_________ 。
 及少量
及少量 、
、 )为原料生产
)为原料生产 ,工艺流程如下:
,工艺流程如下:
已知:①“水溶”、“转沉”、“转化”后,所得含钒物质依次为
 、
、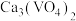 、
、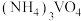 ;
;②不同pH下,V元素在溶液中的主要存在形式见下表:
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  |  |  |

回答下列问题:
(1)“焙烧”时,
 发生反应的化学方程式为
发生反应的化学方程式为(2)滤渣Ⅰ的成分为
(3)“转化”时,滤渣Ⅱ经高温煅烧后水浸,所得物质可导入到
(4)“沉钒”中析出
 晶体时,需要加入过量
晶体时,需要加入过量 ,其原因是①
,其原因是①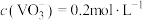 为使“沉钒”时,钒元素的沉降率达到96%,应调节溶液中
为使“沉钒”时,钒元素的沉降率达到96%,应调节溶液中 至少
至少 。
。(5)“煅烧”的,
 制得产品
制得产品 。但反应体系中,若不及时分离气体Ⅱ,部分
。但反应体系中,若不及时分离气体Ⅱ,部分 会转化成
会转化成 ,反应中氧化剂与还原剂物质的量之比为
,反应中氧化剂与还原剂物质的量之比为 ,该反应的化学方程式为
,该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
真题
解题方法
【推荐1】ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2固体以便运输和贮存。过氧化氢法制备NaClO2固体的实验装置如图1所示。
已知:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
请回答:
⑴仪器A的作用是_____ ;冰水浴冷却的目的是_____ (写出两种)。
⑵空气流速过快或过慢,均降低NaClO2产率,试解释其原因______ 。
(3)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①_____ (用离子方程式表示),②H2O2+Cl2=2Cl-+O2+2H+。
(4) H2O2浓度对反应速率有影响。通过图2所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是______ ,馏出物是_______ 。
(5)抽滤法分离NaClO2过程中,下列操作不正确的是_______
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
已知:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃;H2O2沸点150℃
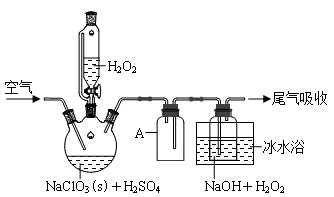
请回答:
⑴仪器A的作用是
⑵空气流速过快或过慢,均降低NaClO2产率,试解释其原因
(3)Cl-存在时会催化ClO2的生成。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步反应完成,将其补充完整:①
(4) H2O2浓度对反应速率有影响。通过图2所示装置将少量30% H2O2溶液浓缩至40%,B处应增加一个设备。该设备的作用是

(5)抽滤法分离NaClO2过程中,下列操作不正确的是
A.为防止滤纸被腐蚀,用玻璃纤维代替滤纸进行抽滤
B.先转移溶液至漏斗,待溶液快流尽时再转移沉淀
C.洗涤沉淀时,应使洗涤剂快速通过沉淀
D.抽滤完毕,断开水泵与吸滤瓶间的橡皮管后,关闭水龙头
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】被世界卫生组织列为Al级新型高效安全消毒剂的二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,易溶于水,沸点为11℃,遇热不稳定易分解发生爆炸。工业上利用硫铁矿[主要成分为二硫化亚铁(FeS2)]还原氯酸钠(NaClO3)制取二氧化氯。某研究小组利用如图装置制备ClO2,向三颈烧瓶中加入NaClO3溶液、浓H2SO4,通入空气,调节恒温器至60℃,通过固体加料器缓慢匀速地加入硫铁矿粉末。请回答下列问题:
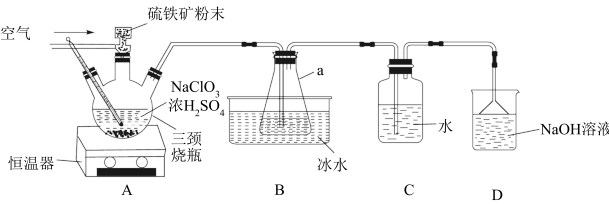
(1)FeS2中S元素的化合价为_______ 价;仪器a的名称是_______ 。
(2)三颈烧瓶中发生反应的离子方程式为ClO +FeS2+H+→ClO2↑+Fe3++SO
+FeS2+H+→ClO2↑+Fe3++SO +H2O(未配平)。
+H2O(未配平)。
①该反应中被氧化的元素为_______ (填元素符号)。
②配平该离子方程式:_______ 。
(3)装置_______ (填“A”、“B”或“C”)为收集ClO2的装置;装置D中倒置漏斗的作用是_______ 。
(4)设计实验证明C1O2的氧化性比Fe3+的强:_______ 。
(5)将少量ClO2水溶液滴入盛有MnSO4溶液的试管中,振荡,有黑色沉淀生成,已知反应中氧化剂与还原剂的物质的量之比为2:5,则该反应的离子方程式为_______ 。

(1)FeS2中S元素的化合价为
(2)三颈烧瓶中发生反应的离子方程式为ClO
 +FeS2+H+→ClO2↑+Fe3++SO
+FeS2+H+→ClO2↑+Fe3++SO +H2O(未配平)。
+H2O(未配平)。①该反应中被氧化的元素为
②配平该离子方程式:
(3)装置
(4)设计实验证明C1O2的氧化性比Fe3+的强:
(5)将少量ClO2水溶液滴入盛有MnSO4溶液的试管中,振荡,有黑色沉淀生成,已知反应中氧化剂与还原剂的物质的量之比为2:5,则该反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】水合肼(N2H4·H2O)可用作抗氧剂等,工业上常用尿素[CO(NH2)2]和 NaClO溶液反应制备水合肼。
已知:Ⅰ.N2H4·H2O 的结构如图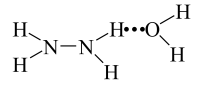 (…表示氢键)。
(…表示氢键)。
Ⅱ.N2H4·H2O 沸点 118 ℃,具有强还原性。
(1)将 Cl2 通入过量 NaOH 溶液中制备 NaClO,得到溶液 X,离子方程式是__ 。
(2)制备水合肼:将溶液 X 滴入尿素水溶液中,控制一定温度,装置如图 a(夹持及控温装置已略)。充分反应后,A 中的溶液经蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品 NaCl 和Na2CO3·10H2O。

①A 中反应的化学方程式是__ 。
②冷凝管的作用是__ 。
③若滴加 NaClO 溶液的速度较快时,水合肼的产率会下降,原因是__ 。
④NaCl 和 Na2CO3 的溶解度曲线如图 b。由蒸馏后的剩余溶液获得 NaCl 粗品的操作是__ 。
(3)水合肼在溶液中可发生类似 NH3·H2O 的电离,呈弱碱性;其分子中与 N 原子相连的 H 原子易发生取代反应。
①水合肼和盐酸按物质的量之比 1∶1 反应的离子方程式是__ 。
②碳酰肼(CH6N4O)是目前去除锅炉水中氧气的最先进材料,由水合肼与 DEC(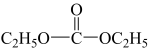 )发生取代反应制得。碳酰肼的结构简式是
)发生取代反应制得。碳酰肼的结构简式是__ 。
已知:Ⅰ.N2H4·H2O 的结构如图
 (…表示氢键)。
(…表示氢键)。Ⅱ.N2H4·H2O 沸点 118 ℃,具有强还原性。
(1)将 Cl2 通入过量 NaOH 溶液中制备 NaClO,得到溶液 X,离子方程式是
(2)制备水合肼:将溶液 X 滴入尿素水溶液中,控制一定温度,装置如图 a(夹持及控温装置已略)。充分反应后,A 中的溶液经蒸馏获得水合肼粗品后,剩余溶液再进一步处理还可获得副产品 NaCl 和Na2CO3·10H2O。

①A 中反应的化学方程式是
②冷凝管的作用是
③若滴加 NaClO 溶液的速度较快时,水合肼的产率会下降,原因是
④NaCl 和 Na2CO3 的溶解度曲线如图 b。由蒸馏后的剩余溶液获得 NaCl 粗品的操作是
(3)水合肼在溶液中可发生类似 NH3·H2O 的电离,呈弱碱性;其分子中与 N 原子相连的 H 原子易发生取代反应。
①水合肼和盐酸按物质的量之比 1∶1 反应的离子方程式是
②碳酰肼(CH6N4O)是目前去除锅炉水中氧气的最先进材料,由水合肼与 DEC(
 )发生取代反应制得。碳酰肼的结构简式是
)发生取代反应制得。碳酰肼的结构简式是
您最近一年使用:0次