硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂。它易溶于水,难溶于酒精,受热、遇酸易分解。工业上可用硫化碱法制备,反应原理:2Na2S + Na2CO3+ 4SO2=3Na2S2O3+ CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:
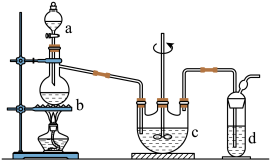
(1)b中反应的离子方程式为_________________________ ,c中试剂为__________ 。
(2)反应开始后,c中先有浑浊产生,后又变为澄清,此浑浊物是____________ 。
(3)控制b中的溶液的pH接近7,停止通入SO2。若未控制好,pH<7,会影响产率,原因是(用离子方程式表示)___________________________ 。
(4)停止通入SO2后,将c中的溶液抽入d中,d中的试剂为________ 。
(5)将d所得液溶转移到蒸发皿中,水浴加热浓缩,冷却结晶、过滤、洗涤,洗涤晶体所用的试剂为(填化学式)__________ 。
(6)实验中要控制SO2生成速率,可采取的措施有________________ (写出一条)。
(7)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL0.01mol/LKIO3溶液,并加入过量的KI酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时达到滴定终点。实验数据如下表:
则该产品的纯度是______ ,(用百分数表示,保留1位小数)间接碘量法滴定过程中可能造成实验结果偏低的是_________ 。
A.滴定管未用Na2S2O3溶液润洗
B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡

(1)b中反应的离子方程式为
(2)反应开始后,c中先有浑浊产生,后又变为澄清,此浑浊物是
(3)控制b中的溶液的pH接近7,停止通入SO2。若未控制好,pH<7,会影响产率,原因是(用离子方程式表示)
(4)停止通入SO2后,将c中的溶液抽入d中,d中的试剂为
(5)将d所得液溶转移到蒸发皿中,水浴加热浓缩,冷却结晶、过滤、洗涤,洗涤晶体所用的试剂为(填化学式)
(6)实验中要控制SO2生成速率,可采取的措施有
(7)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL0.01mol/LKIO3溶液,并加入过量的KI酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当蓝色褪去且半分钟不变色时达到滴定终点。实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
A.滴定管未用Na2S2O3溶液润洗
B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗
D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡
更新时间:2016-12-09 07:49:39
|
相似题推荐
解答题-工业流程题
|
困难
(0.15)
解题方法
【推荐1】将废旧电路板(含铜、铝、锑、铅、银、金、铂和钯等金属元素)破碎和静电分选处理后,从所得金属富集粉末中回收金属的部分工艺流程如下:

已知煅烧后银、钯、金、铂均以游离态存在,锑、铅转化为 、PbO(二者是两性偏碱性的氧化物);
、PbO(二者是两性偏碱性的氧化物); 在
在 中形成不溶碱性盐,但能与氯离子形成可溶性氯化锑;
中形成不溶碱性盐,但能与氯离子形成可溶性氯化锑; 可溶于碱。第一次酸浸调节pH为1~2,第二次酸浸调pH为4~5,氧化后滤液调pH为3~5;滤液a~e中分别含1~2种回收金属。回答下列问题:
可溶于碱。第一次酸浸调节pH为1~2,第二次酸浸调pH为4~5,氧化后滤液调pH为3~5;滤液a~e中分别含1~2种回收金属。回答下列问题:
(1)滤液a中溶质的主要成分为___________ ;为缩短煅烧时间,可采取的措施是___________ (回答一条即可)。
(2)若氧化过程使用足量稀硝酸,生成滤液e中主要成分的反应中,表现氧化性与表现酸性的硝酸物质的量之比为___________ 。 两性偏酸性,与强碱共热可得铅酸盐,
两性偏酸性,与强碱共热可得铅酸盐, 与NaOH反应的离子方程式为
与NaOH反应的离子方程式为___________ 。
(3)利用佛尔哈德(Volhard)法可直接滴定溶液中 测定其浓度,方法是在酸性介质中用铁铵矾[
测定其浓度,方法是在酸性介质中用铁铵矾[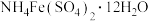 ]作指示剂,用KSCN标准溶液滴定
]作指示剂,用KSCN标准溶液滴定 [
[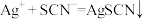 (白色)],达到滴定终点的现象
(白色)],达到滴定终点的现象___________ ;滴定时应将KSCN标准溶液加入___________ (填“酸式”或“碱式”)滴定管。
(4)冶金行业常用EDTA-2Na(乙二胺四乙酸二钠)滴定法测溶液中 浓度。方法是向一定体积待测液中加入过量氯化钠,过滤后将滤纸展开同氯化银沉淀一同放入烧杯,加氨水至沉淀完全溶解,在所得溶液中加入镍氰化钾[
浓度。方法是向一定体积待测液中加入过量氯化钠,过滤后将滤纸展开同氯化银沉淀一同放入烧杯,加氨水至沉淀完全溶解,在所得溶液中加入镍氰化钾[ ],镍被银定量取代,以紫脲酸铁为指示剂,用EDTA-2Na标准溶液滴定镍,从而直接计算
],镍被银定量取代,以紫脲酸铁为指示剂,用EDTA-2Na标准溶液滴定镍,从而直接计算 浓度。下列说法正确的是
浓度。下列说法正确的是___________ 。
A.氯化银溶于氨水的离子方程式为
B.配制EDTA-2Na标准溶液时,未冷却即转移至容量瓶中进行定容,所测 浓度偏大
浓度偏大
C.待测液中加入氯化钠,过滤后未洗涤沉淀时使用的烧杯,所测 浓度偏小
浓度偏小

已知煅烧后银、钯、金、铂均以游离态存在,锑、铅转化为
 、PbO(二者是两性偏碱性的氧化物);
、PbO(二者是两性偏碱性的氧化物); 在
在 中形成不溶碱性盐,但能与氯离子形成可溶性氯化锑;
中形成不溶碱性盐,但能与氯离子形成可溶性氯化锑; 可溶于碱。第一次酸浸调节pH为1~2,第二次酸浸调pH为4~5,氧化后滤液调pH为3~5;滤液a~e中分别含1~2种回收金属。回答下列问题:
可溶于碱。第一次酸浸调节pH为1~2,第二次酸浸调pH为4~5,氧化后滤液调pH为3~5;滤液a~e中分别含1~2种回收金属。回答下列问题:(1)滤液a中溶质的主要成分为
(2)若氧化过程使用足量稀硝酸,生成滤液e中主要成分的反应中,表现氧化性与表现酸性的硝酸物质的量之比为
 两性偏酸性,与强碱共热可得铅酸盐,
两性偏酸性,与强碱共热可得铅酸盐, 与NaOH反应的离子方程式为
与NaOH反应的离子方程式为(3)利用佛尔哈德(Volhard)法可直接滴定溶液中
 测定其浓度,方法是在酸性介质中用铁铵矾[
测定其浓度,方法是在酸性介质中用铁铵矾[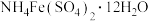 ]作指示剂,用KSCN标准溶液滴定
]作指示剂,用KSCN标准溶液滴定 [
[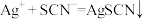 (白色)],达到滴定终点的现象
(白色)],达到滴定终点的现象(4)冶金行业常用EDTA-2Na(乙二胺四乙酸二钠)滴定法测溶液中
 浓度。方法是向一定体积待测液中加入过量氯化钠,过滤后将滤纸展开同氯化银沉淀一同放入烧杯,加氨水至沉淀完全溶解,在所得溶液中加入镍氰化钾[
浓度。方法是向一定体积待测液中加入过量氯化钠,过滤后将滤纸展开同氯化银沉淀一同放入烧杯,加氨水至沉淀完全溶解,在所得溶液中加入镍氰化钾[ ],镍被银定量取代,以紫脲酸铁为指示剂,用EDTA-2Na标准溶液滴定镍,从而直接计算
],镍被银定量取代,以紫脲酸铁为指示剂,用EDTA-2Na标准溶液滴定镍,从而直接计算 浓度。下列说法正确的是
浓度。下列说法正确的是A.氯化银溶于氨水的离子方程式为

B.配制EDTA-2Na标准溶液时,未冷却即转移至容量瓶中进行定容,所测
 浓度偏大
浓度偏大C.待测液中加入氯化钠,过滤后未洗涤沉淀时使用的烧杯,所测
 浓度偏小
浓度偏小
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
解题方法
【推荐2】小组同学探究 和不同铜盐溶液的反应,实验如下。
和不同铜盐溶液的反应,实验如下。
实验:向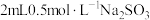 溶液中加入
溶液中加入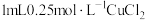 溶液,立即产生橙黄色沉淀(沉淀A),放置
溶液,立即产生橙黄色沉淀(沉淀A),放置 左右,转化为白色沉淀(沉淀B)。
左右,转化为白色沉淀(沉淀B)。
已知:i.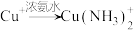 (无色)
(无色)
ii.
(1)研究沉淀B的成分。
向洗涤后的沉淀B中加入足量浓氨水,得到无色溶液,在空气中放置一段时间,溶液变为深蓝色。取少量深蓝色溶液,滴加试剂X,产生白色沉淀。
①白色沉淀是 ,试剂X是
,试剂X是_______ 。
②无色溶液在空气中放置变为深蓝色,反应的离子方程式为_______ 。
(2)经检验,沉淀A不含 。推测沉淀A能转化为沉淀B与
。推测沉淀A能转化为沉淀B与 有关,为研究沉淀A的成分及沉淀A转化为B的原因,实验如下。
有关,为研究沉淀A的成分及沉淀A转化为B的原因,实验如下。 ,补充实验:向少量洗净的沉淀A中加入稀硫酸,证实沉淀A中含有
,补充实验:向少量洗净的沉淀A中加入稀硫酸,证实沉淀A中含有 的证据是
的证据是_______ 。
②无色溶液中含有 ,推测
,推测 的产生有两个途径:
的产生有两个途径:
途径1:实验过程中 氧化
氧化 ;
;
途径2:_______ (将途径补充完整)。
经研究,途径1不合理,途径2合理。
③解释 和
和 溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:
溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:_______ 。
(3) 和
和 溶液反应最终生成
溶液反应最终生成 沉淀,并检测到有
沉淀,并检测到有 生成,离子方程式是
生成,离子方程式是_______ 。用 和
和 溶液重复上述实验,仅产生橙黄色沉淀,放置
溶液重复上述实验,仅产生橙黄色沉淀,放置 后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。
后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。
(4)根据上述实验所得结论:_______ (答出两点)。
 和不同铜盐溶液的反应,实验如下。
和不同铜盐溶液的反应,实验如下。实验:向
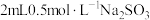 溶液中加入
溶液中加入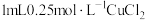 溶液,立即产生橙黄色沉淀(沉淀A),放置
溶液,立即产生橙黄色沉淀(沉淀A),放置 左右,转化为白色沉淀(沉淀B)。
左右,转化为白色沉淀(沉淀B)。已知:i.
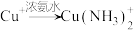 (无色)
(无色)ii.

(1)研究沉淀B的成分。
向洗涤后的沉淀B中加入足量浓氨水,得到无色溶液,在空气中放置一段时间,溶液变为深蓝色。取少量深蓝色溶液,滴加试剂X,产生白色沉淀。
①白色沉淀是
 ,试剂X是
,试剂X是②无色溶液在空气中放置变为深蓝色,反应的离子方程式为
(2)经检验,沉淀A不含
 。推测沉淀A能转化为沉淀B与
。推测沉淀A能转化为沉淀B与 有关,为研究沉淀A的成分及沉淀A转化为B的原因,实验如下。
有关,为研究沉淀A的成分及沉淀A转化为B的原因,实验如下。
 ,补充实验:向少量洗净的沉淀A中加入稀硫酸,证实沉淀A中含有
,补充实验:向少量洗净的沉淀A中加入稀硫酸,证实沉淀A中含有 的证据是
的证据是②无色溶液中含有
 ,推测
,推测 的产生有两个途径:
的产生有两个途径:途径1:实验过程中
 氧化
氧化 ;
;途径2:
经研究,途径1不合理,途径2合理。
③解释
 和
和 溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:
溶液反应时,先产生橙黄色沉淀,再转化为白色的原因:(3)
 和
和 溶液反应最终生成
溶液反应最终生成 沉淀,并检测到有
沉淀,并检测到有 生成,离子方程式是
生成,离子方程式是 和
和 溶液重复上述实验,仅产生橙黄色沉淀,放置
溶液重复上述实验,仅产生橙黄色沉淀,放置 后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。
后变为暗红色沉淀(可溶于氨水,得到无色溶液,放置变为深蓝色)。(4)根据上述实验所得结论:
您最近一年使用:0次
【推荐3】实验室从某废弃炉渣(含Cu、Ni、Co、Ca、Fe等金属及其氧化物)中回收Cu、Ni、Co,其部分实验过程如下:
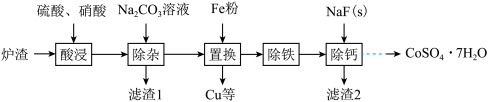
(1)除杂。该步骤所用玻璃仪器有烧杯、___________ 。
(2)除铁。将“置换”后溶液中的 氧化为
氧化为 ,控制pH可形成
,控制pH可形成 沉淀。写出该反应的离子方程式:
沉淀。写出该反应的离子方程式:_____________________ 。
(3)除钙。向“除铁”后的滤液中加入NaF,使 转化为
转化为 沉淀除去。若溶液pH偏低,将会导致
沉淀除去。若溶液pH偏低,将会导致 沉淀不完全,其原因是
沉淀不完全,其原因是____________ 。[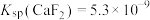 、
、 ]。
]。
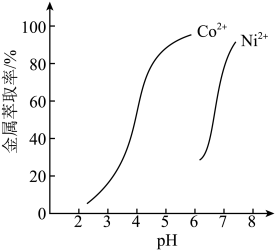
(4)除钙后的溶液经过萃取、反萃取等操作可分离钴和镍.其中萃取原理可表示为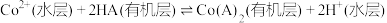
①与萃取剂Cyanex272(磷酸酯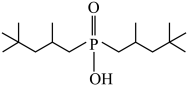 )相比,芳香基磷酸酯更适合高酸度废水中
)相比,芳香基磷酸酯更适合高酸度废水中 的萃取,原因是
的萃取,原因是______ 。
②设计以“除钙”后的混合溶液(含 、
、 、
、 溶液)为原料,制备
溶液)为原料,制备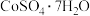 的实验方案:
的实验方案:__________ (已知 、
、 的萃取率-pH的关系曲线如图所示。实验中须使用的试剂有:Cyanex272、
的萃取率-pH的关系曲线如图所示。实验中须使用的试剂有:Cyanex272、 溶液、NaOH溶液)。
溶液、NaOH溶液)。

(1)除杂。该步骤所用玻璃仪器有烧杯、
(2)除铁。将“置换”后溶液中的
 氧化为
氧化为 ,控制pH可形成
,控制pH可形成 沉淀。写出该反应的离子方程式:
沉淀。写出该反应的离子方程式:(3)除钙。向“除铁”后的滤液中加入NaF,使
 转化为
转化为 沉淀除去。若溶液pH偏低,将会导致
沉淀除去。若溶液pH偏低,将会导致 沉淀不完全,其原因是
沉淀不完全,其原因是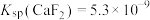 、
、 ]。
]。(4)除钙后的溶液经过萃取、反萃取等操作可分离钴和镍.其中萃取原理可表示为
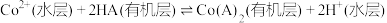
①与萃取剂Cyanex272(磷酸酯
 )相比,芳香基磷酸酯更适合高酸度废水中
)相比,芳香基磷酸酯更适合高酸度废水中 的萃取,原因是
的萃取,原因是②设计以“除钙”后的混合溶液(含
 、
、 、
、 溶液)为原料,制备
溶液)为原料,制备 的实验方案:
的实验方案: 、
、 的萃取率-pH的关系曲线如图所示。实验中须使用的试剂有:Cyanex272、
的萃取率-pH的关系曲线如图所示。实验中须使用的试剂有:Cyanex272、 溶液、NaOH溶液)。
溶液、NaOH溶液)。
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐1】某兴趣小组利用以下实验装置模拟工业炼铁的主要过程:
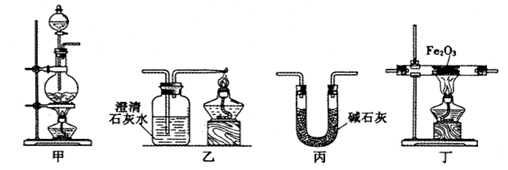
(1)装置甲中发生的反应为:HCOOH(甲酸)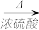 CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该
CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该______________ (填字母)。
a.将甲酸滴入浓硫酸 b.将浓硫酸滴入甲酸 c.将甲酸与浓硫酸混合后加入
(2)请按合适的顺序连接好以下装置:甲→( ) →( ) →( )
(3)丙装置中碱石灰的作用是__________________________ 。
(4)实验将近完成时,熄灭装置甲、乙、丁中酒精灯的先后顺序为__________ 。
(5)为了探究影响反应产物的外界因素,在Fe2O3,与CO反应部位,该小组同学分别用酒精灯和酒精喷灯进行了两次实验,结果如下:
①甲同学猜想黑色产物中可能含有碳单质。乙同学排除了该可能,他提出的两种理由是:____ 、____ 。
②丙同学查找资料发现,Fe3O4也能被磁铁吸引,对黑色产物成分提出以下三种假设:i.全部为铁;ii.________ ;iii.___________ 。
③通过进一步定量实验,黑色产物所含元素组成和质量分数如下:
样品I的成分及质量分数为______________________ 。
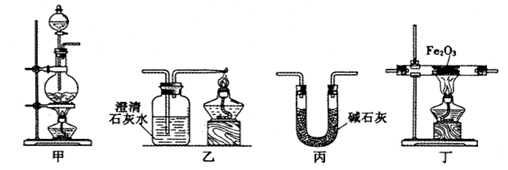
(1)装置甲中发生的反应为:HCOOH(甲酸)
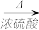 CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该
CO↑+H2O。已知甲酸是一种无色有刺激性气味的液体。制取一氧化碳时应该a.将甲酸滴入浓硫酸 b.将浓硫酸滴入甲酸 c.将甲酸与浓硫酸混合后加入
(2)请按合适的顺序连接好以下装置:甲→
(3)丙装置中碱石灰的作用是
(4)实验将近完成时,熄灭装置甲、乙、丁中酒精灯的先后顺序为
(5)为了探究影响反应产物的外界因素,在Fe2O3,与CO反应部位,该小组同学分别用酒精灯和酒精喷灯进行了两次实验,结果如下:
| 加热方式 | 通CO加热时间/min | 澄清石灰水变浑浊时间/min | 产物颜色 | 产物能否全部被磁铁吸引 |
| 酒精灯 | 30 | 5 | 黑色 | 能 |
| 酒精喷灯 | 30 | 1 | 黑色 | 能 |
①甲同学猜想黑色产物中可能含有碳单质。乙同学排除了该可能,他提出的两种理由是:
②丙同学查找资料发现,Fe3O4也能被磁铁吸引,对黑色产物成分提出以下三种假设:i.全部为铁;ii.
③通过进一步定量实验,黑色产物所含元素组成和质量分数如下:
| 样品序号 | 加热方式 | 元素组成和质量分数 |
| 产物样品I | 酒精灯 | w(Fe)=74.4%、w(O)=25.6% |
| 产物样品II | 酒精喷灯 | w(Fe)=100% |
样品I的成分及质量分数为
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
解题方法
【推荐2】高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
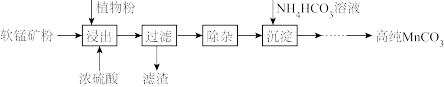
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是____ ,植物粉的作用是____ 。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是____ ;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式____ 。
(3)制备:在30 ℃~35 ℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35 ℃以下的原因是____ ;该反应的化学方程式为____ ;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____ 。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。_____________________________________

(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是
(3)制备:在30 ℃~35 ℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35 ℃以下的原因是
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
解题方法
【推荐3】碳酸镧[La(CO3)3,M=458g•mol-1]为白色难溶固体,分解温度为900℃。在溶液中制备时,形成水合碳酸镧La2(CO3)3•xH2O,若溶液碱性太强,会生成受热易分解的碱式碳酸镧La(OH)CO3。已知酒精喷灯火焰温度可达1000℃。
回答下列问题:
(1)用如图装置模拟制备水合碳酸镧:

①实验开始时,应先打开仪器___ (填“A”或“B”)的活塞。
②装置接口的连接顺序为___ →d,e←___ (填接口标号)。
③反应中生成水合碳酸镧的化学方程式为___ 。
(2)某小组通过以下实验验证制得的样品中不含La(OH)CO3,并测定La2(CO3)3•xH2O中结晶水的含量。将石英玻璃A管称重,记为m1g;将样品装入石英玻璃管中,再次将装置A称重,记为m2g;将装有试剂的装置C称重,记为m3g,按如图连接好装置进行实验。

实验步骤:i.打开K1、K2和K3,缓缓通入N2;
ii.数分钟后关闭K1、K3,打开K4,点燃酒精喷灯,加热A中样品;
iii.一段时间后,熄灭酒精喷灯,打开K1,通数分钟N2后关闭K1和K2,冷却到室温,称量A。重复上述操作步骤,直至A恒重,记为m4g(此时装置A中固体为La2O3,M=326g•mol-1);称重装置C,记为m5g。
①装置B中的试剂为___ 。
②根据实验记录,当 =
=__ 时,说明制得的样品中不含La(OH)CO3。
③若无装置D,测得La2(CO3)3•xH2O中x的数值__ (填“偏大”或“偏小”)。
(3)磷酸盐与碳酸镧结合后吸光度为0.30mg•L-1的磷酸盐溶液与对应吸光度关系如图,取2mL30mg•L-1的磷酸盐溶液,加入适量上述实验制备的水合碳酸镧进行测定,30min后测得溶液的吸光度为0.22,水合碳酸镧对磷酸盐的结合率为__ (结合率=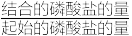 ×100%)。
×100%)。

回答下列问题:
(1)用如图装置模拟制备水合碳酸镧:

①实验开始时,应先打开仪器
②装置接口的连接顺序为
③反应中生成水合碳酸镧的化学方程式为
(2)某小组通过以下实验验证制得的样品中不含La(OH)CO3,并测定La2(CO3)3•xH2O中结晶水的含量。将石英玻璃A管称重,记为m1g;将样品装入石英玻璃管中,再次将装置A称重,记为m2g;将装有试剂的装置C称重,记为m3g,按如图连接好装置进行实验。

实验步骤:i.打开K1、K2和K3,缓缓通入N2;
ii.数分钟后关闭K1、K3,打开K4,点燃酒精喷灯,加热A中样品;
iii.一段时间后,熄灭酒精喷灯,打开K1,通数分钟N2后关闭K1和K2,冷却到室温,称量A。重复上述操作步骤,直至A恒重,记为m4g(此时装置A中固体为La2O3,M=326g•mol-1);称重装置C,记为m5g。
①装置B中的试剂为
②根据实验记录,当
 =
=③若无装置D,测得La2(CO3)3•xH2O中x的数值
(3)磷酸盐与碳酸镧结合后吸光度为0.30mg•L-1的磷酸盐溶液与对应吸光度关系如图,取2mL30mg•L-1的磷酸盐溶液,加入适量上述实验制备的水合碳酸镧进行测定,30min后测得溶液的吸光度为0.22,水合碳酸镧对磷酸盐的结合率为
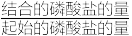 ×100%)。
×100%)。
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
名校
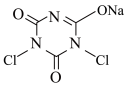
【推荐1】NaDCC(结构简式为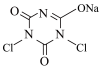 ),是一种优良的消毒剂。常温下,NaDCC为白色粉末或颗粒,性质稳定,受热易分解,难溶于冰水,在实验室中可通过以下反应和装置(夹持仪器略去)制取。
),是一种优良的消毒剂。常温下,NaDCC为白色粉末或颗粒,性质稳定,受热易分解,难溶于冰水,在实验室中可通过以下反应和装置(夹持仪器略去)制取。
原理: (氰尿酸)+2NaClO
(氰尿酸)+2NaClO
 +NaOH+H2O
+NaOH+H2O
实验装置:
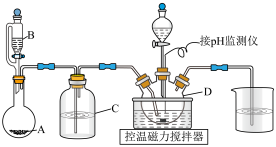
Ⅰ.制取NaDCC的实验步骤如下:
①向D中加入10mL40%NaOH溶液,水浴控温10℃左右,搅拌。
②A中加入KMnO4固体,B中加入浓盐酸,混合使之反应,打开磁力搅拌器。
③D中pH降至8左右时,向其中加入一定量氰尿酸,保持10℃左右,边搅拌边持续通入A中产生的气体,至D中有较多晶体析出,停止反应;
④将D中的混合物用冰水浴冷却,过滤,洗涤,低温晾干得到NaDCC晶体。
Ⅱ.NaDCC有效氯含量测定:
⑤用250mL碘量瓶称取0.2000gNaDCC晶体样品,加蒸馏水100mL,摇动至样品完全溶解,加适量的碘化钾和稀硫酸,避光放置5min。再用少量水冲洗碘量瓶瓶塞和瓶内壁。
⑥用滴定管快速滴入0.2000 Na2S2O3溶液至浅黄色时,加2滴指示剂后,继续滴定至终点,记录消耗Na2S2O3溶液的体积,重复三次,平均消耗Na2S2O3溶液16.76mL。
Na2S2O3溶液至浅黄色时,加2滴指示剂后,继续滴定至终点,记录消耗Na2S2O3溶液的体积,重复三次,平均消耗Na2S2O3溶液16.76mL。
⑦完成一次空白试验,消耗Na2S2O3溶液0.16mL。
已知:
样品有效氯=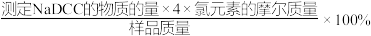
请回答下列问题:
(1)仪器B的名称是___________ 。制备NaDCC实验中使用仪器C的目的是为了提高___________ (填原料名称)的利用率。
(2)若步骤②中通入气体过快,仪器D中反应热量未及时散失,可生成较多NaClO3副产物,该副反应的离子方程式为___________ 。
(3)步骤④中洗涤的操作是___________ 。
(4)已知NaDCC在酸性环境中还原得到氰尿酸和氯化物,写出步骤⑤中样品加入适量的碘化钾和稀硫酸的离子反应方程式___________ 。
(5)步骤⑥中使用的最佳指示剂是___________ ,滴定终点的现象为溶液由___________ 变为___________ 。若变色后立即读取Na2S2O3溶液体积,则测定的样品有效氯含量结果___________ (填字母)。
A.一定偏大 B.一定偏小 C.可能偏大 D.可能偏小
(6)计算样品有效氯___________ %(保留四位有效数字)。
 ),是一种优良的消毒剂。常温下,NaDCC为白色粉末或颗粒,性质稳定,受热易分解,难溶于冰水,在实验室中可通过以下反应和装置(夹持仪器略去)制取。
),是一种优良的消毒剂。常温下,NaDCC为白色粉末或颗粒,性质稳定,受热易分解,难溶于冰水,在实验室中可通过以下反应和装置(夹持仪器略去)制取。原理:
 (氰尿酸)+2NaClO
(氰尿酸)+2NaClO
 +NaOH+H2O
+NaOH+H2O实验装置:

Ⅰ.制取NaDCC的实验步骤如下:
①向D中加入10mL40%NaOH溶液,水浴控温10℃左右,搅拌。
②A中加入KMnO4固体,B中加入浓盐酸,混合使之反应,打开磁力搅拌器。
③D中pH降至8左右时,向其中加入一定量氰尿酸,保持10℃左右,边搅拌边持续通入A中产生的气体,至D中有较多晶体析出,停止反应;
④将D中的混合物用冰水浴冷却,过滤,洗涤,低温晾干得到NaDCC晶体。
Ⅱ.NaDCC有效氯含量测定:
⑤用250mL碘量瓶称取0.2000gNaDCC晶体样品,加蒸馏水100mL,摇动至样品完全溶解,加适量的碘化钾和稀硫酸,避光放置5min。再用少量水冲洗碘量瓶瓶塞和瓶内壁。
⑥用滴定管快速滴入0.2000
 Na2S2O3溶液至浅黄色时,加2滴指示剂后,继续滴定至终点,记录消耗Na2S2O3溶液的体积,重复三次,平均消耗Na2S2O3溶液16.76mL。
Na2S2O3溶液至浅黄色时,加2滴指示剂后,继续滴定至终点,记录消耗Na2S2O3溶液的体积,重复三次,平均消耗Na2S2O3溶液16.76mL。⑦完成一次空白试验,消耗Na2S2O3溶液0.16mL。
已知:

样品有效氯=
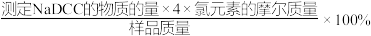
请回答下列问题:
(1)仪器B的名称是
(2)若步骤②中通入气体过快,仪器D中反应热量未及时散失,可生成较多NaClO3副产物,该副反应的离子方程式为
(3)步骤④中洗涤的操作是
(4)已知NaDCC在酸性环境中还原得到氰尿酸和氯化物,写出步骤⑤中样品加入适量的碘化钾和稀硫酸的离子反应方程式
(5)步骤⑥中使用的最佳指示剂是
A.一定偏大 B.一定偏小 C.可能偏大 D.可能偏小
(6)计算样品有效氯
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
【推荐2】由银(74%)、铅(25%)、锑(1%)等制成的合金是一种优良的电镀新材料。对其中的银的分析,可采用络合滴定法,具体分析步骤概括如下:
试样 沉淀(A)
沉淀(A) 溶液(B)
溶液(B) 溶液(C)
溶液(C) 溶液(D)
溶液(D)
其中(I)加入HNO3(1:1),煮沸,再加入HCl(1:9),煮沸,过滤,依次用HCl(1:9)和水洗涤沉淀;(II)加入浓氨水,过滤,用5%氨水洗涤沉淀;(III)加入氨水-氯化铵缓冲溶液(pH=10),再加入一定量的镍氰化钾固体;(IV)加入紫脲酸铵指示剂(简记为In),用乙二胺四乙酸二钠(简写为Na2H2Y)标准溶液滴定至近终点时,加入氨水10mL(为了使其终点明显),继续滴定至溶液颜色由黄色变为紫红色为终点。已知有关数据如下:
表1
表2
(1)写出A和D中Ag存在形体的化学式:A_______ 、D_______ 。
(2)写出第III步骤的主反应方程式_______ ,第IV步骤滴定终点时的反应方程式_______ 。
(3)试样加HNO3溶解后,为什么要煮沸_______ ?加入HCl(1:9)后为什么还要煮沸_______ ?
(4)假定溶液C中Ag(I)的总浓度为0.010mol/L,游离NH3浓度为2mol/L,要求滴定误差控制在0.2%以内,试计算溶液C中Ni(II)总浓度至少为_______ ?
试样
 沉淀(A)
沉淀(A) 溶液(B)
溶液(B) 溶液(C)
溶液(C) 溶液(D)
溶液(D)其中(I)加入HNO3(1:1),煮沸,再加入HCl(1:9),煮沸,过滤,依次用HCl(1:9)和水洗涤沉淀;(II)加入浓氨水,过滤,用5%氨水洗涤沉淀;(III)加入氨水-氯化铵缓冲溶液(pH=10),再加入一定量的镍氰化钾固体;(IV)加入紫脲酸铵指示剂(简记为In),用乙二胺四乙酸二钠(简写为Na2H2Y)标准溶液滴定至近终点时,加入氨水10mL(为了使其终点明显),继续滴定至溶液颜色由黄色变为紫红色为终点。已知有关数据如下:
表1
| 配合物 | [AgY]3- | [NiY]2- | [Ag(CN)2]- | [Ni(CN)4]2- | [Ag(NH3)2]+ | [Ni(NH3)6]2+ |
| lgK稳 | 7.32 | 18.62 | 21.1 | 31.3 | 7.05 | 8.74 |
| 酸 | H4Y | H3Y- | H2Y2- | HY3- |
| lgK稳 | -2.0 | -2.67 | -6.16 | -10.26 |
(2)写出第III步骤的主反应方程式
(3)试样加HNO3溶解后,为什么要煮沸
(4)假定溶液C中Ag(I)的总浓度为0.010mol/L,游离NH3浓度为2mol/L,要求滴定误差控制在0.2%以内,试计算溶液C中Ni(II)总浓度至少为
您最近一年使用:0次
解答题-原理综合题
|
困难
(0.15)
解题方法
【推荐3】一种测定黄铁矿(主要成分为FeS2,杂质不含硫)中硫含量的实验原理及步骤如下:

已知:I.2FeS2+15Na2O2 Fe2(SO4)3+Na2SO4+14Na2O;
Fe2(SO4)3+Na2SO4+14Na2O;
II.Pb2++ =PbSO4↓;
=PbSO4↓;
III.Pb2++H2Y2-=PbY2-+2H+。
回答下列问题:
(1)“氧化焙烧”时,每1molFeS2被完全氧化,转移电子的物质的量为_______ mol。
(2)已知KClO3氧化FeS2的反应速率更快,化学方程式为2FeS2+6KClO3 Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为
Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为_______ 。
(3)为保证黄铁矿充分氧化,“氯化焙烧”前需要采取的措施是_______ 。
(4)滴定分析步骤如下:
步骤1.浊液A静置后,取上层清液10.00mL,放入锥形瓶中,加适量水稀释;
步骤2.用硝酸调整其pH为3~4,滴入0.05mol·L-1的Pb(NO3)2标准溶液20.00mL,加热至充分反应;
步骤3.冷却、过滤、洗涤,将洗涤液与滤液合并;
步骤4.控制滤液pH约为5,加入指示剂,用cmol·L-1的H2Y2-(EDTA溶液)标准溶液滴定过量的Pb2+,滴定至终点时,消耗H2Y2-标准溶液VmL。
①在规格为50.00mL的滴定管中盛装H2Y2-溶液滴定时,若某一时刻的读数为15.00mL,此时滴定管中H2Y2-溶液的体积为_______ (填字母)。
a.15.00mL b.小于15.00mL c.35.00mL d.大于35.00mL
②黄铁矿中硫的质量分数为_______ (用含c、V的代数式表示)。
③下列情形下会使测得的硫的质量分数偏大的是_______ (填字母)。
a.步骤1锥形瓶洗净后,内部有少量蒸馏水
b.步骤2控制的pH较大,产生了少量碱式碳酸铅沉淀
c.步骤3沉淀未用蒸馏水充分洗涤
d.步骤4起始读数时平视。终点时仰视

已知:I.2FeS2+15Na2O2
 Fe2(SO4)3+Na2SO4+14Na2O;
Fe2(SO4)3+Na2SO4+14Na2O;II.Pb2++
 =PbSO4↓;
=PbSO4↓;III.Pb2++H2Y2-=PbY2-+2H+。
回答下列问题:
(1)“氧化焙烧”时,每1molFeS2被完全氧化,转移电子的物质的量为
(2)已知KClO3氧化FeS2的反应速率更快,化学方程式为2FeS2+6KClO3
 Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为
Fe(SO4)3+K2SO4+O2↑+4KCl+Cl2↑。该反应中还原产物为(3)为保证黄铁矿充分氧化,“氯化焙烧”前需要采取的措施是
(4)滴定分析步骤如下:
步骤1.浊液A静置后,取上层清液10.00mL,放入锥形瓶中,加适量水稀释;
步骤2.用硝酸调整其pH为3~4,滴入0.05mol·L-1的Pb(NO3)2标准溶液20.00mL,加热至充分反应;
步骤3.冷却、过滤、洗涤,将洗涤液与滤液合并;
步骤4.控制滤液pH约为5,加入指示剂,用cmol·L-1的H2Y2-(EDTA溶液)标准溶液滴定过量的Pb2+,滴定至终点时,消耗H2Y2-标准溶液VmL。
①在规格为50.00mL的滴定管中盛装H2Y2-溶液滴定时,若某一时刻的读数为15.00mL,此时滴定管中H2Y2-溶液的体积为
a.15.00mL b.小于15.00mL c.35.00mL d.大于35.00mL
②黄铁矿中硫的质量分数为
③下列情形下会使测得的硫的质量分数偏大的是
a.步骤1锥形瓶洗净后,内部有少量蒸馏水
b.步骤2控制的pH较大,产生了少量碱式碳酸铅沉淀
c.步骤3沉淀未用蒸馏水充分洗涤
d.步骤4起始读数时平视。终点时仰视
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
名校
解题方法
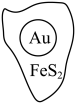
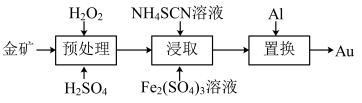
【推荐1】抗原检测盒中T线处使用的是胶体金(Au)标记物。一种从被 包裹的含金矿物(如图)中提取金单质的过程为:将金矿进行预处理,可除去
包裹的含金矿物(如图)中提取金单质的过程为:将金矿进行预处理,可除去 而露出金矿物,再加入
而露出金矿物,再加入 溶液和
溶液和 溶液对金矿物进行浸取,得到含金的溶液,然后加入
溶液对金矿物进行浸取,得到含金的溶液,然后加入 置换出
置换出 。其工艺流程如下:
。其工艺流程如下:
(1)①“预处理”时,用 将
将 直接氧化为
直接氧化为 和硫酸,写出该反应的化学方程式
和硫酸,写出该反应的化学方程式______ 。
②研究发现:在 的催化作用下,
的催化作用下, 产生具有强氧化能力的中间体
产生具有强氧化能力的中间体 ,
, 将金表面的
将金表面的 氧化溶出,
氧化溶出, 越多,
越多, 溶出率越高.
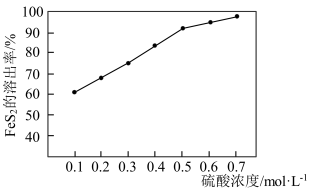
溶出率越高. 溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,
溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大, 溶出率逐渐提高的主要原因是
溶出率逐渐提高的主要原因是________ 。
(2)“置换”时需维持无氧环境,其主要原因是_________ 。
(3)测定样品中 的含量:准确称取
的含量:准确称取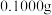 试样,加入王水,将样品中的
试样,加入王水,将样品中的 完全转化成具有强氧化性的氯金酸
完全转化成具有强氧化性的氯金酸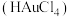 ,在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量
,在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量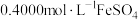 溶液
溶液 ,将
,将 完全还原为
完全还原为 ,滴加二苯胺磺酸钠作指示剂,用
,滴加二苯胺磺酸钠作指示剂,用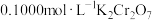 标准溶液滴定至终点(将剩余的
标准溶液滴定至终点(将剩余的 恰好完全氧化),消耗
恰好完全氧化),消耗 溶液
溶液 。
。
已知: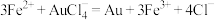

计算样品中金的质量分数(写出计算过程)_____________ 。
 包裹的含金矿物(如图)中提取金单质的过程为:将金矿进行预处理,可除去
包裹的含金矿物(如图)中提取金单质的过程为:将金矿进行预处理,可除去 而露出金矿物,再加入
而露出金矿物,再加入 溶液和
溶液和 溶液对金矿物进行浸取,得到含金的溶液,然后加入
溶液对金矿物进行浸取,得到含金的溶液,然后加入 置换出
置换出 。其工艺流程如下:
。其工艺流程如下:

(1)①“预处理”时,用
 将
将 直接氧化为
直接氧化为 和硫酸,写出该反应的化学方程式
和硫酸,写出该反应的化学方程式②研究发现:在
 的催化作用下,
的催化作用下, 产生具有强氧化能力的中间体
产生具有强氧化能力的中间体 ,
, 将金表面的
将金表面的 氧化溶出,
氧化溶出, 越多,
越多, 溶出率越高.
溶出率越高. 溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,
溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大, 溶出率逐渐提高的主要原因是
溶出率逐渐提高的主要原因是
(2)“置换”时需维持无氧环境,其主要原因是
(3)测定样品中
 的含量:准确称取
的含量:准确称取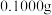 试样,加入王水,将样品中的
试样,加入王水,将样品中的 完全转化成具有强氧化性的氯金酸
完全转化成具有强氧化性的氯金酸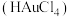 ,在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量
,在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量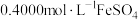 溶液
溶液 ,将
,将 完全还原为
完全还原为 ,滴加二苯胺磺酸钠作指示剂,用
,滴加二苯胺磺酸钠作指示剂,用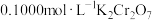 标准溶液滴定至终点(将剩余的
标准溶液滴定至终点(将剩余的 恰好完全氧化),消耗
恰好完全氧化),消耗 溶液
溶液 。
。已知:
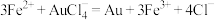

计算样品中金的质量分数(写出计算过程)
您最近一年使用:0次



