[化学一选修2:化学与技术]海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和________ 池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜 只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用_______ (写一点即可)。
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。
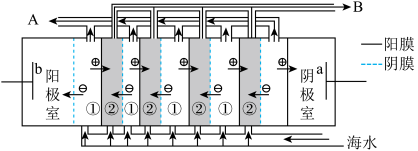
①海水不能直接通入到阴极室中,理由是______________ .
②A口排出的是_______ (填“淡水”或“浓水”)。
(3)用苦卤(含 Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
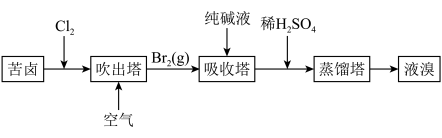
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为___________ 。
②通过苦卤中通入Cl2已获得含溴的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液________ 。
③向蒸馏塔中通入水蒸气加热,控制温度在90 左右进行蒸馏的原因是
左右进行蒸馏的原因是___________ 。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜 只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。

①海水不能直接通入到阴极室中,理由是
②A口排出的是
(3)用苦卤(含 Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:

①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为
②通过苦卤中通入Cl2已获得含溴的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液
③向蒸馏塔中通入水蒸气加热,控制温度在90
 左右进行蒸馏的原因是
左右进行蒸馏的原因是
2014·湖南怀化·一模 查看更多[9]
2020届高中化学第一轮复习第十三章《化学与技术》测试卷2017届山西省重点中学协作体高三上期中化学试卷2017届河南省鹤壁高级中学高三上第一次周练化学试卷2016届河北省衡水中学高三上学期七调考试化学试卷2015届河北省石家庄市高三下学期二模考试理综化学试卷2015届湖北省武汉市武昌区高三元月调考理综化学试卷(已下线)2013-2014辽宁省大连八中高三仿真测试理科综合化学试卷(已下线)2014届湖南省十三校高三第二次联考理综化学试卷(已下线)2014届湖南省怀化市高三第一次模拟考试理综化学试卷
更新时间:2019-01-30 18:14:09
|
相似题推荐
【推荐1】碘在生活和科研中有重要的应用。
(1)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。
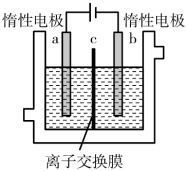
先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为____ 。电解过程中b电极附近溶液的pH____ (填“增大”或“减小”)
(2)已知:①I2(aq) I2(CCl4) K1=85
I2(CCl4) K1=85
②I2(aq)+I-(aq) I
I (aq) K2≈1000
(aq) K2≈1000
③I2(g)+H2(g) 2HI(g) ΔH=-9.48kJ·mol-1
2HI(g) ΔH=-9.48kJ·mol-1
④W(s)+I2(g) WI2(g) ΔH<0
WI2(g) ΔH<0
常温下,把溶解在H2O的I2提取到CCl4中的方法叫萃取,①正向移动,碘单质在水和CCl4混合液中存在①的溶解平衡,萃取时通常采用“少量多次”的目的是____ 。
(3)常温下,10mL0.1mol·L-1KI水溶液加入一定量的碘单质,加入10mLCCl4进行萃取,静置分层(实验过程中不考虑体积变化)。已知:I-和I 不溶于CCl4,实验测得CCl4层液体中c(I2)=0.085mol·L-1,则水层中c(I-)=
不溶于CCl4,实验测得CCl4层液体中c(I2)=0.085mol·L-1,则水层中c(I-)=____ mol·L-1。
(4)反应③在一定条件下速率方程:v正=Kc(I2)c(H2),K为速率常数,下列说法正确的是____ 。
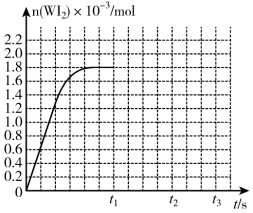
(5)在碘钨灯灯泡内封存少量的碘可以延长钨丝寿命,发生反应④,为模拟上述反应,取0.004mol碘和0.004mol钨放置在50.0mL密闭容器中反应,在450℃,n(WI2)随时间变化图象如图所示,t1时,将温度升高到530℃,t2时达到平衡(530℃平衡常数K=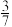 )。请在图中画出n(WI2)从t1~t3随时间变化图象
)。请在图中画出n(WI2)从t1~t3随时间变化图象____ 。
(1)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。

先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为
(2)已知:①I2(aq)
 I2(CCl4) K1=85
I2(CCl4) K1=85②I2(aq)+I-(aq)
 I
I (aq) K2≈1000
(aq) K2≈1000③I2(g)+H2(g)
 2HI(g) ΔH=-9.48kJ·mol-1
2HI(g) ΔH=-9.48kJ·mol-1④W(s)+I2(g)
 WI2(g) ΔH<0
WI2(g) ΔH<0常温下,把溶解在H2O的I2提取到CCl4中的方法叫萃取,①正向移动,碘单质在水和CCl4混合液中存在①的溶解平衡,萃取时通常采用“少量多次”的目的是
(3)常温下,10mL0.1mol·L-1KI水溶液加入一定量的碘单质,加入10mLCCl4进行萃取,静置分层(实验过程中不考虑体积变化)。已知:I-和I
 不溶于CCl4,实验测得CCl4层液体中c(I2)=0.085mol·L-1,则水层中c(I-)=
不溶于CCl4,实验测得CCl4层液体中c(I2)=0.085mol·L-1,则水层中c(I-)=(4)反应③在一定条件下速率方程:v正=Kc(I2)c(H2),K为速率常数,下列说法正确的是
| A.反应③的ΔS=0 |
| B.反应③I2平衡转化率随温度升高变大 |
| C.升高温度速率常数k变大 |
| D.混合气体颜色不变时,反应已达到平衡状态 |
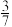 )。请在图中画出n(WI2)从t1~t3随时间变化图象
)。请在图中画出n(WI2)从t1~t3随时间变化图象
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】研究氮氧化物反应机理,对于控制汽车尾气、保护环境有重要意义。
(1)NO在空气中存在如下反应:2NO(g) + O2(g) 2NO2(g) ΔH,上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示): ① 2NO(g)
2NO2(g) ΔH,上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示): ① 2NO(g)  N2O2(g)ΔH1<0,②
N2O2(g)ΔH1<0,② ___________ ;
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为: 4NH3(g)+6NO(g) 5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示。
5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示。
①在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2所示,据图可知,在相同的时间内,300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小(催化剂均末失效),写出300℃之后脱氮率减小的原因是_________ 。
②其他条件相同时,请在图中补充在催化剂B作用下脱氮率随温度变化的曲线________ 。
(3)工业制HNO3的尾气中含有的NO2和NO常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,现有平均组成为NOx的NO、NO2混合气体,通入足量的NaOH溶液中,充分反应后没有气体剩余,则:
①x的取值范围为_________________ 。
②反应后溶液中n(NO2-)︰n(NO3-)=____________________ 。(用含x的代数式表示)
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图示,两电极间是新型固体氧化物陶瓷,在一定条件下可自由传导O2-,电解池阴极反应为___ 。
(1)NO在空气中存在如下反应:2NO(g) + O2(g)
 2NO2(g) ΔH,上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示): ① 2NO(g)
2NO2(g) ΔH,上述反应分两步完成,其中第一步反应①如下,写出第二步反应②的热化学方程式(其反应的焓变ΔH2用含ΔH、ΔH1的式子来表示): ① 2NO(g)  N2O2(g)ΔH1<0,②
N2O2(g)ΔH1<0,② (2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应的热化学方程式为: 4NH3(g)+6NO(g)
 5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示。
5N2(g)+6H2O(g)△H=-1811.63KJ/mol;反应在恒容密闭容器中进行,在其它相条件同时,选用不同的催化剂,反应产生N2的物质的量随时间变化如图所示。
①在催化剂A的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如图2所示,据图可知,在相同的时间内,300℃之前,温度升高脱氮率逐渐增大,300℃之后温度升高脱氮率逐渐减小(催化剂均末失效),写出300℃之后脱氮率减小的原因是
②其他条件相同时,请在图中补充在催化剂B作用下脱氮率随温度变化的曲线

(3)工业制HNO3的尾气中含有的NO2和NO常用NaOH溶液吸收,反应的化学方程式为:NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO2+NaNO3+H2O,现有平均组成为NOx的NO、NO2混合气体,通入足量的NaOH溶液中,充分反应后没有气体剩余,则:
①x的取值范围为
②反应后溶液中n(NO2-)︰n(NO3-)=
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如图示,两电极间是新型固体氧化物陶瓷,在一定条件下可自由传导O2-,电解池阴极反应为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】84消毒液(有效成分NaClO)和医用酒精(75%的乙醇水溶液)都能用于杀菌消毒。
Ⅰ.84消毒液的制备:
(1)在实验室利用如图装置(电极材料为惰性电极)制备少量84消毒液,则a为电源的___________ 极(填“正”或“负”)。为提高NaClO的稳定性并抑制其水解,可向其溶液中加入少量___________ (填化学式)。
Ⅱ.对于网传的“84消毒液与酒精混用会产生氯气”的说法,某小组进行了如下活动。
查阅资料:
①乙醇能与NaClO发生一系列的复杂反应,可能生成氯气、乙醛、乙酸、氯仿等;
②乙醛具有强还原性,可以被NaClO、新制Cu(OH)2悬浊液等氧化。
实验探究:
采用某品牌的84消毒液和乙醇溶液按如图装置进行实验(加热及加持仪器略)。

(2)仪器A的作用是___________ ,为使C中乙醛(CH3CHO)含量较高,B中盛放的试剂为___________ 。实验室稀释84消毒液需要的玻璃仪器有___________ 。
(3)实验①和②中,仪器D中不变色的原因可能是:___________ 。
(4)有同学认为实验④产生的大量气泡中除Cl2外,还可能含有O2,产生的原因是___________ 。(用化学方程式表示)。
(5)试写出NaClO与C2H5OH反应生成CH3CHO的化学方程式___________ 。
Ⅰ.84消毒液的制备:
(1)在实验室利用如图装置(电极材料为惰性电极)制备少量84消毒液,则a为电源的

Ⅱ.对于网传的“84消毒液与酒精混用会产生氯气”的说法,某小组进行了如下活动。
查阅资料:
①乙醇能与NaClO发生一系列的复杂反应,可能生成氯气、乙醛、乙酸、氯仿等;
②乙醛具有强还原性,可以被NaClO、新制Cu(OH)2悬浊液等氧化。
实验探究:
采用某品牌的84消毒液和乙醇溶液按如图装置进行实验(加热及加持仪器略)。

| 编号. | ① | ② | ③ | ④ |
| 实验 | 75%乙醇与稀释100倍84消毒液,不加热 | 75%乙醇与稀释100倍84消毒液, 加热 | 95%乙醇与不稀释84消毒液,不加热 | 95% 乙醇与不稀释84消毒液,加热 |
| 仪器C中 | 无明显现象 | 无明显现象 | 少量气泡生成 | 大量气泡生成 |
| 仪器D中 | 不变色 | 不变色 | 变浅 | 变浅 |
(3)实验①和②中,仪器D中不变色的原因可能是:
(4)有同学认为实验④产生的大量气泡中除Cl2外,还可能含有O2,产生的原因是
(5)试写出NaClO与C2H5OH反应生成CH3CHO的化学方程式
您最近一年使用:0次
【推荐1】请按要求回答下列问题:
(1)甲烷的标准燃烧热为 kJ⋅mol
kJ⋅mol ,则表示甲烷燃烧热的热化学方程式:
,则表示甲烷燃烧热的热化学方程式:__________________ 。
(2)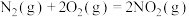
 kJ/mol
kJ/mol
 kJ/mol
kJ/mol
写出 与
与 反应生成
反应生成 和水蒸气的热化学反应方程式
和水蒸气的热化学反应方程式_________________________________ 。
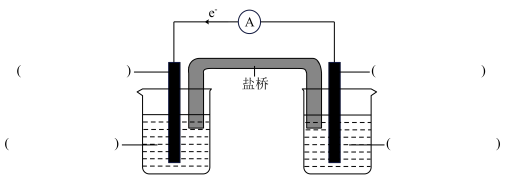
(3)铁片镀铜实验中(装置如图所示),b接电源的______ 极,铁片上发生的电极反应式为______________ 。电镀过程中
______ (填“变大”、“变小”或“基本保持不变”)。

(4)新冠疫情期间,某同学设计了一个电解装置如图,用于制备“84”消毒液的有效成分,则c为电源的______ 极;该发生器阴极电极反应式为________________________ 。
(5)如图装置利用 与Cu发生的反应,设计一个可正常工作的电池,补全该电化学装置示意图
与Cu发生的反应,设计一个可正常工作的电池,补全该电化学装置示意图________________ 。(供选择的实验用品为:石墨棒、铜棒、 溶液、
溶液、 溶液)
溶液)
(1)甲烷的标准燃烧热为
 kJ⋅mol
kJ⋅mol ,则表示甲烷燃烧热的热化学方程式:
,则表示甲烷燃烧热的热化学方程式:(2)
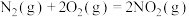
 kJ/mol
kJ/mol
 kJ/mol
kJ/mol写出
 与
与 反应生成
反应生成 和水蒸气的热化学反应方程式
和水蒸气的热化学反应方程式(3)铁片镀铜实验中(装置如图所示),b接电源的


(4)新冠疫情期间,某同学设计了一个电解装置如图,用于制备“84”消毒液的有效成分,则c为电源的
(5)如图装置利用
 与Cu发生的反应,设计一个可正常工作的电池,补全该电化学装置示意图
与Cu发生的反应,设计一个可正常工作的电池,补全该电化学装置示意图 溶液、
溶液、 溶液)
溶液)
您最近一年使用:0次
【推荐2】CuCl 晶体微溶于水和稀硫酸,不溶于乙醇,但易溶于浓盐酸和氯化铵溶液,发生的反应为:CuCl+Cl- CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:
CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:
(1)实验室保存新制CuCl 晶体的方法是__________ 。
(2)向硫酸铜溶液中加入亚硫酸铵和氯化铵,会发生反应生成CuCl。
①该反应的离子方程式为_____________ 。
②(NH4)2SO3要适当过量,目的为保证Cu2+的还原速率、_____________ 。
③已知Cu2+的沉淀率与NH4Cl、CuSO4的物质的量之比[n(NH4Cl)/n(CuSO4)]的关系如图甲所示,当氯化铵用量增加到一定程度后,Cu2+的沉淀率减小,原因是_______________ 。

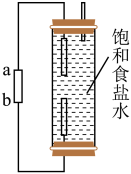
(3)已知:CuCl 固体、CuOH 固体分别为白色和橙黄色,且Ksp(CuCl)= 1.2×10-6,Ksp(CuOH)=1.2×10-14。用铜电极电解饱和食盐水的装置如图乙所示,阳极的电极反应式为Cu-e-+Cl -=CuCl。则实验过程中的实验现象为_________________ 。
 CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:
CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:(1)实验室保存新制CuCl 晶体的方法是
(2)向硫酸铜溶液中加入亚硫酸铵和氯化铵,会发生反应生成CuCl。
①该反应的离子方程式为
②(NH4)2SO3要适当过量,目的为保证Cu2+的还原速率、
③已知Cu2+的沉淀率与NH4Cl、CuSO4的物质的量之比[n(NH4Cl)/n(CuSO4)]的关系如图甲所示,当氯化铵用量增加到一定程度后,Cu2+的沉淀率减小,原因是

(3)已知:CuCl 固体、CuOH 固体分别为白色和橙黄色,且Ksp(CuCl)= 1.2×10-6,Ksp(CuOH)=1.2×10-14。用铜电极电解饱和食盐水的装置如图乙所示,阳极的电极反应式为Cu-e-+Cl -=CuCl。则实验过程中的实验现象为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程如示意图所示,完成下列填空:

(1)在电解过程中,与电源负极相连的电极上的电极反应式为________________ ,若检验与电源正极相连的电极上的气体产物,实验室中通常选用的化学试剂是________ 。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为___________________
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是_____ (选填a、b、c)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为________ (选填a、b、c)。
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过蒸发浓缩、冷却、________ (填写操作名称)除去NaCl。
(6)在电解过程中,发生总反应的化学方程式为__________________
(7)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应,请写出Cl2和NaOH溶液反应的化学方程式__________ 。

(1)在电解过程中,与电源负极相连的电极上的电极反应式为
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)为了有效地除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
a.先加NaOH,后加Na2CO3,再加钡试剂
b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过蒸发浓缩、冷却、
(6)在电解过程中,发生总反应的化学方程式为
(7)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2和NaOH反应,请写出Cl2和NaOH溶液反应的化学方程式
您最近一年使用:0次
【推荐1】海带中含丰富的碘。为了从海带中提碘,某研究性学习小组设计并进行了以下实验:

(1)步骤⑤中,向含碘水溶液中加入苯,充分振荡静置后看到的现象是________
(2)有关上述实验方案说法正确的是_____
(3)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_______ ,最后碘在_______ (填仪器名称)中得到。
(4)简述检验提取碘后的水溶液中是否还含有单质碘的方法_______ 。
(5)写出步骤④所发生的反应的离子方程式_______ 。

(1)步骤⑤中,向含碘水溶液中加入苯,充分振荡静置后看到的现象是________
| A.液体分为两层,上层紫色,下层无色 |
| B.液体不分层,呈浅棕色 |
| C.液体不分层,呈无色 |
| D.液体分为两层,上是无色,下层紫色 |
| A.步骤①的操作可以在烧瓶中进行 |
| B.步骤②可以适当加热以提升单位时间内的浸取率 |
| C.步骤③⑤的操作分别是过滤、萃取 |
| D.步骤⑤加入的有机溶剂可以更换为四氯化碳 |
(4)简述检验提取碘后的水溶液中是否还含有单质碘的方法
(5)写出步骤④所发生的反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】中国沿海某城市采用反渗透法将海水淡化,得到淡水供市民使用,剩余母液继续加工获得其他产品。某实验小组同学模拟工业生产流程,进行如下实验。
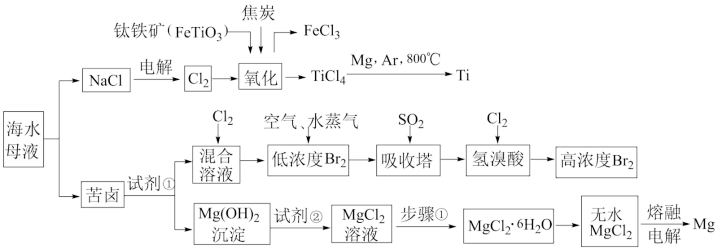
回答下列问题:
(1)海水淡化的方法还有___________ (写出一种)。
(2)制取Br2时第一次通入Cl2时发生反应的离子方程式是___________ 。
(3)吸收塔中反应的离子方程式是___________ 。
(4)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用___________ (写化学式)。
(5)加入试剂②后反应的离子方程式是___________ 。
(6)步骤①包括加热、蒸发、冷却、结晶、___________ 。
(7)若要验证所得无水MgCl2中不含NaCl,最简单的方法是___________ 。
(8)通电时无水MgCl2在熔融状态下反应的化学方程式是___________ 。
(9)写出钛铁矿在高温下经氧化得到四氯化钛的化学方程式___________ 。
(10)由TiCl4 Ti需要在Ar气中进行的理由是
Ti需要在Ar气中进行的理由是___________ 。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于___________ ℃即可。

回答下列问题:
(1)海水淡化的方法还有
(2)制取Br2时第一次通入Cl2时发生反应的离子方程式是
(3)吸收塔中反应的离子方程式是
(4)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用
(5)加入试剂②后反应的离子方程式是
(6)步骤①包括加热、蒸发、冷却、结晶、
(7)若要验证所得无水MgCl2中不含NaCl,最简单的方法是
(8)通电时无水MgCl2在熔融状态下反应的化学方程式是
(9)写出钛铁矿在高温下经氧化得到四氯化钛的化学方程式
(10)由TiCl4
 Ti需要在Ar气中进行的理由是
Ti需要在Ar气中进行的理由是| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】近年来,新能源汽车和储能技术快速发展,锂盐消耗飞速增长。中国拥有丰富的锂资源,以盐湖卤水(主要含NaCl、MgCl2和LiCl等)通过煅烧法提取锂的工艺流程如图所示,回答下列问题。

已知:①喷雾干燥后所得固体中含有NaCl、LiCl、MgCl2∙6H2O等;
②20℃时,相关物质的溶解度如下:
(1)Mg的原子结构示意图为___________ 。
(2) MgCl2∙6H2O在煅烧时会产生HCl气体,则该反应的化学方程式为___________ ,HCl为___________ (填“离子化合物”或“共价化合物”)。
(3)加入碳酸钠时,发生反应的离子方程式为___________ ,从浊液中获得Li2CO3固体的操作是___________ 。
(4)该工艺的不足之处为___________ (填一点即可)。

已知:①喷雾干燥后所得固体中含有NaCl、LiCl、MgCl2∙6H2O等;
②20℃时,相关物质的溶解度如下:
| 化合物 | 溶解度/(g/L) |
| NaCl | 360 |
| LiCl | 832 |
| Na2CO3 | 218 |
| Li2CO3 | 13.3 |
(1)Mg的原子结构示意图为
(2) MgCl2∙6H2O在煅烧时会产生HCl气体,则该反应的化学方程式为
(3)加入碳酸钠时,发生反应的离子方程式为
(4)该工艺的不足之处为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】海洋是一个巨大的化学资源宝库。海水资源综合利用的部分过程如下图所示:

回答下列问题:
(1)粗盐中含有 、
、 、
、 等可溶性杂质。根据除杂原理,在表中填写“除杂”时依次添加的试剂及其预期沉淀的离子。
等可溶性杂质。根据除杂原理,在表中填写“除杂”时依次添加的试剂及其预期沉淀的离子。
(2)操作X为___________ 。
(3)镁可从母液中提取。工业上由无水 制取
制取 的化学方程式为
的化学方程式为________ 。
(4)海水提溴工艺流程主要包括氧化、吹出、吸收、分离等环节。
①向母液中通入适量的 ,其目的是
,其目的是___________ (用离子方程式表示)。
②已知溴的沸点为59℃。上述流程中“操作Ⅰ”应为___________ 。
(5)下列有关说法正确的是___________。

回答下列问题:
(1)粗盐中含有
 、
、 、
、 等可溶性杂质。根据除杂原理,在表中填写“除杂”时依次添加的试剂及其预期沉淀的离子。
等可溶性杂质。根据除杂原理,在表中填写“除杂”时依次添加的试剂及其预期沉淀的离子。| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 |  溶液 溶液 |  |
| 步骤2 | ||
| 步骤3 |
(3)镁可从母液中提取。工业上由无水
 制取
制取 的化学方程式为
的化学方程式为(4)海水提溴工艺流程主要包括氧化、吹出、吸收、分离等环节。
①向母液中通入适量的
 ,其目的是
,其目的是②已知溴的沸点为59℃。上述流程中“操作Ⅰ”应为
(5)下列有关说法正确的是___________。
A.海水中含量最多的元素是 、 、 |
| B.海水淡化的主要方法有蒸馏法、电渗析法和离子交换法 |
| C.电解饱和食盐水过程中既发生氧化反应又发生还原反应 |
| D.海水提溴工艺中“吹出”和“吸收”两环节的目的是富集溴 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图:

(1)请列举海水淡化的两种方法:___ 、___ 。
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-。其目的是___ 。
(3)步骤II用SO2水溶液吸收Br2,吸收率可达95%。有关反应的离子方程式为___ 。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法。查阅了有关资料知:Br2的沸点为59℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如图装置简图:

请你参与分析讨论:
①图中仪器B的名称是___ 。
②整套实验装皿中仪器连接均不能用橡胶塞和橡胶管。其原因是___ 。
③C中液体颜色为___ 。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr,溶液,充分反应后。再进行的分离操作是___ 。

(1)请列举海水淡化的两种方法:
(2)步骤I中已获得Br2,步骤II中又将Br2还原为Br-。其目的是
(3)步骤II用SO2水溶液吸收Br2,吸收率可达95%。有关反应的离子方程式为
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法。查阅了有关资料知:Br2的沸点为59℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如图装置简图:

请你参与分析讨论:
①图中仪器B的名称是
②整套实验装皿中仪器连接均不能用橡胶塞和橡胶管。其原因是
③C中液体颜色为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】海洋是一个巨大的化学资源宝库。一种工业上从海水中提取溴的工艺流程如下图所示: ;
;
吸收环节发生的主要反应为: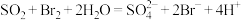 。
。
请回答下列问题:
(1)在吸收环节发生的主要反应中, 是
是___________ (填“氧化剂”或“还原剂”)。
(2)常温下, 为深红棕色液体,说明
为深红棕色液体,说明 的沸点比
的沸点比 的
的___________ (填“高”或“低”)。
(3)该工艺通过氧化、吹出、吸收、蒸馏等环节获得 (溴元素经历了“
(溴元素经历了“ ”的转化),而不是在氧化环节后直接蒸馏得到
”的转化),而不是在氧化环节后直接蒸馏得到 ,其原因是
,其原因是___________ (填字母)。
a.海水中 浓度较低,需富集 b.海水中
浓度较低,需富集 b.海水中 浓度很高,需稀释
浓度很高,需稀释
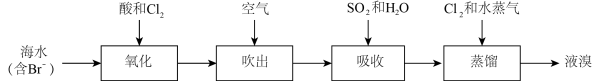
 ;
;吸收环节发生的主要反应为:
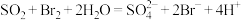 。
。请回答下列问题:
(1)在吸收环节发生的主要反应中,
 是
是(2)常温下,
 为深红棕色液体,说明
为深红棕色液体,说明 的沸点比
的沸点比 的
的(3)该工艺通过氧化、吹出、吸收、蒸馏等环节获得
 (溴元素经历了“
(溴元素经历了“ ”的转化),而不是在氧化环节后直接蒸馏得到
”的转化),而不是在氧化环节后直接蒸馏得到 ,其原因是
,其原因是a.海水中
 浓度较低,需富集 b.海水中
浓度较低,需富集 b.海水中 浓度很高,需稀释
浓度很高,需稀释
您最近一年使用:0次



