碘在生活和科研中有重要的应用。
(1)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。
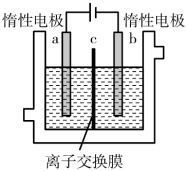
先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为____ 。电解过程中b电极附近溶液的pH____ (填“增大”或“减小”)
(2)已知:①I2(aq) I2(CCl4) K1=85
I2(CCl4) K1=85
②I2(aq)+I-(aq) I
I (aq) K2≈1000
(aq) K2≈1000
③I2(g)+H2(g) 2HI(g) ΔH=-9.48kJ·mol-1
2HI(g) ΔH=-9.48kJ·mol-1
④W(s)+I2(g) WI2(g) ΔH<0
WI2(g) ΔH<0
常温下,把溶解在H2O的I2提取到CCl4中的方法叫萃取,①正向移动,碘单质在水和CCl4混合液中存在①的溶解平衡,萃取时通常采用“少量多次”的目的是____ 。
(3)常温下,10mL0.1mol·L-1KI水溶液加入一定量的碘单质,加入10mLCCl4进行萃取,静置分层(实验过程中不考虑体积变化)。已知:I-和I 不溶于CCl4,实验测得CCl4层液体中c(I2)=0.085mol·L-1,则水层中c(I-)=
不溶于CCl4,实验测得CCl4层液体中c(I2)=0.085mol·L-1,则水层中c(I-)=____ mol·L-1。
(4)反应③在一定条件下速率方程:v正=Kc(I2)c(H2),K为速率常数,下列说法正确的是____ 。
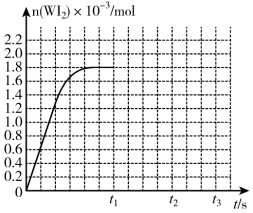
(5)在碘钨灯灯泡内封存少量的碘可以延长钨丝寿命,发生反应④,为模拟上述反应,取0.004mol碘和0.004mol钨放置在50.0mL密闭容器中反应,在450℃,n(WI2)随时间变化图象如图所示,t1时,将温度升高到530℃,t2时达到平衡(530℃平衡常数K=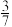 )。请在图中画出n(WI2)从t1~t3随时间变化图象
)。请在图中画出n(WI2)从t1~t3随时间变化图象____ 。
(1)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。

先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为
(2)已知:①I2(aq)
 I2(CCl4) K1=85
I2(CCl4) K1=85②I2(aq)+I-(aq)
 I
I (aq) K2≈1000
(aq) K2≈1000③I2(g)+H2(g)
 2HI(g) ΔH=-9.48kJ·mol-1
2HI(g) ΔH=-9.48kJ·mol-1④W(s)+I2(g)
 WI2(g) ΔH<0
WI2(g) ΔH<0常温下,把溶解在H2O的I2提取到CCl4中的方法叫萃取,①正向移动,碘单质在水和CCl4混合液中存在①的溶解平衡,萃取时通常采用“少量多次”的目的是
(3)常温下,10mL0.1mol·L-1KI水溶液加入一定量的碘单质,加入10mLCCl4进行萃取,静置分层(实验过程中不考虑体积变化)。已知:I-和I
 不溶于CCl4,实验测得CCl4层液体中c(I2)=0.085mol·L-1,则水层中c(I-)=
不溶于CCl4,实验测得CCl4层液体中c(I2)=0.085mol·L-1,则水层中c(I-)=(4)反应③在一定条件下速率方程:v正=Kc(I2)c(H2),K为速率常数,下列说法正确的是
| A.反应③的ΔS=0 |
| B.反应③I2平衡转化率随温度升高变大 |
| C.升高温度速率常数k变大 |
| D.混合气体颜色不变时,反应已达到平衡状态 |
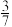 )。请在图中画出n(WI2)从t1~t3随时间变化图象
)。请在图中画出n(WI2)从t1~t3随时间变化图象
更新时间:2022-02-21 17:05:10
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】一定温度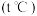 下,向
下,向 密闭容器中通入
密闭容器中通入 和
和 各
各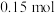 ,发生如下反应:
,发生如下反应: 一段时间后达到平衡,测得数据如下:
一段时间后达到平衡,测得数据如下:
请回答:
(1) 内,
内,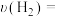
___________  。
。
(2)下列能证明该反应已经达到平衡的是___________ (填字母)。
a. b.混合气体的颜色不再发生变化
b.混合气体的颜色不再发生变化
c.混合气体中各组分的物质的量不再发生变化 d.混合气体的密度不再变化。
(3)①该反应的化学平衡常数表达式为___________ 。② 的平衡转化率是
的平衡转化率是___________ 。
(4)升高温度,化学平衡常数K要___________ (填“变大”或“变小”)。
(5)该温度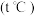 下,若开始通入一定量的
下,若开始通入一定量的 和
和 ,反应达到平衡时,测得
,反应达到平衡时,测得 ,
,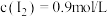 ,则平衡时
,则平衡时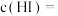
___________  。
。
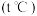 下,向
下,向 密闭容器中通入
密闭容器中通入 和
和 各
各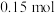 ,发生如下反应:
,发生如下反应: 一段时间后达到平衡,测得数据如下:
一段时间后达到平衡,测得数据如下: | 2 | 4 | 7 | 9 |
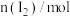 | 0.12 | 0.11 | 0.10 | 0.10 |
请回答:
(1)
 内,
内,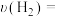
 。
。(2)下列能证明该反应已经达到平衡的是
a.
 b.混合气体的颜色不再发生变化
b.混合气体的颜色不再发生变化c.混合气体中各组分的物质的量不再发生变化 d.混合气体的密度不再变化。
(3)①该反应的化学平衡常数表达式为
 的平衡转化率是
的平衡转化率是(4)升高温度,化学平衡常数K要
(5)该温度
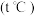 下,若开始通入一定量的
下,若开始通入一定量的 和
和 ,反应达到平衡时,测得
,反应达到平衡时,测得 ,
,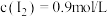 ,则平衡时
,则平衡时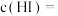
 。
。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】CO2可用于合成多种化工原料。用 CO2生产绿色燃料甲醇时发生反应A: CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1
(1)反应 A 的平衡常数表达式是_____ 。在恒温恒容的密闭容器中进行该反应,下列说法正确的是_____ (填字母)。
A.反应达到平衡时,容器的总压强不再改变
B.加入合适的催化剂,可以提高 CO2的转化率
C.将初始投料增加 1 倍,可以提高CO2的转化率
D.充入一定量的He 气,可以提高CO2的转化率
(2)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2平衡转化率影响的曲线。
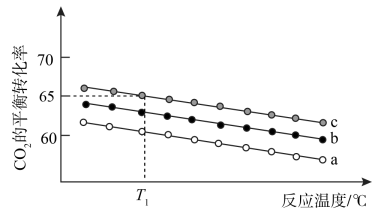
① 反应 A 的ΔH1_____ 0(填“>”或“<”)。
② 曲线 c 对应的投料是_____ 。
③ T1℃时,曲线c 对应的化学平衡常数_____ 1(填“大于”、“小于”或“等于”)。
(3)在一定条件下,利用 CO2合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)⇌CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2和H2按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对 CO2的转化率影响如图 2 所示。
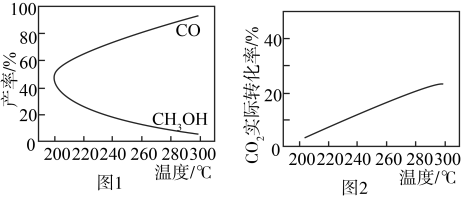
由图象可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是_____ 。
(4)以 CO2和 H2O 为原料合成 CH4,可以借助氮化镓(GaN)与 Cu 组成的人工光合系统, 装置如图所示。
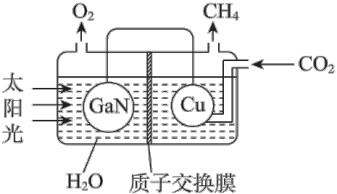
① GaN 电极上的电极反应式是_____ 。
② 当有 0.4mol 电子转移时,铜电极上生成的CH4在标准状况下的体积是_____ L。
(1)反应 A 的平衡常数表达式是
A.反应达到平衡时,容器的总压强不再改变
B.加入合适的催化剂,可以提高 CO2的转化率
C.将初始投料增加 1 倍,可以提高CO2的转化率
D.充入一定量的He 气,可以提高CO2的转化率
(2)在体积为 1 L 的恒容密闭容器中发生反应 A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对 CO2平衡转化率影响的曲线。

① 反应 A 的ΔH1
② 曲线 c 对应的投料是
③ T1℃时,曲线c 对应的化学平衡常数
(3)在一定条件下,利用 CO2合成 CH3OH 的反应过程中会有副反应:CO2(g) + H2(g)⇌CO(g) + H2O(g)。压强一定时,将初始投料比一定的 CO2和H2按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 CH3OH、CO 的产率影响如图 1 所示,温度对 CO2的转化率影响如图 2 所示。

由图象可知,升高温度,CO2的实际转化率提高而甲醇的产率降低,其原因是
(4)以 CO2和 H2O 为原料合成 CH4,可以借助氮化镓(GaN)与 Cu 组成的人工光合系统, 装置如图所示。

① GaN 电极上的电极反应式是
② 当有 0.4mol 电子转移时,铜电极上生成的CH4在标准状况下的体积是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】氢能是一种清洁能源,按照生产过程中的碳排放情况分为灰氢、蓝氢和绿氢。
(1)煤的气化制得灰氢 :C(s)+H2O(g) CO(g)+H2(g)。该反应的平衡常数表达式K=
CO(g)+H2(g)。该反应的平衡常数表达式K=_____ 。该方法生产过程有CO2排放。
(2)甲烷水蒸气催化重整制得蓝氢 ,步骤如下。
I.H2的制取:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0
①为提高CH4的平衡转化率,可采取的措施有_____ (写出两条即可)。
II.H2的富集:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0
②已知830℃时,该反应的平衡常数K=1.在容积不变的密闭容器中,将2molCO与8molH2O混合加热到830℃,反应达平衡时CO的转化率为_____ 。
III.用 吸收CO2实现低碳排放。
吸收CO2实现低碳排放。 消耗率随时间变化关系如图所示。
消耗率随时间变化关系如图所示。
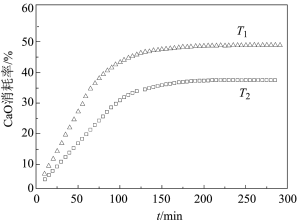
③比较温度高低:T1_____ T2(填“>”或“<”)。
(3)热化学硫碘循环分解水制得绿氢 ,全程零碳排放。反应如下:
反应i:SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) ∆H1=-82kJ·mol−1
反应ii:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ∆H2=+544kJ·mol−1
反应iii:……
反应ⅰ~iii循环实现分解水:2H2O(g)==2H2(g)+O2(g) ∆H=+484kJ·mol−1。
写出反应iii的热化学方程式_____ 。
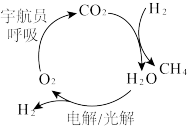
(4)一种非常重要的载人航天器中氧气再生方法:萨巴帝尔(Sabatier)反应,可以将二氧化碳转化为甲烷和水,配合水的电解可以实现氧气的再生。萨巴帝尔(Sabatier)反应是放热反应,控制反应器内的温度非常重要,已知此反应在300℃~400℃时转化率较高,所以一般会将进入反应器的气体预热到此温度,同时反应器配有_____ 装置,确保反应器高效率、低能耗的持续运行。萨巴帝尔(Sabatier)反应在载人航天器实现回收CO2再生O2,其过程如图所示,这种方法再生O2的最大缺点是需要不断补充_____ (填化学式)。
(1)煤的气化制得
 CO(g)+H2(g)。该反应的平衡常数表达式K=
CO(g)+H2(g)。该反应的平衡常数表达式K=(2)甲烷水蒸气催化重整制得
I.H2的制取:CH4(g)+H2O(g)
 CO(g)+3H2(g) ΔH>0
CO(g)+3H2(g) ΔH>0①为提高CH4的平衡转化率,可采取的措施有
II.H2的富集:CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH<0
CO2(g)+H2(g) ΔH<0②已知830℃时,该反应的平衡常数K=1.在容积不变的密闭容器中,将2molCO与8molH2O混合加热到830℃,反应达平衡时CO的转化率为
III.用
 吸收CO2实现低碳排放。
吸收CO2实现低碳排放。 消耗率随时间变化关系如图所示。
消耗率随时间变化关系如图所示。
③比较温度高低:T1
(3)热化学硫碘循环分解水制得
反应i:SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) ∆H1=-82kJ·mol−1
反应ii:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ∆H2=+544kJ·mol−1
反应iii:……
反应ⅰ~iii循环实现分解水:2H2O(g)==2H2(g)+O2(g) ∆H=+484kJ·mol−1。
写出反应iii的热化学方程式
(4)一种非常重要的载人航天器中氧气再生方法:萨巴帝尔(Sabatier)反应,可以将二氧化碳转化为甲烷和水,配合水的电解可以实现氧气的再生。萨巴帝尔(Sabatier)反应是放热反应,控制反应器内的温度非常重要,已知此反应在300℃~400℃时转化率较高,所以一般会将进入反应器的气体预热到此温度,同时反应器配有

您最近一年使用:0次
【推荐1】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
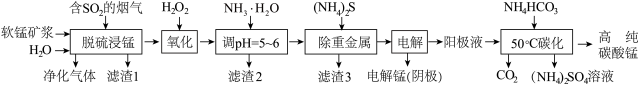
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为__ 。
(2)“滤渣2”中主要成分的化学式为__ 。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是__ 。
(4)“电解”时用惰性电极,阳极的电极反应式为__ 。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为___ 。“50℃碳化”时加入过量NH4HCO3,可能的原因是__ (写两种)。
(6)已知:25℃时,Kw=1.0×10-14,Ka(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:NH4++H2O NH3·H2O+H+,则该反应的平衡常数为
NH3·H2O+H+,则该反应的平衡常数为__ 。

(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为
(2)“滤渣2”中主要成分的化学式为
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是
(4)“电解”时用惰性电极,阳极的电极反应式为
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为
(6)已知:25℃时,Kw=1.0×10-14,Ka(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:NH4++H2O
 NH3·H2O+H+,则该反应的平衡常数为
NH3·H2O+H+,则该反应的平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】工业上利用N2和H2可以实现合成氨气,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列有关问题:
(1)已知N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ.mol-1
2NH3(g) △H=-92.4kJ.mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为___________ 。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g),其化学平衡常数K与温度t的关系如下表:
2NH3(g),其化学平衡常数K与温度t的关系如下表:
完成下列问题:
①比较K1、K2的大小:K1___________ K2(填“>”、“=”或“<”);
②在同温同压下判断该反应达到化学平衡状态的依据是___________ (填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)硝酸工业的尾气NO可用于制备NH4NO3,其工作原理如图。
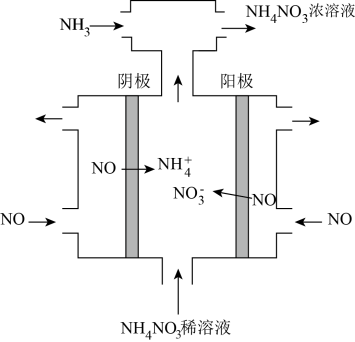
①其阴极的电极反应式为___________ 。
②常温下,1LpH=6的NH4NO3溶液中c(NH3·H2O)+c(OH-)=___________ mol·L-1。
(4)工业上生产尿素的化学方程式为:
2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(l)
CO(NH2)2(s)+H2O(l)
在T℃,体积为4L的密闭容器中,通入6molNH3和3 mol CO2,反应达到平衡时,c(NH3)=0.5mol·L-1,e(CO2)=0.25mol·L-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的V正___________ V逆(填“>”“<”或“=”)。再次平衡后,平衡常数为___________ 。
(5)已知Ksp(AgCl)=1.8×10-10,若向50mL0.09mol·L-1的AgNO3溶液中加入50mL0.10mol·L-1的盐酸,混合后溶液中的Ag+的浓度为___________ mol·L-1。
(1)已知N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
N2(g)+3H2(g)
 2NH3(g) △H=-92.4kJ.mol-1
2NH3(g) △H=-92.4kJ.mol-12H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
写出氨气经催化氧化完全生成一氧化氮和水蒸气的热化学方程式为
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)
 2NH3(g),其化学平衡常数K与温度t的关系如下表:
2NH3(g),其化学平衡常数K与温度t的关系如下表:| t/K | 298 | 398 | 498 | ...... |
| K/(mol/L)2 | 4.1×106 | K1 | K2 | ...... |
完成下列问题:
①比较K1、K2的大小:K1
②在同温同压下判断该反应达到化学平衡状态的依据是
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2) (正)=v(H2) (逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)硝酸工业的尾气NO可用于制备NH4NO3,其工作原理如图。

①其阴极的电极反应式为
②常温下,1LpH=6的NH4NO3溶液中c(NH3·H2O)+c(OH-)=
(4)工业上生产尿素的化学方程式为:
2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(l)
CO(NH2)2(s)+H2O(l)在T℃,体积为4L的密闭容器中,通入6molNH3和3 mol CO2,反应达到平衡时,c(NH3)=0.5mol·L-1,e(CO2)=0.25mol·L-1。若此时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入3molNH3,则此时反应的V正
(5)已知Ksp(AgCl)=1.8×10-10,若向50mL0.09mol·L-1的AgNO3溶液中加入50mL0.10mol·L-1的盐酸,混合后溶液中的Ag+的浓度为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】钛是一种性能非常优越的金属,有着广泛的应用,有人说“21世纪将是钛的世纪”黄冈市有着储量可观的金红石(TiO2)矿,可作为钛冶炼的原料,但因选矿等原因,目前未大规模开发利用,故金红石矿的高效综合利用是黄冈市亟待攻克的重点课题。
Ⅰ.浮选是金红石选矿中常用的方法,油酸是浮选中良好的捕获剂和发泡剂。其原理为:金红石表面解离的Ti4+在水溶液中水解形成羟基化合物[Ti(OH)2]2+和[Ti(OH)3]+,络合在金红石表面成为浮选的活性点,再被油酸电离的C17H33COO-捕获,从而使金红石疏水上浮。
(1)油酸可由高级脂肪酸甘油酯制得,试写出三油酸甘油酯发生皂化反应的方程式_______ 。
(2)浮选时需控制pH在6~8之间,试分析其原因,pH过低时_______ ,pH过高时_______ 。
Ⅱ.经浮选后的金红石精矿粉(主要成分为TiO2,含有少量Al2O3、SiO2、FeO、Fe2O3等杂质)制备金属钛的工艺如下:
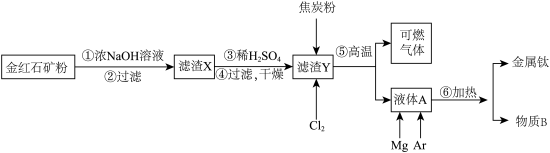
(3)操作①②的作用是_______ ,操作③④的作用是_______ 。
(4)过程⑤称为“碳氯化”,将钛由氧化物转化为氯化物,试写出该反应的化学方程式_______ 。
(5)物质B可以通过_______ (填工艺名称),实现物质循环利用。
(6)保持100 kPa下,将TiO2、C、Cl2以物质的量比1:2.2:2进行“碳氯化”反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
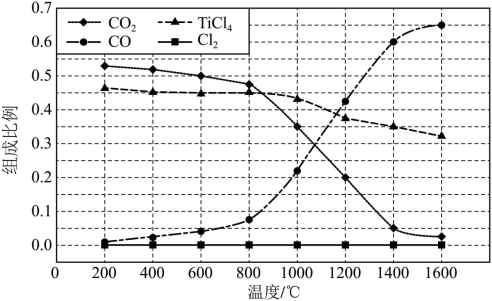
①反应C(s)+CO2(g) 2CO(g)的平衡常数Kp(1400℃)=
2CO(g)的平衡常数Kp(1400℃)=_______ 。
②图中显示,在200℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因_______ 。
Ⅰ.浮选是金红石选矿中常用的方法,油酸是浮选中良好的捕获剂和发泡剂。其原理为:金红石表面解离的Ti4+在水溶液中水解形成羟基化合物[Ti(OH)2]2+和[Ti(OH)3]+,络合在金红石表面成为浮选的活性点,再被油酸电离的C17H33COO-捕获,从而使金红石疏水上浮。
(1)油酸可由高级脂肪酸甘油酯制得,试写出三油酸甘油酯发生皂化反应的方程式
(2)浮选时需控制pH在6~8之间,试分析其原因,pH过低时
Ⅱ.经浮选后的金红石精矿粉(主要成分为TiO2,含有少量Al2O3、SiO2、FeO、Fe2O3等杂质)制备金属钛的工艺如下:

(3)操作①②的作用是
(4)过程⑤称为“碳氯化”,将钛由氧化物转化为氯化物,试写出该反应的化学方程式
(5)物质B可以通过
(6)保持100 kPa下,将TiO2、C、Cl2以物质的量比1:2.2:2进行“碳氯化”反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。

①反应C(s)+CO2(g)
 2CO(g)的平衡常数Kp(1400℃)=
2CO(g)的平衡常数Kp(1400℃)=②图中显示,在200℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】I.(1)指出如下图实验装置中的错误之处(加热装置中烧杯底部已垫有石棉网)
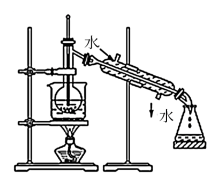
①_______ ;
②_______ 。
(2)图是某学生的过滤操作示意图,其操作不规范的是_______
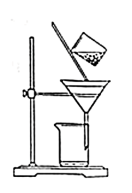
a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
II.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2.请回答下列问题:
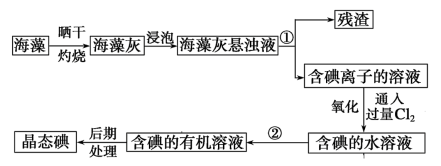
(1)指出提取碘的过程中有关实验操作①和②的名称:_______ ;_______ 。
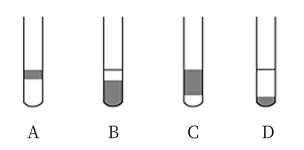
(2)在3 mL含碘的水溶液中加入1mL四氯化碳,振荡静置后观察到试管里的分层现象是上图中的_______ (注:试管中深色区为有色溶液),上层无色溶液的溶质是_______ 下层颜色是_______ 。
(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过的操作是_______ 。
III.某溶液中含有MgSO4和Na2SO4两种溶质,选择适当试剂将溶液中的镁离子转化为沉淀或固体分离出来,设计实验流程如下:
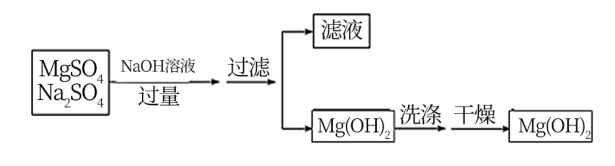
欲证明滤液中存在 、OH-,选用的方案是先取少量的滤液滴加
、OH-,选用的方案是先取少量的滤液滴加_______ ,发现溶液变红,再向其中加入_______ 溶液,出现白色沉淀,则可证明 、OH-,均存在。
、OH-,均存在。

①
②
(2)图是某学生的过滤操作示意图,其操作不规范的是

a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
II.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2.请回答下列问题:


(1)指出提取碘的过程中有关实验操作①和②的名称:
(2)在3 mL含碘的水溶液中加入1mL四氯化碳,振荡静置后观察到试管里的分层现象是上图中的
(3)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过的操作是
III.某溶液中含有MgSO4和Na2SO4两种溶质,选择适当试剂将溶液中的镁离子转化为沉淀或固体分离出来,设计实验流程如下:

欲证明滤液中存在
 、OH-,选用的方案是先取少量的滤液滴加
、OH-,选用的方案是先取少量的滤液滴加 、OH-,均存在。
、OH-,均存在。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】碘在医药、照相、橡胶、染料、气象等许多领域都具有广泛的用途,海洋中虽然含碘的浓度相当小,每升海水中平均含碘0.06mg,但海洋里碘的总储量仍很惊人——9.3×1010t,比陆地上要多得多。一般生长在海底的海带含碘0.3%~0.5%,有的可达1%,比海水中碘的浓度高出十几万倍!海藻中含有丰富的碘元素(以I-形式存在)。实验室提取碘的流程如下:

(1)实验操作①的名称是_________ ,实验操作③所用主要仪器名称为____________ ,实验②发生的离子反应方程式为 ___________________ 。
(2)提取碘的过程中,可供选择的有机试剂是___________ (填序号)。
A.四氯化碳(沸点77℃) B.酒精(沸点78℃) C.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl,为消耗此杂质,使碘全部游离出来,应加入适量_________ (填序号)溶液,反应的离子方程式为___________ 。
A.KIO3 B.HClO C.Br2 D.KI
(4)为使从含碘有机溶液中提取碘并回收溶剂,采用水浴加热蒸馏(如图所示)。请指出图中实验装置除未加沸石外的错误之处(有处填几处,下列空白可不填满,也可补充)。
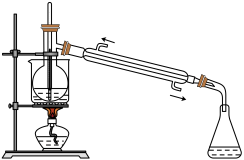
①____________
②____________
③____________

(1)实验操作①的名称是
(2)提取碘的过程中,可供选择的有机试剂是
A.四氯化碳(沸点77℃) B.酒精(沸点78℃) C.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl,为消耗此杂质,使碘全部游离出来,应加入适量
A.KIO3 B.HClO C.Br2 D.KI
(4)为使从含碘有机溶液中提取碘并回收溶剂,采用水浴加热蒸馏(如图所示)。请指出图中实验装置除未加沸石外的错误之处(有处填几处,下列空白可不填满,也可补充)。

①
②
③
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】化学兴趣小组在实验室进行“海带提碘”的实验过程如图:

(1)操作①的名称是_____ ,操作②的主要仪器是_____ ;氧化步骤的离子方程式是_____ 。
(2)探究异常:取样检验时,部分同学没有观察到溶液变蓝色。他们假设原因可能是加入的氯水过量,氧化了①I2;②淀粉;③I2和淀粉。他们在没有变蓝色的溶液中,滴加_____ (选填“四氯化碳”“碘水”“淀粉溶液”)后,若出现_____ 现象,即可证明假设①正确,同时排除假设②③.能同时排除假设②③的原因是_____ 。
(3)查阅资料:Cl2 可氧化 I2,反应的化学方程式为_____ Cl2+_____ I2+_____ H2O→_____ HIO3+_____ HCl.配平上述方程式,并标出电子转移的方向和数目_______ 。
(4)探究氧化性:在盛有 FeCl3 溶液的试管中,滴入几滴 KI 溶液,将反应后的溶液均匀倒入两支试管,试管 a 中加入 1 mL 苯振荡静置,出现______ (填实验现象),证明有 I2存在;试管b 中滴入 KSCN 溶液,溶液显血红色,证明有_____ 存在。
(5)比较氧化性:综合上述实验,可以得出的结论是氧化性:Cl2>FeCl3,理由是_____ 。

(1)操作①的名称是
(2)探究异常:取样检验时,部分同学没有观察到溶液变蓝色。他们假设原因可能是加入的氯水过量,氧化了①I2;②淀粉;③I2和淀粉。他们在没有变蓝色的溶液中,滴加
(3)查阅资料:Cl2 可氧化 I2,反应的化学方程式为
(4)探究氧化性:在盛有 FeCl3 溶液的试管中,滴入几滴 KI 溶液,将反应后的溶液均匀倒入两支试管,试管 a 中加入 1 mL 苯振荡静置,出现
(5)比较氧化性:综合上述实验,可以得出的结论是氧化性:Cl2>FeCl3,理由是
您最近一年使用:0次



