过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
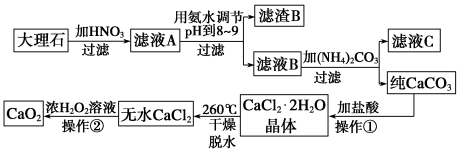
请回答下列问题:
(1)操作①应包括下列操作中的____________ 。(填序号)
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是_________________________________ 。
(3)若测得滤液c中c(CO32-)=10-3mol/L,则Ca2+____ (填“是”或“不”)沉淀完全。[已知c(Ca2+)≤10-5 mol/L时即可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中c(NH4+)_______ c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出该反应的化学方程式_________________________ ;用简要的文字解释用氢氧化钠调节pH至9~11的原因____________ 。
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率__________________ 。

请回答下列问题:
(1)操作①应包括下列操作中的
A.溶解 B.过滤 C.蒸馏 D.分液 E.蒸发结晶
(2)用氨水调节pH至8~9的目的是
(3)若测得滤液c中c(CO32-)=10-3mol/L,则Ca2+
(4)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中c(NH4+)
(5)操作②是:在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。写出该反应的化学方程式
(6)已知大理石含CaCO3的质量分数为a,m g大理石可以制得n g CaO2,请计算:CaCO3转化为CaO2过程中,Ca原子的利用率
2010·福建泉州·一模 查看更多[4]
(已下线)福建省泉州市2010年高中毕业班五月质量检测理综化学部分2016届辽宁省抚顺市高三下学期3月模拟理综化学试卷【全国百强校】海南省海南中学2018届高三下学期第二次模拟考试化学试题湖南省衡阳市第八中学2020届高三模拟检测理科综合化学试题
更新时间:2016-04-18 17:20:15
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】水杨酸甲酯对多种细菌的繁殖和黏附有抑制作用,也是安全、有效的植物生长调节剂。某化学小组用水杨酸(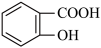 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。装置示意图和有关数据如下:
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。装置示意图和有关数据如下:
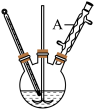
反应原理: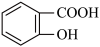

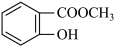
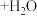
实验步骤:Ⅰ.在三颈烧瓶中加入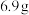 (
(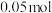 )水杨酸和
)水杨酸和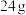 (
( ,
,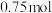 )甲醇,向混合物中加入约
)甲醇,向混合物中加入约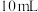 甲苯(甲苯与水形成共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入
甲苯(甲苯与水形成共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入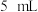 浓硫酸,摇动混匀加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应
浓硫酸,摇动混匀加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应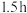 ;
;
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、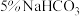 溶液和水洗涤;分出的产物加入少量无水
溶液和水洗涤;分出的产物加入少量无水 固体,过滤得到粗酯;
固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯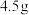 。
。
请根据以上信息回答下列问题:
(1)仪器A的名称是_______ ,制备水杨酸甲酯时,最合适的加热方法是_______ 。
(2)本实验甲醇要过量,其目的是_______ 。
(3)反应结束后,分离甲醇的操作是_______ 。
(4)洗涤操作中,第一次水洗的主要目的是_______ ,第二次水洗的主要目的是_______ 。
(5)检验产品中是否含有水杨酸的化学方法是_______ 。
(6)本实验的产率为_______ %(保留小数点后一位)。
 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。装置示意图和有关数据如下:
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。装置示意图和有关数据如下:| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) | 溶解性(水中) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 |  | 224 | 微溶 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 | 不溶 |
| 甲醇 | 32 | 无色液体 | 0.792 | 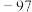 | 64.7 | 互溶 |

反应原理:


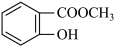
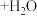
实验步骤:Ⅰ.在三颈烧瓶中加入
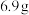 (
(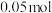 )水杨酸和
)水杨酸和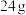 (
( ,
,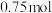 )甲醇,向混合物中加入约
)甲醇,向混合物中加入约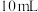 甲苯(甲苯与水形成共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入
甲苯(甲苯与水形成共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入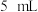 浓硫酸,摇动混匀加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应
浓硫酸,摇动混匀加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应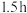 ;
;Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、
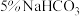 溶液和水洗涤;分出的产物加入少量无水
溶液和水洗涤;分出的产物加入少量无水 固体,过滤得到粗酯;
固体,过滤得到粗酯;Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯
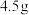 。
。请根据以上信息回答下列问题:
(1)仪器A的名称是
(2)本实验甲醇要过量,其目的是
(3)反应结束后,分离甲醇的操作是
(4)洗涤操作中,第一次水洗的主要目的是
(5)检验产品中是否含有水杨酸的化学方法是
(6)本实验的产率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】过碳酸钠( )是一种强氧化剂,易溶于水形成碳酸钠和过氧化氢的混合液,难溶于乙醇,主要用作漂白剂和氧化剂,通常用作洗衣粉的助剂。某实验小组模拟工业在实验室用饱和食盐水制备过碳酸钠,其流程如下:
)是一种强氧化剂,易溶于水形成碳酸钠和过氧化氢的混合液,难溶于乙醇,主要用作漂白剂和氧化剂,通常用作洗衣粉的助剂。某实验小组模拟工业在实验室用饱和食盐水制备过碳酸钠,其流程如下:

(1)“反应Ⅰ”中应先向饱和食盐水中通入_______ (填化学式),其反应Ⅰ的离子方程式为_______ 。
(2)操作Ⅰ为_______ 。
(3)“反应Ⅱ”需控制温度在20℃左右的原因是_______ ,乙醇的作用是_______ 。
(4)产品中过碳酸钠含量的测定:取m g产品于烧杯中,加水溶液配成100mL的溶液,取25mL溶液用硫酸酸化的c mol/L的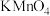 溶液滴定,滴定终点消耗
溶液滴定,滴定终点消耗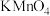 溶液的体积为V mL;
溶液的体积为V mL;
①滴定时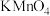 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为_______ ;
②滴定终点的实验现象为_______ ;
③产品中过碳酸钠的质量分数为_______ (用含“c、V、m”的式子表示)。
 )是一种强氧化剂,易溶于水形成碳酸钠和过氧化氢的混合液,难溶于乙醇,主要用作漂白剂和氧化剂,通常用作洗衣粉的助剂。某实验小组模拟工业在实验室用饱和食盐水制备过碳酸钠,其流程如下:
)是一种强氧化剂,易溶于水形成碳酸钠和过氧化氢的混合液,难溶于乙醇,主要用作漂白剂和氧化剂,通常用作洗衣粉的助剂。某实验小组模拟工业在实验室用饱和食盐水制备过碳酸钠,其流程如下:
(1)“反应Ⅰ”中应先向饱和食盐水中通入
(2)操作Ⅰ为
(3)“反应Ⅱ”需控制温度在20℃左右的原因是
(4)产品中过碳酸钠含量的测定:取m g产品于烧杯中,加水溶液配成100mL的溶液,取25mL溶液用硫酸酸化的c mol/L的
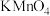 溶液滴定,滴定终点消耗
溶液滴定,滴定终点消耗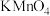 溶液的体积为V mL;
溶液的体积为V mL;①滴定时
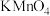 溶液发生反应的离子方程式为
溶液发生反应的离子方程式为②滴定终点的实验现象为
③产品中过碳酸钠的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】硫酸四氨合铜(Ⅱ)晶体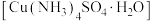
 易溶于水,不溶于乙醇,常用作杀虫剂和媒染剂。以废铜(表面有油污)为原料制备
易溶于水,不溶于乙醇,常用作杀虫剂和媒染剂。以废铜(表面有油污)为原料制备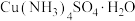 ,实验步骤如下:
,实验步骤如下:
Ⅰ.制备
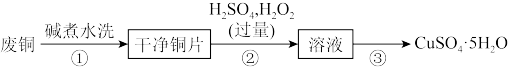
(1)步骤①中的“碱”是指一种钠盐,能与盐酸反应生成无色无味的气体,写出该钠盐与盐酸反应的离子方程式___________ 。
(2)写出 的电子式
的电子式___________ 。
(3)已知铜片与浓硫酸在加热条件下也能反应生成硫酸铜溶液,写出该反应的化学方程式___________ 。步骤②中铜片在稀硫酸中溶解也生成硫酸铜溶液,写出该反应的离子方程式___________ 。分析工业上利用 和
和 制备硫酸铜溶液的优点:
制备硫酸铜溶液的优点:___________ (写出一条即可)。
Ⅱ.制备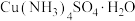 ,实验装置如图所示:
,实验装置如图所示:
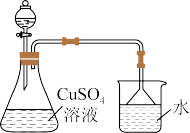
(4)向饱和硫酸铜溶液中滴加浓氨水至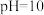 ,有大量的蓝色沉淀生成,继续滴加浓氨水至蓝色沉淀完全消失,加入乙醇,生成深蓝色固体沉淀,静置,过滤得到
,有大量的蓝色沉淀生成,继续滴加浓氨水至蓝色沉淀完全消失,加入乙醇,生成深蓝色固体沉淀,静置,过滤得到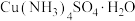 晶体。
晶体。
①写出开始向饱和硫酸铜溶液中滴加浓氨水的离子方程式___________ 。
②写出由饱和 制备
制备 溶液的化学方程式
溶液的化学方程式___________ 。
(5)称取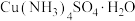 试样
试样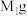 加水溶解,加入过量盐酸酸化的
加水溶解,加入过量盐酸酸化的 溶液,静置、过滤,得到
溶液,静置、过滤,得到 沉淀
沉淀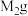 ,试样中
,试样中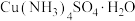 的质量分数为
的质量分数为___________ (只需列出计算式)。
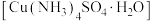
 易溶于水,不溶于乙醇,常用作杀虫剂和媒染剂。以废铜(表面有油污)为原料制备
易溶于水,不溶于乙醇,常用作杀虫剂和媒染剂。以废铜(表面有油污)为原料制备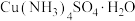 ,实验步骤如下:
,实验步骤如下:Ⅰ.制备

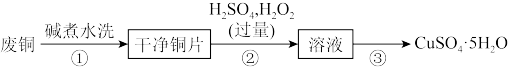
(1)步骤①中的“碱”是指一种钠盐,能与盐酸反应生成无色无味的气体,写出该钠盐与盐酸反应的离子方程式
(2)写出
 的电子式
的电子式(3)已知铜片与浓硫酸在加热条件下也能反应生成硫酸铜溶液,写出该反应的化学方程式
 和
和 制备硫酸铜溶液的优点:
制备硫酸铜溶液的优点:Ⅱ.制备
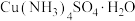 ,实验装置如图所示:
,实验装置如图所示:
(4)向饱和硫酸铜溶液中滴加浓氨水至
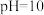 ,有大量的蓝色沉淀生成,继续滴加浓氨水至蓝色沉淀完全消失,加入乙醇,生成深蓝色固体沉淀,静置,过滤得到
,有大量的蓝色沉淀生成,继续滴加浓氨水至蓝色沉淀完全消失,加入乙醇,生成深蓝色固体沉淀,静置,过滤得到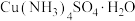 晶体。
晶体。①写出开始向饱和硫酸铜溶液中滴加浓氨水的离子方程式
②写出由饱和
 制备
制备 溶液的化学方程式
溶液的化学方程式(5)称取
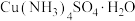 试样
试样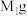 加水溶解,加入过量盐酸酸化的
加水溶解,加入过量盐酸酸化的 溶液,静置、过滤,得到
溶液,静置、过滤,得到 沉淀
沉淀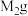 ,试样中
,试样中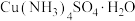 的质量分数为
的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】从工业含锌废渣(主要成分为ZnO,还含有SiO2、Fe3+、Cu2+、Pb2+等杂质)制取ZnCO3∙2Zn(OH)2的一种工艺如下:
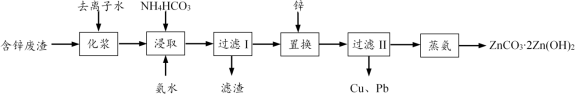
(1)浸取前,需将含锌废渣粉碎并加水制成悬浊液(化浆),目的是____ 。
(2)浸取时的温度控制在30 ℃,原因是____ 。浸取后,ZnO转化为[Zn(NH3)4]CO3溶液,滤渣的主要成分为____ 。
(3)除Cu2+、Pb2+时,也可加入(NH4)2S使其生成硫化物沉淀。已知Ksp(CuS)=6.310-36,Ksp(PbS)=8.010-28,要使溶液中Cu2+、Pb2+的浓度均小于1.010-5 mol·L-1,则沉淀时需控制S2-的浓度至少为_____ mol·L-1。
(4)蒸氨时发生反应的化学方程式为____ 。
(5)本工艺中可循环利用的物质为____ 。

(1)浸取前,需将含锌废渣粉碎并加水制成悬浊液(化浆),目的是
(2)浸取时的温度控制在30 ℃,原因是
(3)除Cu2+、Pb2+时,也可加入(NH4)2S使其生成硫化物沉淀。已知Ksp(CuS)=6.310-36,Ksp(PbS)=8.010-28,要使溶液中Cu2+、Pb2+的浓度均小于1.010-5 mol·L-1,则沉淀时需控制S2-的浓度至少为
(4)蒸氨时发生反应的化学方程式为
(5)本工艺中可循环利用的物质为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】Li3N是一种储氢材料,可以用Li和N2在450℃反应制备。已知Li3N易水解,细粉状的Li3N在空气中加热可发生剧烈燃烧。下图是某实验小组设计的实验室制备少量Li3N的装置图。请回答下列问题:
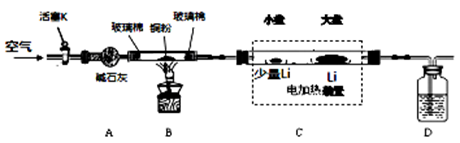
(1)B装置的作用是_________________ ,如果B装置中玻璃管两端没有玻璃棉可能造成的后果是____________________________ 。
(2)D装置中的试剂是_____________ ,作用是 __________________________ 。
(3)C装置的小盘中放有少量Li的作用是____________________________ 。
(4)实验步骤如下:安装好仪器,检查装置气密性,装入药品;_________________________ 。 (请按正确的顺序填入下列步骤的标号);拆除装置,取出产物。
①点燃B中酒精灯加热B中试管;
②打开活塞K;
③关闭电加热装置停,充分冷却;
④调节电加热装置控制温度为450℃;
⑤关闭活塞K;
⑥熄灭B中酒精灯;
(5)请你设计一个实验,用化学方法区分Li与Li3N,写出实验简要步骤及观察到的现象___________________________________ 。
(6)Li3N在H2中加热时可得到氨基锂(LiNH2),该反应在270℃可逆,所以Li3N可作为储氢材料,该反应的化学方程式为:___________________________________ 。

(1)B装置的作用是
(2)D装置中的试剂是
(3)C装置的小盘中放有少量Li的作用是
(4)实验步骤如下:安装好仪器,检查装置气密性,装入药品;
①点燃B中酒精灯加热B中试管;
②打开活塞K;
③关闭电加热装置停,充分冷却;
④调节电加热装置控制温度为450℃;
⑤关闭活塞K;
⑥熄灭B中酒精灯;
(5)请你设计一个实验,用化学方法区分Li与Li3N,写出实验简要步骤及观察到的现象
(6)Li3N在H2中加热时可得到氨基锂(LiNH2),该反应在270℃可逆,所以Li3N可作为储氢材料,该反应的化学方程式为:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】以菱铁矿(主要成分是碳酸亚铁FeCO3)为原料制取铁的流程如图:

(1)“浸取”时通常将菱铁矿石进行粉碎,其目的是__________ (填“加快”或“减慢”)反应速率,写出浸取过程中的化学反应方程式:____________________________ 。
(2)“氧化”和“沉淀”是将“浸取”过程中产生的Fe2+转化为Fe(OH)3沉淀,则操作①的名称为____________ (填“蒸发”或“过滤”)。
(3)利用金属活动性的不同,可以采取不同的冶炼方法,其中上述过程中的②属于______ (填“热还原法”或“电解法”)。
(4)氨水由氨气溶于水制备,工业合成氨气反应方程式为:N2+3H2 2NH3。现在2 L容积不变的容器中,通入0.8 mol H2和0.4 mol N2,3 min后生成了0.12 mol NH3,用NH3表示该反应的速率v(NH3)=
2NH3。现在2 L容积不变的容器中,通入0.8 mol H2和0.4 mol N2,3 min后生成了0.12 mol NH3,用NH3表示该反应的速率v(NH3)=_____________ mol•L-1•min-1。

(1)“浸取”时通常将菱铁矿石进行粉碎,其目的是
(2)“氧化”和“沉淀”是将“浸取”过程中产生的Fe2+转化为Fe(OH)3沉淀,则操作①的名称为
(3)利用金属活动性的不同,可以采取不同的冶炼方法,其中上述过程中的②属于
(4)氨水由氨气溶于水制备,工业合成氨气反应方程式为:N2+3H2
 2NH3。现在2 L容积不变的容器中,通入0.8 mol H2和0.4 mol N2,3 min后生成了0.12 mol NH3,用NH3表示该反应的速率v(NH3)=
2NH3。现在2 L容积不变的容器中,通入0.8 mol H2和0.4 mol N2,3 min后生成了0.12 mol NH3,用NH3表示该反应的速率v(NH3)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】CuCl常用作催化剂、杀菌剂、媒染剂、脱色剂和冶金工业等。实验室用如下装置(夹持仪器略去)将二氧化硫通入新制 悬浊液中制备CuCl(已知CuCl为白色固体,难溶于水和乙醇)。
悬浊液中制备CuCl(已知CuCl为白色固体,难溶于水和乙醇)。
(1)仪器a的名称是_______ ,装置A中分液漏斗中盛装的试剂为_______ 。
(2)装置B的作用是_______ 。
(3)装置D的作用是_______ ,其中发生反应的离子方程式为_______ 。
(4) 与装置C中生成的
与装置C中生成的 悬浊液反应制备CuCl的离子方程式为
悬浊液反应制备CuCl的离子方程式为_______ 。
(5)装置C中 溶液的体积为20mL,滴入足量NaOH溶液后再通入
溶液的体积为20mL,滴入足量NaOH溶液后再通入 ,反应结束后,将装置C中混合物过滤,依次用水和乙醇洗涤、烘干,得到固体的质量为0.693g。
,反应结束后,将装置C中混合物过滤,依次用水和乙醇洗涤、烘干,得到固体的质量为0.693g。
①先用水洗再用乙醇洗涤的目的是_______ 。
②该实验所得CuCl的产率为_______ %。
 悬浊液中制备CuCl(已知CuCl为白色固体,难溶于水和乙醇)。
悬浊液中制备CuCl(已知CuCl为白色固体,难溶于水和乙醇)。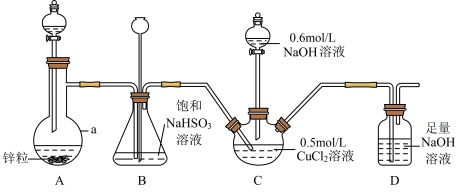
(1)仪器a的名称是
(2)装置B的作用是
(3)装置D的作用是
(4)
 与装置C中生成的
与装置C中生成的 悬浊液反应制备CuCl的离子方程式为
悬浊液反应制备CuCl的离子方程式为(5)装置C中
 溶液的体积为20mL,滴入足量NaOH溶液后再通入
溶液的体积为20mL,滴入足量NaOH溶液后再通入 ,反应结束后,将装置C中混合物过滤,依次用水和乙醇洗涤、烘干,得到固体的质量为0.693g。
,反应结束后,将装置C中混合物过滤,依次用水和乙醇洗涤、烘干,得到固体的质量为0.693g。①先用水洗再用乙醇洗涤的目的是
②该实验所得CuCl的产率为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.由三种元素组成的化合物A,按如下流程进行实验。
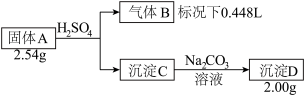
气体B为黄绿色气体单质, 沉淀C和D焰色反应为均为砖红色。
(1)组成A的三种元素是______ ,A的化学式是______
(2)固体A与足量稀硫酸反应的化学方程式是______ 。
(3)请从化学反应原理的角度解释(结合化学方程式)为什么沉淀C能转化成 D______ 。
Ⅱ.常用的补铁剂有硫酸亚铁等,而乳酸亚铁被人体吸收的效果比无机铁好,它溶于水形成淡绿色的透明溶液,几乎不溶于乙醇。它的制备方法有两种:一是在FeCO3中加入乳酸;二是利用废铁屑制取纯净的三水合乳酸亚铁晶体,其实验流程如下图所示:
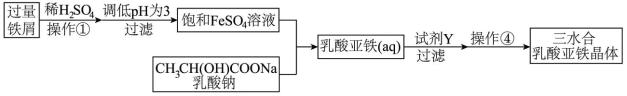
(1)写出制备方法一的离子反应方程式_______ ;
(2)操作①中不需要用到的仪器为________ ;
A.玻璃棒 B.坩埚 C.坩埚钳 D.蒸发皿
(3)加入过量的试剂Y为_______ 。

气体B为黄绿色气体单质, 沉淀C和D焰色反应为均为砖红色。
(1)组成A的三种元素是
(2)固体A与足量稀硫酸反应的化学方程式是
(3)请从化学反应原理的角度解释(结合化学方程式)为什么沉淀C能转化成 D
Ⅱ.常用的补铁剂有硫酸亚铁等,而乳酸亚铁被人体吸收的效果比无机铁好,它溶于水形成淡绿色的透明溶液,几乎不溶于乙醇。它的制备方法有两种:一是在FeCO3中加入乳酸;二是利用废铁屑制取纯净的三水合乳酸亚铁晶体,其实验流程如下图所示:

(1)写出制备方法一的离子反应方程式
(2)操作①中不需要用到的仪器为
A.玻璃棒 B.坩埚 C.坩埚钳 D.蒸发皿
(3)加入过量的试剂Y为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】碘元素是人体的必需微量元素之一。某学习小组在实验室进行海带提碘的探究,实验过程如图:
Ⅰ.海带中碘元素的确定
海带 海带灰
海带灰
 海带灰浸取液
海带灰浸取液
(1)取海带灰浸取液 ,加入稀硫酸约
,加入稀硫酸约 、5%的
、5%的 溶液约
溶液约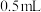 ,然后加入
,然后加入 约
约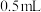 ,振荡后静置,可以观察到
,振荡后静置,可以观察到_______ ,证明海带中含有碘元素,该反应的离子方程式为_______ 。
Ⅱ.海带提碘
海带灰浸取液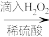 含I2的水溶液
含I2的水溶液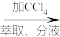 碘的有机溶液→晶体碘
碘的有机溶液→晶体碘
(2)若向 碘水L中加入
碘水L中加入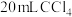 ,充分振荡、静置,此时碘在
,充分振荡、静置,此时碘在 中的物质的量浓度是水中的86倍,则萃取效率为
中的物质的量浓度是水中的86倍,则萃取效率为_______ %(结果保留小数点后两位)(萃取效率 )。
)。
(3)萃取实验中,若要使碘尽可能地完全转移到 中,可以采取的操作是
中,可以采取的操作是_______ 。
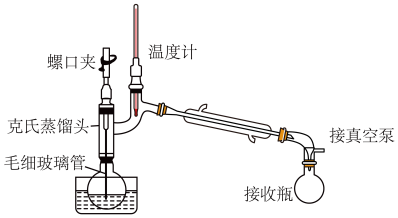
(4)某同学采取减压蒸馏(装置如图),可以很快完成碘和四氯化碳的分离,减压蒸馏时使用了克氏蒸馏头,克氏蒸馏头比普通蒸馏头增加了一个弯管,弯管的主要作用是_______ 。
Ⅲ.海带中碘含量的测定
(5)若称取干海带 ,经灼烧、浸取、
,经灼烧、浸取、 氧化等过程后配制成
氧化等过程后配制成 溶液,移取
溶液,移取 于锥形瓶中,用
于锥形瓶中,用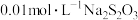 标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的
标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的 溶液的平均体积为
溶液的平均体积为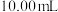 ,计算海带中含碘的质量分数为
,计算海带中含碘的质量分数为_______ %(结果保留小数点后两位)(已知 )。若滴定结束读数时俯视刻度线,会导致测定结果
)。若滴定结束读数时俯视刻度线,会导致测定结果_______ (填“偏高”“偏低”或“不影响”)。
Ⅰ.海带中碘元素的确定
海带
 海带灰
海带灰
 海带灰浸取液
海带灰浸取液(1)取海带灰浸取液
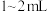 ,加入稀硫酸约
,加入稀硫酸约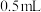 、5%的
、5%的 溶液约
溶液约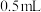 ,然后加入
,然后加入 约
约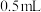 ,振荡后静置,可以观察到
,振荡后静置,可以观察到Ⅱ.海带提碘
海带灰浸取液
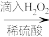 含I2的水溶液
含I2的水溶液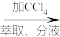 碘的有机溶液→晶体碘
碘的有机溶液→晶体碘(2)若向
 碘水L中加入
碘水L中加入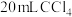 ,充分振荡、静置,此时碘在
,充分振荡、静置,此时碘在 中的物质的量浓度是水中的86倍,则萃取效率为
中的物质的量浓度是水中的86倍,则萃取效率为 )。
)。(3)萃取实验中,若要使碘尽可能地完全转移到
 中,可以采取的操作是
中,可以采取的操作是(4)某同学采取减压蒸馏(装置如图),可以很快完成碘和四氯化碳的分离,减压蒸馏时使用了克氏蒸馏头,克氏蒸馏头比普通蒸馏头增加了一个弯管,弯管的主要作用是

Ⅲ.海带中碘含量的测定
(5)若称取干海带
 ,经灼烧、浸取、
,经灼烧、浸取、 氧化等过程后配制成
氧化等过程后配制成 溶液,移取
溶液,移取 于锥形瓶中,用
于锥形瓶中,用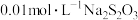 标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的
标准溶液滴定,待溶液由黄色变为浅黄色时,滴加两滴淀粉指示剂,继续滴定至蓝色刚好褪去,且半分钟内无变化,即为终点,平行滴定3次,记录所消耗的 溶液的平均体积为
溶液的平均体积为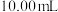 ,计算海带中含碘的质量分数为
,计算海带中含碘的质量分数为 )。若滴定结束读数时俯视刻度线,会导致测定结果
)。若滴定结束读数时俯视刻度线,会导致测定结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】实验室用如图装置制备并收集干燥、纯净的 已知碳酸的酸性比次氯酸的强,回答下列问题:
已知碳酸的酸性比次氯酸的强,回答下列问题:
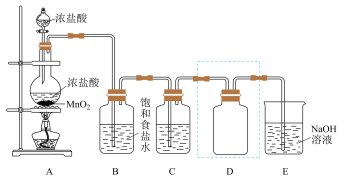
(1)装置A中发生反应的离子方程式是___________ 。
(2)装置B的作用是___________ 。
(3)装置C中盛放的物质是___________ 。
(4)装置D用于收集 ,装置D中进气方向为
,装置D中进气方向为___________ (填“甲”或“乙”),若在D中放入紫色石蕊溶液,则瓶内会出现什么现象___________ 。
(5)装置E用于吸收尾气,E中发生反应的化学方程式是___________ 。
(6)可用 和冷的石灰乳反应制备漂白粉,漂白粉有效成分是
和冷的石灰乳反应制备漂白粉,漂白粉有效成分是___________ (填化学式)。
(7)漂白粉常用于游泳池的消毒,起消毒作用的是HClO。漂白粉在水中释放HClO的途径如下:
途径一: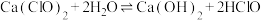
途径二: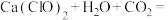
___________ (把反应补充完整)。
 已知碳酸的酸性比次氯酸的强,回答下列问题:
已知碳酸的酸性比次氯酸的强,回答下列问题:
(1)装置A中发生反应的离子方程式是
(2)装置B的作用是
(3)装置C中盛放的物质是
(4)装置D用于收集
 ,装置D中进气方向为
,装置D中进气方向为
(5)装置E用于吸收尾气,E中发生反应的化学方程式是
(6)可用
 和冷的石灰乳反应制备漂白粉,漂白粉有效成分是
和冷的石灰乳反应制备漂白粉,漂白粉有效成分是(7)漂白粉常用于游泳池的消毒,起消毒作用的是HClO。漂白粉在水中释放HClO的途径如下:
途径一:
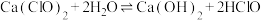
途径二:
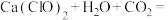
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
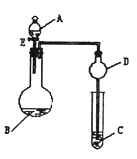
(1)图中A仪器的名称为:_______________ ,
D装置在实验中的作用是______________________ 。
(2)若A为30%H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中的现象为________________ ,
C中发生反应的化学方程式为:_____________________ 。
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是_______________________ ;继续通气体于C中,足够长的时间后,发现C中溶液的颜色消失,这是因为在溶液中I2能被氧化为HIO3,写出该反应的化学方程式_______________________ 。
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是_________________ ,C中发生反应的离子方程式为:______________________________________ 。

(1)图中A仪器的名称为:
D装置在实验中的作用是
(2)若A为30%H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中的现象为
C中发生反应的化学方程式为:
(3)若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是
(4)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某学生课外学习活动小组针对教材中铜与浓硫酸反应,提出了研究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:实验试剂:18mol/L硫酸20mL,纯铜粉足量,足量2mol/LNaOH溶液;请根据实验回答问题:
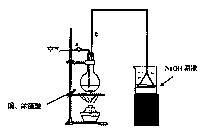
(1)烧杯中用NaOH溶液吸收的物质是:___________ (填化学式),利用倒置的漏斗而不是将导气管直接深入烧杯中的目的是:_____________________________ 。
(2)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是:_____________________ 。
待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的_____ (填仪器序号“a”或“b”)起到了确保硫酸体积保持不变的作用。
(3)将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行______ 、_______ 、______ 后称量硫酸钡的质量为13.98g,请计算能与铜反应的硫酸的最低浓度是________________________ 。
(4)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因________________ 。

(1)烧杯中用NaOH溶液吸收的物质是:
(2)加热烧瓶20分钟,烧瓶中发生反应的化学方程式是:
待烧瓶中反应基本结束,撤去酒精灯,利用烧瓶中的余热使反应进行完全。然后由导管a通入足量的空气,以确保烧瓶中的SO2气体全部进入烧杯中。在该实验装置中的
(3)将充分反应后的烧杯取下,向其中加入足量的酸化的双氧水,再加入足量的BaCl2溶液,再进行
(4)有的同学提出在上面(4)中可以不必加入酸化的双氧水,直接进行后面的实验,也能得到准确的数据,请结合你的理解分析是否需要加入双氧水及原因
您最近一年使用:0次



