氮及其化合物与人类生产、生活息息相关.回答下列问题:
(1)基态N原子中电子在2p轨道上的排布遵循的原则是__________ ,前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为__________ 。
(2)C、N、O三种元素第一电离能从大到小的顺序是__________ 。
(3)N2F2分子中N原子的杂化方式是__________ ,l mol N2F2含有__________ molσ键.
(4)NF3的键角__________ NH3的键角(填“<”“>”或“=”),原因是__________ .
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4__________ mol配位键.
(6)安全气囊的设计原理为6NaN3+FeIO3 Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑
①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子__________ .
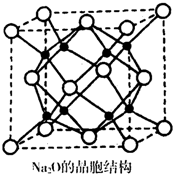
②Na2O的晶胞结构如图所示,晶胞边长为566pm,晶胞中氧原子的配位数为__________ ,Na2O晶体的密度为__________ g•cm-3(只要求列算式,不必计算出结果)。
(1)基态N原子中电子在2p轨道上的排布遵循的原则是
(2)C、N、O三种元素第一电离能从大到小的顺序是
(3)N2F2分子中N原子的杂化方式是
(4)NF3的键角
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一.l mol NH4BF4
(6)安全气囊的设计原理为6NaN3+FeIO3
 Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质.写出两种与N3-互为等电子体的分子或离子
②Na2O的晶胞结构如图所示,晶胞边长为566pm,晶胞中氧原子的配位数为

更新时间:2016-12-09 15:30:05
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】碳原子构成的单质具有多种同素异形体,也对应着有多种不同晶体类型。请根据以下信息,回答下列问题。
(1)下图为金刚石的晶胞:

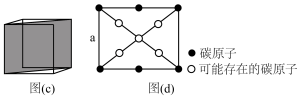
①沿晶胞对角面取得截图(如图c方式截图),所得截图如图d所示,请在图d中白圈处找出未画出的碳原子,请在图中白圈处找出未画出的碳原子,并在相应位置上按图示碳原子涂黑_______ 。
②已知在金刚石晶体中,每个碳原子周围的任意两根碳碳键被2个六元碳环所共有,请计算:金刚石晶体中每个碳原子被_______ 个六元碳环所共有,每个C—C被_______ 个六元碳环所共用。
③若再将任何两个成键的碳原子连线的中心处插入一个氧原子,就构成了某种特殊“碳氧化物”的晶胞。下列说法正确的是_______ (填标号)。
a.该“碳氧化物”晶体中每个碳原子周围的氧原子数是2
b.一个晶胞中含有8个“碳氧化物”分子
c.该“碳氧化物”的化学式为CO2
d.这种晶体是共价晶体
(2)①下图为石墨和石墨烯的结构示意图。石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。下列关于石墨与石墨烯的说法正确的是_______ 。

A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取sp2杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.层内碳原子间存在共价键
E.石墨烯中平均每个六元碳环含有3个碳原子
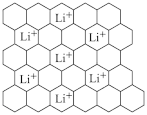
②石墨可用作锂离子电池的负极材料,Li+嵌入石墨的两层间,导致石墨的层堆积方式发生改变,形成化学式为LixC6的嵌入化合物,某石墨嵌入化合物的平面结构如图所示,则x=_______ ;若每个六元环都对应一个Li+,则化学式为_______ 。
(1)下图为金刚石的晶胞:

①沿晶胞对角面取得截图(如图c方式截图),所得截图如图d所示,请在图d中白圈处找出未画出的碳原子,请在图中白圈处找出未画出的碳原子,并在相应位置上按图示碳原子涂黑

②已知在金刚石晶体中,每个碳原子周围的任意两根碳碳键被2个六元碳环所共有,请计算:金刚石晶体中每个碳原子被
③若再将任何两个成键的碳原子连线的中心处插入一个氧原子,就构成了某种特殊“碳氧化物”的晶胞。下列说法正确的是
a.该“碳氧化物”晶体中每个碳原子周围的氧原子数是2
b.一个晶胞中含有8个“碳氧化物”分子
c.该“碳氧化物”的化学式为CO2
d.这种晶体是共价晶体
(2)①下图为石墨和石墨烯的结构示意图。石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。下列关于石墨与石墨烯的说法正确的是

A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取sp2杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.层内碳原子间存在共价键
E.石墨烯中平均每个六元碳环含有3个碳原子
②石墨可用作锂离子电池的负极材料,Li+嵌入石墨的两层间,导致石墨的层堆积方式发生改变,形成化学式为LixC6的嵌入化合物,某石墨嵌入化合物的平面结构如图所示,则x=

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】钛、铬、铁、镍、铜等金属及其化合物在工业上都有重要用途。
(1)基态钛原子外围电子的轨道表达式为_____ 。与钛同周期的元素中,基态原子的未成对电子数与钛原子相同的有_____ 种。
(2)TiCl4是氯化法制取钛的中间产物。TiCl4和SiC14在常温下都是液体,分子结构相同。采用蒸馏的方法分离TiCl4和SiCl4的混合物,先获得的馏分是_____ (填化学式)。
(3)[Cr(C2O4)2(H2O2)]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有_____ 键。
(4)雷氐盐(Reinecke salt)的化学式为NH4[Cr(NCS)4(NH3)2] • H2O,是一种易溶于水和乙醇的暗红色固体。
①雷氏盐中铬元素的化合价为_____ 。
②NCS的立体构型是_____ ,其中碳原子的杂化轨道类型为_____ 。
③SO2、CO2、BeCl2、SCl2四种分子中,与NCS-互为等电子体的有_____ (填化学式)。
(5)Ni和La的合金是目前使用广泛的储氢材料,具有容量大、寿命长、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
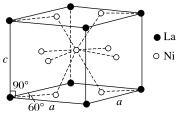
①晶体的化学式为_____ 。
②该晶胞的密度为dg•cm-3。设NA为阿伏加 德罗常数的值,则该晶胞的体积是____ (用含d、NA的代数式表示)cm3。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知: a=511pm,c=397pm;标准状况下,氢气的密度为8.98X10-5 g, ,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_____ (保留整数)。
(1)基态钛原子外围电子的轨道表达式为
(2)TiCl4是氯化法制取钛的中间产物。TiCl4和SiC14在常温下都是液体,分子结构相同。采用蒸馏的方法分离TiCl4和SiCl4的混合物,先获得的馏分是
(3)[Cr(C2O4)2(H2O2)]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有
(4)雷氐盐(Reinecke salt)的化学式为NH4[Cr(NCS)4(NH3)2] • H2O,是一种易溶于水和乙醇的暗红色固体。
①雷氏盐中铬元素的化合价为
②NCS的立体构型是
③SO2、CO2、BeCl2、SCl2四种分子中,与NCS-互为等电子体的有
(5)Ni和La的合金是目前使用广泛的储氢材料,具有容量大、寿命长、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①晶体的化学式为
②该晶胞的密度为dg•cm-3。设NA为阿伏加 德罗常数的值,则该晶胞的体积是
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知: a=511pm,c=397pm;标准状况下,氢气的密度为8.98X10-5 g,
 ,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】 、
、 、
、 都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
(1) 位于元素周期表的
位于元素周期表的___________ 区, 的价层电子排布图为
的价层电子排布图为___________ 。
(2)向黄色的三氯化铁溶液中加入无色的 溶液,溶液变成红色。该反应在有的教材中用方程式
溶液,溶液变成红色。该反应在有的教材中用方程式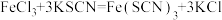 表示。经研究表明,
表示。经研究表明,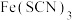 是配合物,
是配合物, 与
与 不仅能以1∶3的个数比配合,还可以其他个数比配合。请按要求填空:
不仅能以1∶3的个数比配合,还可以其他个数比配合。请按要求填空:
①所得 与
与 的配合物中,主要是
的配合物中,主要是 与
与 以个数比1∶1配合所得离子显红色。含该离子的化学式是
以个数比1∶1配合所得离子显红色。含该离子的化学式是___________ 。
②铁的另一种配合物铁氰化钾 俗称赤血盐,可用于检验
俗称赤血盐,可用于检验 ,两者反应生成带有特征蓝色的沉淀,请用离子方程式说明原理
,两者反应生成带有特征蓝色的沉淀,请用离子方程式说明原理___________ ,该赤血盐其配体的电子式为:___________ 。
(3) 的某种化合物的结构如图所示,该化合物中既含有配位键,又含有氢键,其中配位键和氢键均采用虚线表示。
的某种化合物的结构如图所示,该化合物中既含有配位键,又含有氢键,其中配位键和氢键均采用虚线表示。
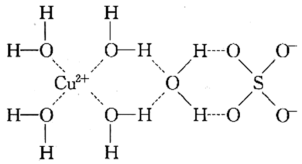
 该化合物中含有
该化合物中含有 键的个数为
键的个数为___________ 。
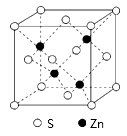
(4)S与 形成的某种晶体的晶胞如图所示,该晶胞中
形成的某种晶体的晶胞如图所示,该晶胞中 微粒的配位数为
微粒的配位数为___________ ,该化合物的化学式为___________ 。
(5)已知 晶体的熔点约为
晶体的熔点约为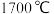 ,构成
,构成 晶体的作用力是
晶体的作用力是___________ 。
 、
、 、
、 都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。
都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。(1)
 位于元素周期表的
位于元素周期表的 的价层电子排布图为
的价层电子排布图为(2)向黄色的三氯化铁溶液中加入无色的
 溶液,溶液变成红色。该反应在有的教材中用方程式
溶液,溶液变成红色。该反应在有的教材中用方程式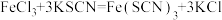 表示。经研究表明,
表示。经研究表明,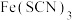 是配合物,
是配合物, 与
与 不仅能以1∶3的个数比配合,还可以其他个数比配合。请按要求填空:
不仅能以1∶3的个数比配合,还可以其他个数比配合。请按要求填空:①所得
 与
与 的配合物中,主要是
的配合物中,主要是 与
与 以个数比1∶1配合所得离子显红色。含该离子的化学式是
以个数比1∶1配合所得离子显红色。含该离子的化学式是②铁的另一种配合物铁氰化钾
 俗称赤血盐,可用于检验
俗称赤血盐,可用于检验 ,两者反应生成带有特征蓝色的沉淀,请用离子方程式说明原理
,两者反应生成带有特征蓝色的沉淀,请用离子方程式说明原理(3)
 的某种化合物的结构如图所示,该化合物中既含有配位键,又含有氢键,其中配位键和氢键均采用虚线表示。
的某种化合物的结构如图所示,该化合物中既含有配位键,又含有氢键,其中配位键和氢键均采用虚线表示。
 该化合物中含有
该化合物中含有 键的个数为
键的个数为(4)S与
 形成的某种晶体的晶胞如图所示,该晶胞中
形成的某种晶体的晶胞如图所示,该晶胞中 微粒的配位数为
微粒的配位数为
(5)已知
 晶体的熔点约为
晶体的熔点约为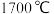 ,构成
,构成 晶体的作用力是
晶体的作用力是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】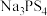 是固态电解质(SSE),具有与液体电解质相当高的离子电导率。回答下列问题:
是固态电解质(SSE),具有与液体电解质相当高的离子电导率。回答下列问题:
(1)基态硫原子核外电子占据最高能层的符号是___________ ,核外电子云轮廓图呈球形与哑铃形的能级上电子数之比为___________ 。
(2)焰色试验可用于检验钠及其化合物,焰色试验中的特殊焰色属于___________ (填“吸收”或“发射”)光谱的颜色;钾与钠产生焰色不同的原因是___________ 。
(3)在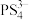 中,S元素显
中,S元素显___________ (填“正”或“负”)价,理由是___________ 。
(4)P的第一电离能___________ (填“>”或“<”)S的第一电离能,其原因为___________ 。
(5)钠原子激发态的电子排布式有___________ (填标号,下同),其中能量较高的是___________ 。
a.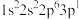 b.
b. c.
c.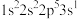 d.
d.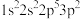
(6)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃,其晶胞结构如图所示。A、B点的原子坐标如图所示,则C点的原子坐标为___________ 。
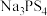 是固态电解质(SSE),具有与液体电解质相当高的离子电导率。回答下列问题:
是固态电解质(SSE),具有与液体电解质相当高的离子电导率。回答下列问题:(1)基态硫原子核外电子占据最高能层的符号是
(2)焰色试验可用于检验钠及其化合物,焰色试验中的特殊焰色属于
(3)在
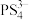 中,S元素显
中,S元素显(4)P的第一电离能
(5)钠原子激发态的电子排布式有
a.
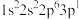 b.
b. c.
c.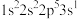 d.
d.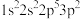
(6)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃,其晶胞结构如图所示。A、B点的原子坐标如图所示,则C点的原子坐标为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】2023年化学诺贝尔奖授予了三位研究量子点的科学家。量子点又称“人造原子”、“超原子”,是一种纳米级的半导体材料,在医疗,科技等多个领域有广泛的应用。
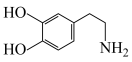
(1)聚多巴胺量子点具有广泛的光学吸收和荧光特性,可直接用于体内成像。多巴胺结构如下图所示。___________ ,其最高能层上有___________ 种运动状态不同的电子。
②多巴胺分子中碳原子的杂化方式为___________ ,1mol多巴胺中含有 键的数目为
键的数目为___________ 。
③多巴胺易溶于水,原因是___________ 。
(2)聚多巴胺量子点还可以通过吸附金属离子如 ,
, ,
, 等用于核磁共振成像(MRI)。
等用于核磁共振成像(MRI)。
① 中含有
中含有 ,其阴离子空间构型为
,其阴离子空间构型为___________ 。
②Mn的第三电离能大于Fe的第三电离能,原因是___________ 。
(3)CdS量子点是一种常见的量子点。
某种CdS晶体的立方晶胞如下图所示。 的配位数为
的配位数为___________ 。
②若CdS晶体的密度为 ,则晶胞中
,则晶胞中 和
和 间的最短距离为
间的最短距离为___________ pm(列出计算式即可)。
(1)聚多巴胺量子点具有广泛的光学吸收和荧光特性,可直接用于体内成像。多巴胺结构如下图所示。
②多巴胺分子中碳原子的杂化方式为
 键的数目为
键的数目为③多巴胺易溶于水,原因是
(2)聚多巴胺量子点还可以通过吸附金属离子如
 ,
, ,
, 等用于核磁共振成像(MRI)。
等用于核磁共振成像(MRI)。①
 中含有
中含有 ,其阴离子空间构型为
,其阴离子空间构型为②Mn的第三电离能大于Fe的第三电离能,原因是
(3)CdS量子点是一种常见的量子点。
某种CdS晶体的立方晶胞如下图所示。

 的配位数为
的配位数为②若CdS晶体的密度为
 ,则晶胞中
,则晶胞中 和
和 间的最短距离为
间的最短距离为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】硼、碳、氮元素形成的化合物极为丰富。
(1)吡啶( )是一种常见的配体,其中含有与苯类似的大
)是一种常见的配体,其中含有与苯类似的大 键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。
键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。
(2) 、
、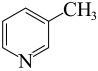 、
、 均可作为配体,则三者中配位能力最弱的是
均可作为配体,则三者中配位能力最弱的是__________ ,其原因为__________ 。
(3)某种新型储氢材料的晶胞如图所示,其中八面体中心为 ,顶点均为配体
,顶点均为配体 ;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则
;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则__________ ,晶体类型是__________ , 与硼原子间的最短距离为
与硼原子间的最短距离为__________ cm(用含a代数式表示)。
(4)下列有关说法正确的是__________。
(1)吡啶(
 )是一种常见的配体,其中含有与苯类似的大
)是一种常见的配体,其中含有与苯类似的大 键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。
键,则吡啶中N原子的价层孤电子对占据的轨道为__________(填标号)。A. 轨道 轨道 | B. 轨道 轨道 | C. 杂化轨道 杂化轨道 | D. 杂化轨道 杂化轨道 |
(2)
 、
、 、
、 均可作为配体,则三者中配位能力最弱的是
均可作为配体,则三者中配位能力最弱的是(3)某种新型储氢材料的晶胞如图所示,其中八面体中心为
 ,顶点均为配体
,顶点均为配体 ;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则
;四面体中心为硼原子,顶点均为氢原子。该晶胞为立方体形,边长为a pm,则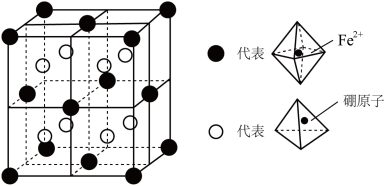
 与硼原子间的最短距离为
与硼原子间的最短距离为(4)下列有关说法正确的是__________。
| A.电负性:N>H>B | B.沸点:吡啶>苯 |
| C.第一电离能:N>C>O | D.基态 的简化电子排布式: 的简化电子排布式: |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】某绿色农药结构简式如图,回答下列问题。

(1)基态硒原子价电子排布式为__________ ,该农药组成元素中,第一电离能较大的前三种元素是________ (按由大到小顾序排列)。
(2)分子中编号为①的碳原子和与其成键的另外几个原子构成的空间结构为_________ ;CSe2首次是由H2Se 和CCl4 反应制取的,试比较上述三种分子的键角_____________ (按由大到小顺序排列)。
(3)H2SeO3 分子的中心原子杂化类型是____________ ,试比较H2SeO3、H2SeO4 和H2SO4三种酸的酸性强弱(按由强到弱顺序排列)_______________ 。
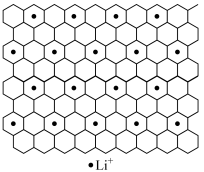
(4)石墨是碳元素的一种同素异形体,石墨晶体可看作ABABA...堆积方式。碱金属离子可填充在石墨层问形成石墨夹层化合物,同时堆积方式从ABABAB...变为AAAA...。下图为石墨夹层化合物W 的投影图,试写出W 的学式_____ ,微粒之间存在的化学键有______ 。

(1)基态硒原子价电子排布式为
(2)分子中编号为①的碳原子和与其成键的另外几个原子构成的空间结构为
(3)H2SeO3 分子的中心原子杂化类型是
(4)石墨是碳元素的一种同素异形体,石墨晶体可看作ABABA...堆积方式。碱金属离子可填充在石墨层问形成石墨夹层化合物,同时堆积方式从ABABAB...变为AAAA...。下图为石墨夹层化合物W 的投影图,试写出W 的学式

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】 、
、 常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:
常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:
(1) 的VSEPR模型是
的VSEPR模型是______ 。已知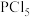 中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知
中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知 中P的杂化类型为
中P的杂化类型为______ (填标号)。 B.
B. C.
C. D.
D.
(2)已知,①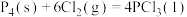
 kJ⋅mol
kJ⋅mol ,
,
②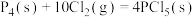
 kJ⋅mol
kJ⋅mol (
(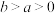 )。
)。
则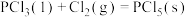

______ (用含a、b、c的式子表示)kJ⋅mol 。
。
(3)实验测得 的速率方程为
的速率方程为 (k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为
(k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为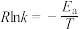 (R为常数,
(R为常数, 为活化能,T为绝对温度)。
为活化能,T为绝对温度)。 和
和 ,实验测得在催化剂Cat1、Cat2下
,实验测得在催化剂Cat1、Cat2下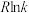 与
与 的关系如图乙所示。催化效能较高的是
的关系如图乙所示。催化效能较高的是______ (填“Cat1”或“Cat2”),判断依据是____________ 。
②将2n mol 和n mol
和n mol 充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时,
充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时, 为a mol,如果此时移走n mol
为a mol,如果此时移走n mol 和0.5n mol
和0.5n mol  ,在相同温度下再达到平衡时
,在相同温度下再达到平衡时 的物质的量为x,则x为
的物质的量为x,则x为______ (填标号)。
A. mol B.
mol B. mol C.
mol C. mol D.0.5a mol
mol D.0.5a mol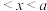 mol
mol
(4)向恒容密闭容器中投入0.2 mol 和0.2 mol
和0.2 mol  ,发生反应:
,发生反应: ,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。
,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。____________ ;曲线c改变的条件可能是____________ 。
②曲线b条件下,该反应平衡常数( )为
)为______ 。[提示:用分压计算的平衡常数为压强平衡常数 ,分压=总压×物质的量分数。]
,分压=总压×物质的量分数。]
 、
、 常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:
常用于制造农药等。磷在氯气中燃烧生成这两种卤化磷。请回答下列问题:(1)
 的VSEPR模型是
的VSEPR模型是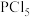 中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知
中P原子的d能级参与杂化,分子呈三角双锥形(如图甲),由此推知 中P的杂化类型为
中P的杂化类型为
 B.
B. C.
C. D.
D.
(2)已知,①
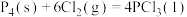
 kJ⋅mol
kJ⋅mol ,
,②
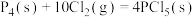
 kJ⋅mol
kJ⋅mol (
(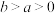 )。
)。则
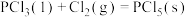

 。
。(3)实验测得
 的速率方程为
的速率方程为 (k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为
(k为速率常数,只与温度、催化剂有关),速率常数k与活化能的经验关系式为 (R为常数,
(R为常数, 为活化能,T为绝对温度)。
为活化能,T为绝对温度)。
 和
和 ,实验测得在催化剂Cat1、Cat2下
,实验测得在催化剂Cat1、Cat2下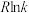 与
与 的关系如图乙所示。催化效能较高的是
的关系如图乙所示。催化效能较高的是②将2n mol
 和n mol
和n mol 充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时,
充入体积不变的密闭容器中,一定条件下发生上述反应,达到平衡时, 为a mol,如果此时移走n mol
为a mol,如果此时移走n mol 和0.5n mol
和0.5n mol  ,在相同温度下再达到平衡时
,在相同温度下再达到平衡时 的物质的量为x,则x为
的物质的量为x,则x为A.
 mol B.
mol B. mol C.
mol C. mol D.0.5a mol
mol D.0.5a mol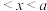 mol
mol(4)向恒容密闭容器中投入0.2 mol
 和0.2 mol
和0.2 mol  ,发生反应:
,发生反应: ,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。
,在不同条件下进行,反应体系总压强随时间的变化如图丙所示。
②曲线b条件下,该反应平衡常数(
 )为
)为 ,分压=总压×物质的量分数。]
,分压=总压×物质的量分数。]
您最近一年使用:0次
【推荐3】某小组探究不同阴离子与Ag+的结合倾向并分析相关转化Ag
资料:a. 和
和 均为白色,难溶于水。
均为白色,难溶于水。
b. 与
与 、
、 能生成
能生成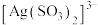 、
、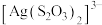
(1)探究 、
、 与
与 的结合倾向
的结合倾向
向NaCl溶液中加入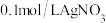 溶液,产生白色浑浊:再向其中滴入
溶液,产生白色浑浊:再向其中滴入 溶液,溶液变澄清。澄清溶液中
溶液,溶液变澄清。澄清溶液中 价银的存在形式
价银的存在形式___________ (填化学式)。
(2)探究 、
、 、
、 与
与 的结合倾向
的结合倾向
由实验I推知:与 结合倾向:
结合倾向:
___________  (填“>”或“<”)
(填“>”或“<”)
(3)探究 、
、 、
、 与
与 的结合倾向
的结合倾向
实验步骤:取两等份AgBr浊液,分别滴加等浓度等体积的 和
和 溶液。
溶液。
实验现象:___________
实验结论:与 结合倾向
结合倾向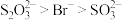 ,请补全实验现象。
,请补全实验现象。
(4)探究 与
与 的反应
的反应
写出实验Ⅳ中白色沉淀变黑色的化学方程式并分析原因___________ 。
(5)从结构角度解释上述实验的结论
① 可以看做是
可以看做是 中的一个O原子被S原子取代,则
中的一个O原子被S原子取代,则 的空间构型为
的空间构型为___________ 。资料显示S原子与 结合比O原子更稳定。试从空间结构角度解释
结合比O原子更稳定。试从空间结构角度解释 与
与 、
、 结合倾向强弱的原因
结合倾向强弱的原因___________ 。
②Cl-、Br-、I-与Ag+的结合生成沉淀的Ksp逐渐减小,试从化学键类型的角度解释在水溶液中溶解度的变化___________ (已知电负性:Cl 3.0 Br 2.8 I 2.5 Ag 1.9)。
资料:a.
 和
和 均为白色,难溶于水。
均为白色,难溶于水。b.
 与
与 、
、 能生成
能生成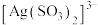 、
、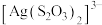
(1)探究
 、
、 与
与 的结合倾向
的结合倾向向NaCl溶液中加入
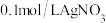 溶液,产生白色浑浊:再向其中滴入
溶液,产生白色浑浊:再向其中滴入 溶液,溶液变澄清。澄清溶液中
溶液,溶液变澄清。澄清溶液中 价银的存在形式
价银的存在形式(2)探究
 、
、 、
、 与
与 的结合倾向
的结合倾向 | 实验 | 滴管 | 试管 | 现象 |
| I | 10滴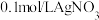 溶液 溶液 | 等浓度的NaI和 溶液 溶液 | 黄色沉淀 | |
| Ⅱ | 等浓度的NaI和 溶液 溶液 | 黄色沉淀 |
 结合倾向:
结合倾向:
 (填“>”或“<”)
(填“>”或“<”)(3)探究
 、
、 、
、 与
与 的结合倾向
的结合倾向实验步骤:取两等份AgBr浊液,分别滴加等浓度等体积的
 和
和 溶液。
溶液。实验现象:
实验结论:与
 结合倾向
结合倾向 ,请补全实验现象。
,请补全实验现象。(4)探究
 与
与 的反应
的反应 | 实验 | 滴管 | 试管 | 现象 |
| Ⅲ | 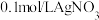 溶液 溶液 | 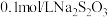 溶液 溶液 | 白色沉淀,振荡后消失 | |
| Ⅳ | 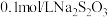 溶液 溶液 | 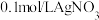 溶液 溶液 | 白色沉淀,逐渐变为灰色,最终为黑色沉淀(AgS) |
(5)从结构角度解释上述实验的结论
①
 可以看做是
可以看做是 中的一个O原子被S原子取代,则
中的一个O原子被S原子取代,则 的空间构型为
的空间构型为 结合比O原子更稳定。试从空间结构角度解释
结合比O原子更稳定。试从空间结构角度解释 与
与 、
、 结合倾向强弱的原因
结合倾向强弱的原因②Cl-、Br-、I-与Ag+的结合生成沉淀的Ksp逐渐减小,试从化学键类型的角度解释在水溶液中溶解度的变化
您最近一年使用:0次
【推荐1】回答下列问题:
(1)氨基酸锌是研究最早和使使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的第一电离能由大到小的顺序是____ 。
②最简单的氨基酸是甘氨酸(结构简式如图),其结构中π键与σ键的数量比为____ 。

(2)分于中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界。
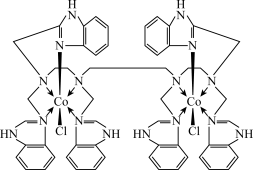
①配合物中每个中心离子的配位数为____ 。
②Co2+的最高能层电子排布式为____ 。
③下列状态的钴中,电离最外层一个电子所需能量最大的是____ (填标号)
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(3)二氯甲醛的结构简式为 ,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是
,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是____ 。
(4)碳酸亚乙酯(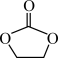 )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因____ 。
(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn,如果成酸元素R相同,则n值越大的R正电性越高,导致R—O—H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱____ 。
(6)氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。晶胞中距离最近的两个O2-之间的距离为apm,MnO晶体的密度为ρg·cm-3,则阿伏加德罗常数的值为____ (用含a和ρ的最简代数式表示)。

(1)氨基酸锌是研究最早和使使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的第一电离能由大到小的顺序是
②最简单的氨基酸是甘氨酸(结构简式如图),其结构中π键与σ键的数量比为

(2)分于中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界。

①配合物中每个中心离子的配位数为
②Co2+的最高能层电子排布式为
③下列状态的钴中,电离最外层一个电子所需能量最大的是
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(3)二氯甲醛的结构简式为
 ,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是
,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是(4)碳酸亚乙酯(
 )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn,如果成酸元素R相同,则n值越大的R正电性越高,导致R—O—H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱
(6)氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。晶胞中距离最近的两个O2-之间的距离为apm,MnO晶体的密度为ρg·cm-3,则阿伏加德罗常数的值为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】镍电池是最早应用于手机、超科等设备的电池种类,它具有良好的大电流放电特性耐过充放电能力强、维护简单。某废旧镍镉电池的回收再生工艺流程如图所示:

部分物质的溶度积常数如下表所示:
回答下列问题:
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为___________ 。
(2)已知镍镉电池的工作原理为 ,则放电时正极的电极反应式为
,则放电时正极的电极反应式为___________ 。
(3)“沉隔”操作选用的沉淀剂为 ,而不选用
,而不选用 的原因为
的原因为___________ 。
(4)“沉镍”过程中为确保滤液中 不超过
不超过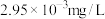 ,需要调节液的
,需要调节液的
___________ 。
(5)“转化I”发生反应的离子方程式为___________ 。
(6)“转化Ⅱ”发生反应的化学方程式为___________ 。
(7)金属镉晶体中原子的堆积方式为六方最密堆积,如图甲所示,晶胞可用图乙表示,则该晶胞中含有的原子个数为___________ ,已知该晶胞的底边长为 ,高为
,高为 ,则该晶体的密度为
,则该晶体的密度为___________  (设
(设 为阿伏加德罗常数的值,列出计算式即可)。
为阿伏加德罗常数的值,列出计算式即可)。
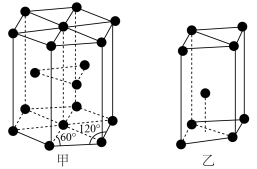

部分物质的溶度积常数如下表所示:
| 物质 |  |  |  |  |
 | 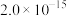 | 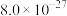 | 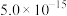 | 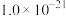 |
(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为(2)已知镍镉电池的工作原理为
 ,则放电时正极的电极反应式为
,则放电时正极的电极反应式为(3)“沉隔”操作选用的沉淀剂为
 ,而不选用
,而不选用 的原因为
的原因为(4)“沉镍”过程中为确保滤液中
 不超过
不超过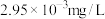 ,需要调节液的
,需要调节液的
(5)“转化I”发生反应的离子方程式为
(6)“转化Ⅱ”发生反应的化学方程式为
(7)金属镉晶体中原子的堆积方式为六方最密堆积,如图甲所示,晶胞可用图乙表示,则该晶胞中含有的原子个数为
 ,高为
,高为 ,则该晶体的密度为
,则该晶体的密度为 (设
(设 为阿伏加德罗常数的值,列出计算式即可)。
为阿伏加德罗常数的值,列出计算式即可)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)基态Fe2+价层电子排布图(轨道表示式)为_______ 。
(2)H、C、Fe 三种元素的电负性由小到大的顺序为_______ 。
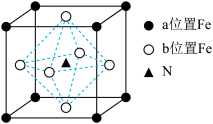
(3)某FexNy的晶胞如图所示(a、b位置均有Fe),若立方晶胞的参数为a nm,阿伏加德罗常数的值为NA,其晶体密度的表达式为_______ g/cm3
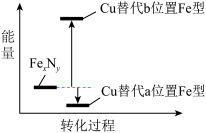
(4)Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如图所示,其中更稳定的Cu替代型产物的化学式为_______ 。该晶体晶胞的另一种表示中,N处于各顶角位置,则Fe处于_______ 位置(填“顶点”、“体心”、“棱心”或“面心”,下同),Cu处于_______ 位置。
(1)基态Fe2+价层电子排布图(轨道表示式)为
(2)H、C、Fe 三种元素的电负性由小到大的顺序为
(3)某FexNy的晶胞如图所示(a、b位置均有Fe),若立方晶胞的参数为a nm,阿伏加德罗常数的值为NA,其晶体密度的表达式为

(4)Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如图所示,其中更稳定的Cu替代型产物的化学式为

您最近一年使用:0次



