金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为____________ ;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO______ FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为________ 、_________ ;
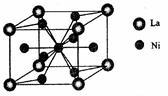
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为_________ ;
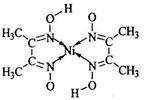
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是________ ,氮镍之间形成的化学键是______ ;
②该结构中,氧氢之间除共价键外还可存在__________ ;
③该结构中,碳原子的杂化轨道类型有______________ 。
(1)Ni原子的核外电子排布式为
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO
(3)NiO晶胞中Ni和O的配位数分别为
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如左下图所示。该合金的化学式为


(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如右上图所示。
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是
②该结构中,氧氢之间除共价键外还可存在
③该结构中,碳原子的杂化轨道类型有
10-11高三上·江苏无锡·期中 查看更多[5]
(已下线)2011届江苏省无锡一中高三上学期期中考试化学卷(已下线)2014高考名师推荐化学--预测16贵州省遵义正安县一中2020届高三上学期开学考试化学试题海南省儋州市鑫源中学2021-2022学年高二下学期期中考试化学试题江苏省无锡市市北高级中学2023-2024学年高二上学期期末检测化学试卷
更新时间:2019-01-30 18:14:09
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】【化学-选修3:物质结构与性质】
我国南京理工大学胡炳成教授团队在N5- 合成上取得了里程碑性研究成果——世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。时隔不久,他们在该领域再次取得突破,成功制得全氮阴离子(N3-)金属盐Co(N5)2(H2O)4·4H2O。这是一种配合物分子,其结构式为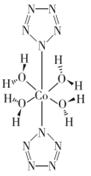 。
。
回答下列问题:
(1)基态氮原子最高能层电子所占用能级的电子云形状为_________ 。
(2)元素的基态气态原子得到一个电子形成气态-1价离子时所放出的能量称作第一电子亲和能(E ),-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如下表所示。
①图中数据显示,同主族元素E1自上而下依次减小,试说明原因________ ;
②下列说法正确的是_______ 。
A.电子亲和能越大,说明越难得到电子
B.一个基态的气态氧原子得到一个电子成为O2-时放出141kJ 的能量
C.氧元素的第二电子亲和能是-780kJ/mol
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
(3)从结构角度分析,按顺序写出R中两种阳离子的立体构型:________ 。
(4)试就上述两种盐进行有关分析:
①热分析结果显示盐(N5)6(H3O)3(NH4)4Cl分解温度高达116.8℃,具有非常好的热稳定性。这与其结构中含有类似苯分子中的大π键有关。N3-中的N 原子的杂化轨道类型为_______ ,N3-中的σ键总数为________ 个。
②金属盐Co(N5)2(H2O)4·4H2O中,中心原子的配位数为______ ,试画出金属盐Co(N5)2(H2O)4·4H2O中钴离子的价电子的排布图_________ 。
(5)R的晶体密度为dg·cm-3,其立方晶胞参数为anm,晶胞中含有y 个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y 的计算表达式为______ (用NA和字母表示)。
我国南京理工大学胡炳成教授团队在N5- 合成上取得了里程碑性研究成果——世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。时隔不久,他们在该领域再次取得突破,成功制得全氮阴离子(N3-)金属盐Co(N5)2(H2O)4·4H2O。这是一种配合物分子,其结构式为
 。
。回答下列问题:
(1)基态氮原子最高能层电子所占用能级的电子云形状为
(2)元素的基态气态原子得到一个电子形成气态-1价离子时所放出的能量称作第一电子亲和能(E ),-1价阴离子再获得一个电子的能量变化叫做第二电子亲和能,部分元素或离子的电子亲和能数据如下表所示。
| 元素 | Cl | Br | I | O | O- |
| 电子亲和能(kJ/mol) | 349 | 343 | 295 | 141 | -780 |
①图中数据显示,同主族元素E1自上而下依次减小,试说明原因
②下列说法正确的是
A.电子亲和能越大,说明越难得到电子
B.一个基态的气态氧原子得到一个电子成为O2-时放出141kJ 的能量
C.氧元素的第二电子亲和能是-780kJ/mol
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
(3)从结构角度分析,按顺序写出R中两种阳离子的立体构型:
(4)试就上述两种盐进行有关分析:
①热分析结果显示盐(N5)6(H3O)3(NH4)4Cl分解温度高达116.8℃,具有非常好的热稳定性。这与其结构中含有类似苯分子中的大π键有关。N3-中的N 原子的杂化轨道类型为
②金属盐Co(N5)2(H2O)4·4H2O中,中心原子的配位数为
(5)R的晶体密度为dg·cm-3,其立方晶胞参数为anm,晶胞中含有y 个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y 的计算表达式为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】(1)下列有关说法正确的是_________________ 。
A.用金属的电子气理论能合理地解释金属易腐蚀的原因
B.手性催化剂只催化或者主要催化一种手性分子的合成
C.草酸二甲酯分子中σ键和π键个数比为6:1
D.MgCO3的热稳定性强于BaCO3
E.根据火山喷出的岩浆中冷却时ZnS比HgS先析出,能判断ZnS的晶格能大于HgS
(2)已知SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8℃、-33℃。依据上述实验事实回答:
①SnCl4中Sn的杂化类型为________ ,SbCl5的晶体类型为_______ ,SbCl3的空间构型为____________ 。
②实验测得在极性溶剂中SbCl5的溶解度比SbCl3的溶解度小得多,其主要原因是___________ 。
(3)人们一直致力于人工固氮的研究,以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物。其中一类是含Mo(钼)、Fe、S原子的类立方体结构,如下图所示:
图中所有实线均代表化学键,左右两边对称,各含一个类立方体的结构。每个类立方体含有4个Fe原子、4个S原子,它们位于立方体的8分顶点,且同种原子不相邻。(已知元素电负性分别为:S—2.5 Fe—1.8 Mo—1.8)
①Mo与Cr是同族元素,并且位于相邻周期,写出基态Mo原子的价电子的轨道表达式为_____________ 。
②钼是一种人体必需的微量元素。工业上可用辉钼矿(MoS2)焙烧除硫得三氧化钼,写出该过程的化学方程式___________________ 。
③上述一个类立方体中4个Fe原子所在的顶点连接所构成的空间几何体为_____________ 。
④在类立方体结构中,一种最近的S原子和S原子间距离为apm,该结构的密度为_______ g/cm3(已知NA,只需列式,无需化简)。
A.用金属的电子气理论能合理地解释金属易腐蚀的原因
B.手性催化剂只催化或者主要催化一种手性分子的合成
C.草酸二甲酯分子中σ键和π键个数比为6:1
D.MgCO3的热稳定性强于BaCO3
E.根据火山喷出的岩浆中冷却时ZnS比HgS先析出,能判断ZnS的晶格能大于HgS
(2)已知SbCl3、SbCl5、SnCl4的熔点依次为73.5℃、2.8℃、-33℃。依据上述实验事实回答:
①SnCl4中Sn的杂化类型为
②实验测得在极性溶剂中SbCl5的溶解度比SbCl3的溶解度小得多,其主要原因是
(3)人们一直致力于人工固氮的研究,以获得廉价的氮肥。科学家先后提出并合成了固氮酶的多种模拟物。其中一类是含Mo(钼)、Fe、S原子的类立方体结构,如下图所示:
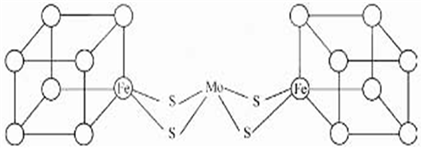
图中所有实线均代表化学键,左右两边对称,各含一个类立方体的结构。每个类立方体含有4个Fe原子、4个S原子,它们位于立方体的8分顶点,且同种原子不相邻。(已知元素电负性分别为:S—2.5 Fe—1.8 Mo—1.8)
①Mo与Cr是同族元素,并且位于相邻周期,写出基态Mo原子的价电子的轨道表达式为
②钼是一种人体必需的微量元素。工业上可用辉钼矿(MoS2)焙烧除硫得三氧化钼,写出该过程的化学方程式
③上述一个类立方体中4个Fe原子所在的顶点连接所构成的空间几何体为
④在类立方体结构中,一种最近的S原子和S原子间距离为apm,该结构的密度为
您最近一年使用:0次
【推荐3】下列为元素周期表中前4周期的元素,根据要求回答下列各小题:
(1)写出下列微粒的核外电子排布式:
①O___________ ;
②Cu___________ 。
(2)写出 Mn的原子结构示意图:___________ 。
(3)写出下列微粒的核外电子排布图:N3-______ 。
(4)Fe 原子的核外电子中,有______ 种运动状态不同的电子,有___________ 种能量不同的电子;Fe3+的化学性质比Fe2+稳定,其原因是___________ 。
(5)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是___________ 。
(6)下列化合物分子中含2个手性碳原子的是
(7)有机铁肥[Cu(NH3)4]SO4·H2O中存在的化学键有___________。(填字母)
(1)写出下列微粒的核外电子排布式:
①O
②Cu
(2)写出 Mn的原子结构示意图:
(3)写出下列微粒的核外电子排布图:N3-
(4)Fe 原子的核外电子中,有
(5)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是
(6)下列化合物分子中含2个手性碳原子的是
A.  | B. 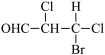 |
C. 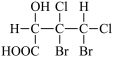 | D. 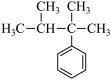 |
| A.离子键 | B.氢键 | C.配位键 | D. 键 键 |
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】下表是元素周期表的一部分,表中所列的数字序号分别代表一种化学元素
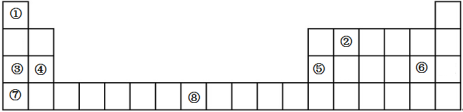
试回答下列问题:
(1)请画出⑧号元素的基态原子价电子排布图_________________________ 。
(2)②号元素(用A表示)形成的一种同素异形体与熔融的⑦号元素(用B表示)形成单质形成A元素间隙化合物,比较常见的A元素间隙化合物是青铜色的化合物,其化学式可写作Ax B,其平面图形见图,则x值为____________ 。

(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表_______ (填元素符号);其中电负性最大的是______ (填图中的序号)(稀有气体除外)。
(4)⑤号元素形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
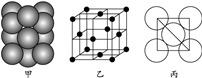
若已知⑤号元素原子半径为d cm,NA代表阿伏伽德罗常数,该元素的相对原子质量为M,则该晶体的密度为____________ g·cm-3(用字母表示)。

试回答下列问题:
(1)请画出⑧号元素的基态原子价电子排布图
(2)②号元素(用A表示)形成的一种同素异形体与熔融的⑦号元素(用B表示)形成单质形成A元素间隙化合物,比较常见的A元素间隙化合物是青铜色的化合物,其化学式可写作Ax B,其平面图形见图,则x值为

(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表

(4)⑤号元素形成的单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知⑤号元素原子半径为d cm,NA代表阿伏伽德罗常数,该元素的相对原子质量为M,则该晶体的密度为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】离子液体是一种只由离子组成的液体,在低温下也能以液态稳定存在,是一种很有研究价值的溶剂。对离子液体的研究显示最常见的离子液体主要由以下的正离子和负离子组成:
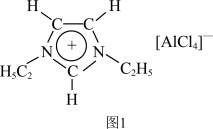
回答下列问题:
(1)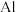 在周期表中的位置是
在周期表中的位置是______ ,其价电子排布式为______ 图 1中负离子的空间构型为______ 。
(2)氯化铝的熔点为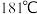 ,氮化铝的熔点高达
,氮化铝的熔点高达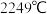 ,它们都是活泼金属和非金属的化合物,熔点相差这么大的原因是
,它们都是活泼金属和非金属的化合物,熔点相差这么大的原因是______ 。
(3)图中正离子有令人惊奇的稳定性,它的电子在其环状结构中高度离域。该正离子中N原子的杂化方式为______ ,C 原子的杂化方式为______ 。
(4)为了使正离子以单体形式存在以获得良好的溶解性能,与N原子相连的 不能被H原子替换,请解释原因:
不能被H原子替换,请解释原因:______ 。
(5) 、Mg、Al三种元素的第一电离能由大到小的顺序是
、Mg、Al三种元素的第一电离能由大到小的顺序是______ 。
(6)已知氮化铝的晶胞结构如图2所示。晶体中氮原子堆积方式如图3所示,这种堆积方式称为______ 。 六棱柱底边边长为acm,高为c cm,阿伏加 德罗常数的值为N,氮化铝晶体的密度为______ 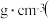 列出计算式
列出计算式 。
。


回答下列问题:
(1)
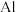 在周期表中的位置是
在周期表中的位置是(2)氯化铝的熔点为
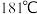 ,氮化铝的熔点高达
,氮化铝的熔点高达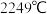 ,它们都是活泼金属和非金属的化合物,熔点相差这么大的原因是
,它们都是活泼金属和非金属的化合物,熔点相差这么大的原因是(3)图中正离子有令人惊奇的稳定性,它的电子在其环状结构中高度离域。该正离子中N原子的杂化方式为
(4)为了使正离子以单体形式存在以获得良好的溶解性能,与N原子相连的
 不能被H原子替换,请解释原因:
不能被H原子替换,请解释原因:(5)
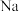 、Mg、Al三种元素的第一电离能由大到小的顺序是
、Mg、Al三种元素的第一电离能由大到小的顺序是(6)已知氮化铝的晶胞结构如图2所示。晶体中氮原子堆积方式如图3所示,这种堆积方式称为
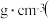 列出计算式
列出计算式 。
。
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】【化学—物质结构与性质】
电石(CaC2)发生如下反应合成尿素[CO(NH2)2],可进一步合成三聚氰胺。

(1)CO(NH2)2分子中含有σ键的个数为______ 。CaCN2中阴离子为CN22-,与CN22-离子互为等电子体的分子的化学式为_______ ,可推知CN22-的空间构型为_________ 。
(2)三聚氰胺在动物体内可转化为三聚氰酸( ),三聚氰酸分子中N原子采取
),三聚氰酸分子中N原子采取______ 杂化。三聚氰胺与三聚氰酸的分子相互之间通过________ 结合,在肾脏内易形成结石。
(3)下图是电石的晶胞示意图,则一个晶胞中含有___ 个Ca2+离子,研究表明,C22-的存在使晶胞呈长方体,该晶胞中一个Ca2+周围距离相等且最近的C22-有___ 个。
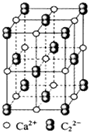
电石(CaC2)发生如下反应合成尿素[CO(NH2)2],可进一步合成三聚氰胺。

(1)CO(NH2)2分子中含有σ键的个数为
(2)三聚氰胺在动物体内可转化为三聚氰酸(
 ),三聚氰酸分子中N原子采取
),三聚氰酸分子中N原子采取(3)下图是电石的晶胞示意图,则一个晶胞中含有

您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】晶体世界丰富多彩,复杂多样,各类晶体具有不同的结构特点,决定着他具有不同的性质和用途,回答下列问题:
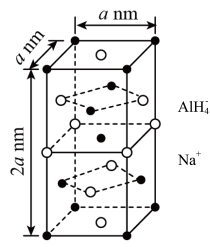
(1)氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。NaAlH4晶体中,与AlH 紧邻且等距的Na+有
紧邻且等距的Na+有_____ 个;NaAlH4晶体的密度为_____ g•cm-3(用含a、NA的代数式表示)。
(2)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示。
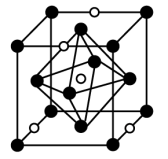
氮化钼的化学式为_____ ,Mo原子周围与之等距离的Mo原子个数为_____ 。
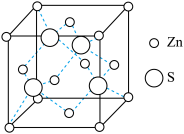
(3)ZnS的晶胞结构如图所示:晶体中S2-填充在Zn2+围成的四面体空隙中,则四面体空隙的填充率为_____ ;已知ZnS的晶胞密度是ag/cm3,则Zn2+与S2-的最短距离为_____ pm(用含a、NA的代数式表示)。
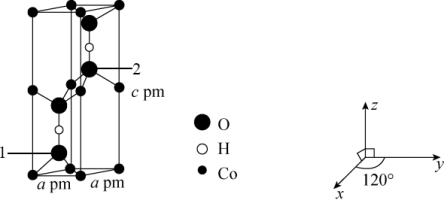
(4)已知Co可形成晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可表示晶胞中各原子的位置,称作原子的分数坐标,已知晶胞含对称中心,其中1号O原子的分数坐标为(0.6667,0.3333,0.1077),2号O原子的分数坐标为_____ 。
(1)氢化铝钠(NaAlH4)是一种新型轻质储氢材料,其晶胞结构如图所示,为长方体。NaAlH4晶体中,与AlH
 紧邻且等距的Na+有
紧邻且等距的Na+有
(2)氮化钼作为锂离子电池负极材料具有很好的发展前景。它属于填隙式氮化物,N原子部分填充在Mo原子立方晶格的八面体空隙中,晶胞结构如图所示。

氮化钼的化学式为
(3)ZnS的晶胞结构如图所示:晶体中S2-填充在Zn2+围成的四面体空隙中,则四面体空隙的填充率为

(4)已知Co可形成晶胞结构如图所示,以晶胞参数为单位长度建立的坐标系可表示晶胞中各原子的位置,称作原子的分数坐标,已知晶胞含对称中心,其中1号O原子的分数坐标为(0.6667,0.3333,0.1077),2号O原子的分数坐标为

您最近一年使用:0次
【推荐2】氮元素是重要的非金属元素,可形成卤化氮、氮化物、叠氮化物及配合物等多种化合物。
(1)NF3、NBr3、NCl3的沸点由高到低的顺序是___ ,原因是__ 。
(2)Mg3N2遇水发生剧烈反应,生成一种有刺激性气味的气体。该反应的化学方程式为___ 。
(3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N 。请写出两种与N
。请写出两种与N 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:___ 。
(4)NaN3与KN3相比,NaN3的晶格能___ (填“>”、“=”或“<”)KN3的晶格能。
(5)某元素X形成的离子X+中K、L、M三个电子层均充满了电子。它与N3-形成晶体的结构如图所示。X+的符号是___ ,晶体中距离每个N3-最近的X+有___ 个。

(1)NF3、NBr3、NCl3的沸点由高到低的顺序是
(2)Mg3N2遇水发生剧烈反应,生成一种有刺激性气味的气体。该反应的化学方程式为
(3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N
 。请写出两种与N
。请写出两种与N 互为等电子体的分子的化学式:
互为等电子体的分子的化学式:(4)NaN3与KN3相比,NaN3的晶格能
(5)某元素X形成的离子X+中K、L、M三个电子层均充满了电子。它与N3-形成晶体的结构如图所示。X+的符号是

您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的价电子排布式为_________ 。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C___ Ti(填“>”或“<“,下同);第一电离能:N____ O,原因是_________ 。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为___ 形,其中硫原子的杂化方式为_______ ,写出与SO42-互为等电子体的一种分子的化学式:________ 。
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图1,Ti位于立方体的体心。该晶体中,Ca2+的配位数为__ 。
(5)Fe能形成多种氧化物,其中FeO晶胞结构如图2。FeO晶胞边长为428pm则FeO晶体的密度为____ g/cm3(阿伏伽德罗常数的值用NA表示,1pm=10-12m,写出计算式即可)。
(1)Ti基态原子的价电子排布式为
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图1,Ti位于立方体的体心。该晶体中,Ca2+的配位数为
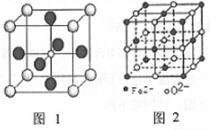
(5)Fe能形成多种氧化物,其中FeO晶胞结构如图2。FeO晶胞边长为428pm则FeO晶体的密度为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】(1)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中Cu原子处于面心,Au原子处于顶点,则该合金中Cu原子与Au原子数量之比为__________ ;该晶体中原子之间的作用力是________ 。
(2)上述晶体具有储氢功能,氢原子可进入由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图1)的结构相似,该晶体储氢后的化学式应为____________ 。
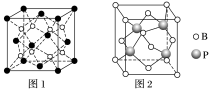
(3)立方BP(磷化硼)的晶胞结构如图2所示,晶胞中含B原子数目为________ 。
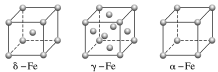
(4)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为________ ,δ、α两种晶胞中铁原子的配位数之比为________ 。
(2)上述晶体具有储氢功能,氢原子可进入由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图1)的结构相似,该晶体储氢后的化学式应为

(3)立方BP(磷化硼)的晶胞结构如图2所示,晶胞中含B原子数目为
(4)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为

您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】 俗称萤石,它的晶胞如图所示,晶胞参数为
俗称萤石,它的晶胞如图所示,晶胞参数为 。据此回答下面问题:
。据此回答下面问题: 的晶胞中有
的晶胞中有___________ 个 ,一个
,一个 距离其最近且相等的F有
距离其最近且相等的F有___________ 个,这些F在空间围成几何图形是___________ 。(填“正方体”或“八面体”或“长方体”)
(2)已知金属钙三维空间采用面心立方最密堆积,钙晶体中钙的配位数是___________ 。
(3) 晶体中,
晶体中, 的配位是
的配位是___________ ,钙离子距离最近的钙离子的核间距为___________  ,密度为
,密度为___________  (列式即可)。提示:阿伏伽德罗常数用
(列式即可)。提示:阿伏伽德罗常数用 表示;Ca的相对原子质量为40,F的相对原子质量为19。
表示;Ca的相对原子质量为40,F的相对原子质量为19。
 俗称萤石,它的晶胞如图所示,晶胞参数为
俗称萤石,它的晶胞如图所示,晶胞参数为 。据此回答下面问题:
。据此回答下面问题:
 的晶胞中有
的晶胞中有 ,一个
,一个 距离其最近且相等的F有
距离其最近且相等的F有(2)已知金属钙三维空间采用面心立方最密堆积,钙晶体中钙的配位数是
(3)
 晶体中,
晶体中, 的配位是
的配位是 ,密度为
,密度为 (列式即可)。提示:阿伏伽德罗常数用
(列式即可)。提示:阿伏伽德罗常数用 表示;Ca的相对原子质量为40,F的相对原子质量为19。
表示;Ca的相对原子质量为40,F的相对原子质量为19。
您最近一年使用:0次

 )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。钾、铁、硒可以形成一种超导材料,其晶胞在
)都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。钾、铁、硒可以形成一种超导材料,其晶胞在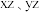 和
和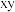 平面投影分别如图所示:
平面投影分别如图所示:
 原子的配位数为
原子的配位数为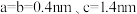 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 (列出计算式)。
(列出计算式)。


