下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:
(1)画出B的离子结构示意图______ ;写出D元素最高价氧化物的水化物电子式_________
(2)盐X水溶液显____ (填“酸”“碱”“中”)性,用离子方程式解释其原因________________
(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为________
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同。Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。该燃料电池放电时,正极的电极反应式是________________________________
(5)如右图是一个电解过程示意图。
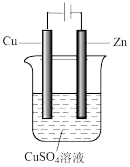
假设使用Y-空气燃料电池作为本过程的电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)_______________ L
| 元素 | 有关信息 |
| A | 元素主要化合价为—2,原子半径为0.074 n m |
| B | 所在主族序数与所在周期序数之差为4 |
| C | 原子半径为0.102 n m,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物的水化物,能按1∶1电离出电子数相等的阴、阳离子 |
| E | 原子半径为0.075 n m,最高价氧化物的水化物与其氢化物组成一种盐X |
(2)盐X水溶液显
(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同。Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。该燃料电池放电时,正极的电极反应式是
(5)如右图是一个电解过程示意图。

假设使用Y-空气燃料电池作为本过程的电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)
10-11高三·河北衡水·阶段练习 查看更多[3]
更新时间:2016-12-09 01:28:31
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】氮的化合物在生产和生活中广泛存在。请回答下列有关问题:
(1)氯胺(NH2Cl)是一种长效缓释消毒剂,可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)
△H=+12kJ·mol-1来制取。

已知部分化学键的键能如上表所示(假定不同物质中同种化学键的键能一样),则a=______ 。
(2)2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
(a)2NO(g) N2O2(g)(快) Va正=Ka正c2(NO),Va逆=Ka逆c2(N2O2),△H1<0
N2O2(g)(快) Va正=Ka正c2(NO),Va逆=Ka逆c2(N2O2),△H1<0
(b)N2O2(g)+ O2(g)=2N02(g) (慢) Vb正=Kb正c2(N2O2)·c2(O2),Vb逆=Kb逆c2(NO2),△H2<0
①一定温度下,反应2NO(g)+O2(g) 2NO2(g)达到平衡状态,其平衡常数K=
2NO2(g)达到平衡状态,其平衡常数K=______ (用ka正、Ka逆、Kb正、Kb逆表示)。
②100KPa时,密闭容器中发生反应2NO(g)+O2(g) 2NO2(g), NO的平衡转化率与温度的关系曲线如右图所示:图中A、B、C三点表示不同温度、压强下达到平衡时NO的转化率,则
2NO2(g), NO的平衡转化率与温度的关系曲线如右图所示:图中A、B、C三点表示不同温度、压强下达到平衡时NO的转化率,则__ 点对应的压强最大,原因是______________ 。
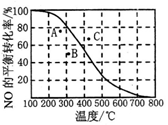
③反应2NO(g)+O2(g) 2NO2(g)在密闭恒容绝热容器中进行,若氧气中混有氮气,容器中还发生了反应:N2(g)+O2(g)
2NO2(g)在密闭恒容绝热容器中进行,若氧气中混有氮气,容器中还发生了反应:N2(g)+O2(g) 2NO(g) △H=+180kJ/mol,则此反应对NO的转化率的影响是
2NO(g) △H=+180kJ/mol,则此反应对NO的转化率的影响是____ (填“增大”、“减小”或“无法判断”)。
④某温度下,反应2NO(g)+O2(g) 2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积.平衡将
2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积.平衡将_____ (填“正反应方向”、“逆反应方向”或“不”)称动。判断的依据是_____ 。
(3)工业上可通过电解NO制备NH4NO3,其工作原理如图所示。
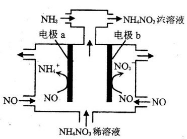
①该装置的阳极是_____ (填“电极a”、“电极b”)。
②电解过程总反应的化学方程式为___________ 。
③若维持电流强度为6A,电解5小时,理论上可制祠NH4NO3的最大质量为_____ g。(已知F=96500C/mol,保留小数点后l位)。
(1)氯胺(NH2Cl)是一种长效缓释消毒剂,可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)
△H=+12kJ·mol-1来制取。

已知部分化学键的键能如上表所示(假定不同物质中同种化学键的键能一样),则a=
(2)2NO(g)+O2(g)
 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:(a)2NO(g)
 N2O2(g)(快) Va正=Ka正c2(NO),Va逆=Ka逆c2(N2O2),△H1<0
N2O2(g)(快) Va正=Ka正c2(NO),Va逆=Ka逆c2(N2O2),△H1<0(b)N2O2(g)+ O2(g)=2N02(g) (慢) Vb正=Kb正c2(N2O2)·c2(O2),Vb逆=Kb逆c2(NO2),△H2<0
①一定温度下,反应2NO(g)+O2(g)
 2NO2(g)达到平衡状态,其平衡常数K=
2NO2(g)达到平衡状态,其平衡常数K=②100KPa时,密闭容器中发生反应2NO(g)+O2(g)
 2NO2(g), NO的平衡转化率与温度的关系曲线如右图所示:图中A、B、C三点表示不同温度、压强下达到平衡时NO的转化率,则
2NO2(g), NO的平衡转化率与温度的关系曲线如右图所示:图中A、B、C三点表示不同温度、压强下达到平衡时NO的转化率,则
③反应2NO(g)+O2(g)
 2NO2(g)在密闭恒容绝热容器中进行,若氧气中混有氮气,容器中还发生了反应:N2(g)+O2(g)
2NO2(g)在密闭恒容绝热容器中进行,若氧气中混有氮气,容器中还发生了反应:N2(g)+O2(g) 2NO(g) △H=+180kJ/mol,则此反应对NO的转化率的影响是
2NO(g) △H=+180kJ/mol,则此反应对NO的转化率的影响是④某温度下,反应2NO(g)+O2(g)
 2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积.平衡将
2NO2(g)中,在保证O2浓度不变的情况下,增大容器的体积.平衡将(3)工业上可通过电解NO制备NH4NO3,其工作原理如图所示。

①该装置的阳极是
②电解过程总反应的化学方程式为
③若维持电流强度为6A,电解5小时,理论上可制祠NH4NO3的最大质量为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】某化学兴趣小组同学对电化学原理进行了一系列探究活动。
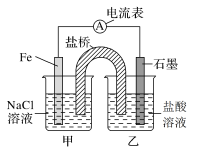
(1)如图,为某化学兴趣小组依据氧化还原反应:___________ (用离子方程式表示)设计的原电池装置,当导线中通过0.0005mol电子的电量时,理论上石墨电极上产生气体体积为___________ ml(标准状况下)。
(2)该实验小组的同学发现,用吸管吸出铁片附近溶液少许置于试管中,滴加几滴酚酞试剂,溶液变红,针对这一现象,某同学的假设是:铁电极材料不纯(材料中含有碳杂质),所以发生了___________ 腐蚀(填“吸氧”或“析氢”),试写出使酚酞溶液变红的电极反应式___________ 。
(3)如图其他条件不变,若将盐桥换成n型铜丝,一段时间后,乙装置中石墨为___________ 极(填“正”、“负”、“阴”或“阳”),乙装置中总反应的离子方程式为___________ ,该反应为___________ (填“自发”或“非自发”)的氧化还原反应。
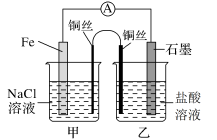
(4)如图其他条件不变,若将盐桥换成铜丝与石墨相连成n型, 一段时间后,乙装置中与铜丝相连的石墨电极上发生的电极反应式为___________ ,产物常用___________ 检验,一段时间后,乙装置中溶液pH___________ (填“变大”、“变小”或“不变”)。
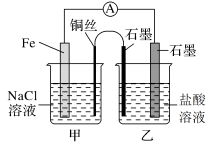

(1)如图,为某化学兴趣小组依据氧化还原反应:
(2)该实验小组的同学发现,用吸管吸出铁片附近溶液少许置于试管中,滴加几滴酚酞试剂,溶液变红,针对这一现象,某同学的假设是:铁电极材料不纯(材料中含有碳杂质),所以发生了
(3)如图其他条件不变,若将盐桥换成n型铜丝,一段时间后,乙装置中石墨为

(4)如图其他条件不变,若将盐桥换成铜丝与石墨相连成n型, 一段时间后,乙装置中与铜丝相连的石墨电极上发生的电极反应式为

您最近一年使用:0次
【推荐3】乙烯是世界上产量最大的化学产品之一,乙烯工业是石油化工产业的核心。
(1)甲醇制备乙烯的主要反应:
i. 2CH3OH(g)=C2H4(g)+2H2O(g) ∆H1=—20.9 kJ/mol
ii. 3CH3OH(g)=C3H6(g)+3H2O(g) ∆H2=—98.1 kJ/mol
iii. 4CH3OH(g)=C4H8(g)+4H2O(g) ∆H3=—118.1 kJ/mol
①C3H6转化为C2H4的热化学方程式iv:2C3H6(g) =3C2H4(g) ∆H4=___________ ,该反应能自发进行的条件是___________ (填“较低”“较高”或“任意”)温度。
②加入N2作为稀释剂,反应i中C2H4的产率将___________ (填“增大”、减小”或“不变”)。
(2)乙炔在Pd表面选择加氢生成乙烯的反应机理如图。其中吸附在Pd表面上的物种用*标注。
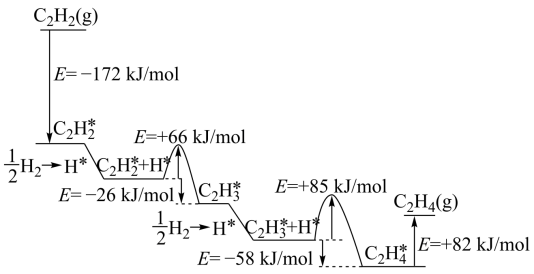
该历程中最大能垒(活化能)Ea(正)=___________ kJ/mol,该步骤的化学方程式为___________ 。
(3)Warker法是目前工业上生产乙醛的最重要方法。其反应如下:
CH2=CH2(g)+ O2(g)
O2(g) CH3CHO(g) ∆H= -243.68kJ/mol
CH3CHO(g) ∆H= -243.68kJ/mol
某温度下,物质的量之比为2:1的CH=CH2和O2在刚性容器内发生反应该反应,若起始总压为1.5 MPa,反应达到平衡时总压减少了25 %,则CH2=CH2的平衡转化率为___________ ,用各物质的平衡分压表示该反应的平衡常数,则Kp=___________ MPa-0.5(只要列出计算式,分压=总压×物质的量分数)。
(4)电解法处理含乙醛的工业废水的总反应为2CH3CHO+H2O CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛和H2SO4溶液为电解质溶液,模拟含乙醛的工业废水,用惰性电极进行电解,其装置如图所示。
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛和H2SO4溶液为电解质溶液,模拟含乙醛的工业废水,用惰性电极进行电解,其装置如图所示。
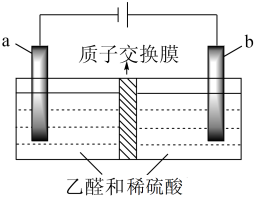
①b上的电极反应式为___________ 。
②在处理过程中,当外电路中的电流I= a A(A为电流单位)时,b分钟处理掉乙醛 c克,则该电解装置的电流效率η=___________ (用含a、b、c的代数式表示)。[已知:F=96500C∙mol-1,η=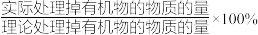 ]
]
(1)甲醇制备乙烯的主要反应:
i. 2CH3OH(g)=C2H4(g)+2H2O(g) ∆H1=—20.9 kJ/mol
ii. 3CH3OH(g)=C3H6(g)+3H2O(g) ∆H2=—98.1 kJ/mol
iii. 4CH3OH(g)=C4H8(g)+4H2O(g) ∆H3=—118.1 kJ/mol
①C3H6转化为C2H4的热化学方程式iv:2C3H6(g) =3C2H4(g) ∆H4=
②加入N2作为稀释剂,反应i中C2H4的产率将
(2)乙炔在Pd表面选择加氢生成乙烯的反应机理如图。其中吸附在Pd表面上的物种用*标注。

该历程中最大能垒(活化能)Ea(正)=
(3)Warker法是目前工业上生产乙醛的最重要方法。其反应如下:
CH2=CH2(g)+
 O2(g)
O2(g) CH3CHO(g) ∆H= -243.68kJ/mol
CH3CHO(g) ∆H= -243.68kJ/mol某温度下,物质的量之比为2:1的CH=CH2和O2在刚性容器内发生反应该反应,若起始总压为1.5 MPa,反应达到平衡时总压减少了25 %,则CH2=CH2的平衡转化率为
(4)电解法处理含乙醛的工业废水的总反应为2CH3CHO+H2O
 CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛和H2SO4溶液为电解质溶液,模拟含乙醛的工业废水,用惰性电极进行电解,其装置如图所示。
CH3CH2OH+CH3COOH。实验室中,以一定浓度的乙醛和H2SO4溶液为电解质溶液,模拟含乙醛的工业废水,用惰性电极进行电解,其装置如图所示。
①b上的电极反应式为
②在处理过程中,当外电路中的电流I= a A(A为电流单位)时,b分钟处理掉乙醛 c克,则该电解装置的电流效率η=
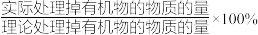 ]
]
您最近一年使用:0次
【推荐1】镍钛钯废靶材含钛55%、镍25%、钯18%和杂质铝2%。从镍钛钯废靶材回收有关金属的工艺流程如下:
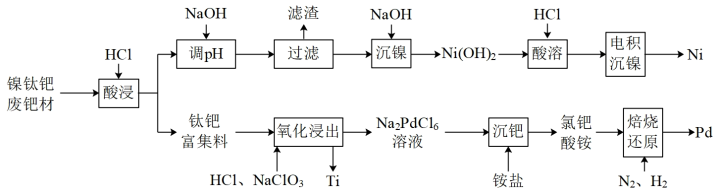
已知:Ⅰ.常温下,钛与钯均不溶于盐酸。
Ⅱ. 在溶液中存在配位平衡:
在溶液中存在配位平衡: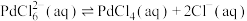

回答下列问题:
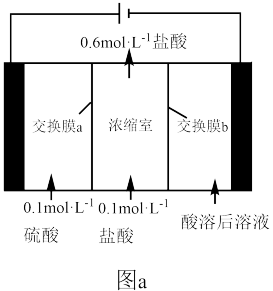
(1)“酸溶”所得溶液,经电积可得单质镍,电积沉镍装置如图a所示。电积装置中,交换膜b应为___________ 离子交换膜(填“阳”或“阴”)。电解时浓缩室溶液体积保持不变,当浓缩室得到 的盐酸时,阴极得到Ni的质量小于
的盐酸时,阴极得到Ni的质量小于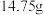 ,其原因为
,其原因为_________ 。
(2)“氧化浸出”时,钯(Pd)被氧化生成配位离子 的离子方程式为
的离子方程式为___________ 。
(3)”沉钯”时,温度保持在55~65℃,温度不易过高,其原因除防止铵盐分解外,还有_____ 。
(4)氯钯酸铵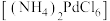 在“焙烧还原”时所用石英管冷凝壁上有大量白色固体析出,该固体可在
在“焙烧还原”时所用石英管冷凝壁上有大量白色固体析出,该固体可在___________ 操作中循环使用(填操作单元名称)。
(5)钯镍合金在较低温度下形成一种超结构有序相,其立方晶胞结构如图所示,晶胞参数为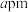 ,结构中有两种八面体空隙,一种完全由镍原子构成(
,结构中有两种八面体空隙,一种完全由镍原子构成(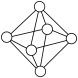 ),另一种由钯原子和镍原子共同构成(
),另一种由钯原子和镍原子共同构成(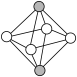 )。
)。
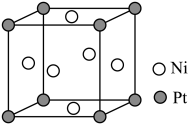
①该晶体的化学式为___________ 。
②两种八面体空隙中心的最近距离为___________ 。

已知:Ⅰ.常温下,钛与钯均不溶于盐酸。
Ⅱ.
 在溶液中存在配位平衡:
在溶液中存在配位平衡: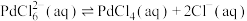

回答下列问题:
(1)“酸溶”所得溶液,经电积可得单质镍,电积沉镍装置如图a所示。电积装置中,交换膜b应为
 的盐酸时,阴极得到Ni的质量小于
的盐酸时,阴极得到Ni的质量小于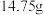 ,其原因为
,其原因为
(2)“氧化浸出”时,钯(Pd)被氧化生成配位离子
 的离子方程式为
的离子方程式为(3)”沉钯”时,温度保持在55~65℃,温度不易过高,其原因除防止铵盐分解外,还有
(4)氯钯酸铵
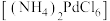 在“焙烧还原”时所用石英管冷凝壁上有大量白色固体析出,该固体可在
在“焙烧还原”时所用石英管冷凝壁上有大量白色固体析出,该固体可在(5)钯镍合金在较低温度下形成一种超结构有序相,其立方晶胞结构如图所示,晶胞参数为
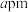 ,结构中有两种八面体空隙,一种完全由镍原子构成(
,结构中有两种八面体空隙,一种完全由镍原子构成( ),另一种由钯原子和镍原子共同构成(
),另一种由钯原子和镍原子共同构成( )。
)。
①该晶体的化学式为
②两种八面体空隙中心的最近距离为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】碲 被誉为尖端技术等工业的维生素。工业上常以粗铜精炼的阳极泥(主要成分是
被誉为尖端技术等工业的维生素。工业上常以粗铜精炼的阳极泥(主要成分是 ,含
,含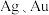 等杂质)为原料提取碲并回收金属,其工艺流程如下图所示:
等杂质)为原料提取碲并回收金属,其工艺流程如下图所示: 与S同一主族,比S原子多2个电子层;
与S同一主族,比S原子多2个电子层; 是两性氧化物,微溶于水。请按要求回答下列问题:
是两性氧化物,微溶于水。请按要求回答下列问题:
(1)碲在元素周期表中的位置_______ ;其最高价氧化物对应的水化物化学式为_______ 。
(2) 与稀
与稀 反应的离子方程式为
反应的离子方程式为_______ 。
(3)步骤①中 发生了(填“氧化”或“还原”或“非氧化还原”)
发生了(填“氧化”或“还原”或“非氧化还原”)_______ 反应;此过程控制 不宜过低的原因是
不宜过低的原因是_______ ;“加压”的目的是_______ 。
(4)步骤②当温度过高时,会导致碲的浸出率降低,原因是_______ 。为提 等滤渣酸浸速率,除适当升温外,还可采取的措施是
等滤渣酸浸速率,除适当升温外,还可采取的措施是_______ (写出1条)。
(5)步骤③铜从(填“阳”或“阴”)_______ 极得到。写出步骤④的离子方程式:_______ 。
(6)常温下,往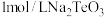 溶液中滴加盐酸,当溶液
溶液中滴加盐酸,当溶液 时,溶液中
时,溶液中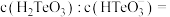
_______ (已知: 的
的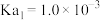 ,
,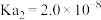 )。
)。
 被誉为尖端技术等工业的维生素。工业上常以粗铜精炼的阳极泥(主要成分是
被誉为尖端技术等工业的维生素。工业上常以粗铜精炼的阳极泥(主要成分是 ,含
,含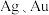 等杂质)为原料提取碲并回收金属,其工艺流程如下图所示:
等杂质)为原料提取碲并回收金属,其工艺流程如下图所示:
 与S同一主族,比S原子多2个电子层;
与S同一主族,比S原子多2个电子层; 是两性氧化物,微溶于水。请按要求回答下列问题:
是两性氧化物,微溶于水。请按要求回答下列问题:(1)碲在元素周期表中的位置
(2)
 与稀
与稀 反应的离子方程式为
反应的离子方程式为(3)步骤①中
 发生了(填“氧化”或“还原”或“非氧化还原”)
发生了(填“氧化”或“还原”或“非氧化还原”) 不宜过低的原因是
不宜过低的原因是(4)步骤②当温度过高时,会导致碲的浸出率降低,原因是
 等滤渣酸浸速率,除适当升温外,还可采取的措施是
等滤渣酸浸速率,除适当升温外,还可采取的措施是(5)步骤③铜从(填“阳”或“阴”)
(6)常温下,往
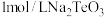 溶液中滴加盐酸,当溶液
溶液中滴加盐酸,当溶液 时,溶液中
时,溶液中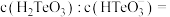
 的
的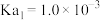 ,
,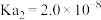 )。
)。
您最近一年使用:0次
【推荐3】氮氧化合物的处理对建设生态文明具有重要意义,可采用多种方法消除。
方法一:氢气还原法
(1)已知H2在催化剂Rh表面还原NO的部分反应机理如表:
①基元反应H2+Rh(s)+Rh(s)→H(s)+H(s)的焓变ΔH=_______ kJ/mol。
②低温时,使用催化剂Pt/Al-M-10-A,将H2和NO以物质的量比1:2充入恒温刚性容器中,发生反应H2(g)+2NO(g)⇌N2O(g)+H2O(g)。下列有关说法错误的是_______ 。
a.当混合气体的平均相对分子质量不再变化时说明反应处于平衡状态
b.任意时刻,2v正(NO)=v逆(H2O)
c.若向容器内充入少量O2,平衡不移动
d.平衡后,向容器中按照物质的量比1∶2再充入H2和NO,平衡向右移动
③将H2、NO、O2按体积比3∶2∶1充入恒温恒压(200℃、100kPa)容器中,发生反应:4H2(g)+2NO(g)+O2(g)⇌N2(g)+4H2O(g),平衡时,N2的体积分数为0.1。NO的平衡转化率为_______ ,平衡常数Kp=_______ (kPa)-2(以分压表示,分压=总压×物质的量分数)。
方法二:一氧化碳还原法
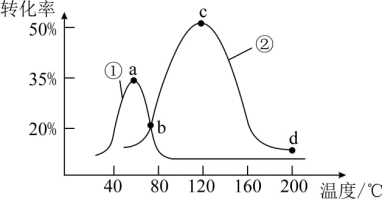
(2)将等物质的量的NO和CO分别充入盛有催化剂①和②的体积相同的刚性容器,进行反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ∆H<0,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因有_______ 。
方法三:间接电化学法
(3)已知:H2S2O4是一种弱酸。利用下图装置可处理燃煤烟气中NO。
①阴极区的电极反应式为_______ 。
②通电时,当电路中转移0.2mole-,吸收的NO在标准状况下的体积为896mL。则NO转化后的产物为_______ 。
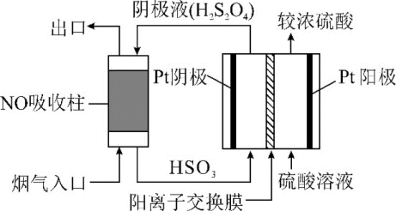
方法一:氢气还原法
(1)已知H2在催化剂Rh表面还原NO的部分反应机理如表:
| 基元反应 | 活化能Ea(kJ·mol-1) |
| H2(g)+Rh(s)+Rh(s)→H(s)+H(s) | 12.6 |
| N(s)+N(s)→N2(s)+Rh(s)+Rh(s) | 120.9 |
| OH(s)+Rh(s)→H(s)+O(s) | 37.7 |
| H(s)+H(s)→H2(g)+Rh(s)+Rh(s) | 77.8 |
| NO(s)→NO(g)+Rh(s) | 108.9 |
①基元反应H2+Rh(s)+Rh(s)→H(s)+H(s)的焓变ΔH=
②低温时,使用催化剂Pt/Al-M-10-A,将H2和NO以物质的量比1:2充入恒温刚性容器中,发生反应H2(g)+2NO(g)⇌N2O(g)+H2O(g)。下列有关说法错误的是
a.当混合气体的平均相对分子质量不再变化时说明反应处于平衡状态
b.任意时刻,2v正(NO)=v逆(H2O)
c.若向容器内充入少量O2,平衡不移动
d.平衡后,向容器中按照物质的量比1∶2再充入H2和NO,平衡向右移动
③将H2、NO、O2按体积比3∶2∶1充入恒温恒压(200℃、100kPa)容器中,发生反应:4H2(g)+2NO(g)+O2(g)⇌N2(g)+4H2O(g),平衡时,N2的体积分数为0.1。NO的平衡转化率为
方法二:一氧化碳还原法
(2)将等物质的量的NO和CO分别充入盛有催化剂①和②的体积相同的刚性容器,进行反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g) ∆H<0,经过相同时间测得NO的转化率如图所示,图中cd段转化率下降的可能原因有

方法三:间接电化学法
(3)已知:H2S2O4是一种弱酸。利用下图装置可处理燃煤烟气中NO。
①阴极区的电极反应式为
②通电时,当电路中转移0.2mole-,吸收的NO在标准状况下的体积为896mL。则NO转化后的产物为

您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】下表是元素周期表的一部分,针对表中的①~⑦元素回答以下问题:
(1)在这些元素原子中,失电子能力最强的是________ (填元素符号)。
(2)单质化学性质最不活泼的元素是________ (填元素符号),其原子结构示意图为______ 。
(3)元素的最高价氧化物对应的水化物中呈两性的是______ (填化学式)。
(4)④、⑤所代表的元素分别与氢元素形成的氢化物中,热稳定性较强的是___________ (填化学式)。
(5)表中元素①的最高价氧化物对应的水化物所含化学键的类型是___________ 。
(6)写出元素③的单质与稀盐酸反应的化学方程式_________________________ 。
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ④ | ⑤ | ||||||
| 三 | ① | ② | ③ | ⑥ | ⑦ |
(1)在这些元素原子中,失电子能力最强的是
(2)单质化学性质最不活泼的元素是
(3)元素的最高价氧化物对应的水化物中呈两性的是
(4)④、⑤所代表的元素分别与氢元素形成的氢化物中,热稳定性较强的是
(5)表中元素①的最高价氧化物对应的水化物所含化学键的类型是
(6)写出元素③的单质与稀盐酸反应的化学方程式
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】(1)氨易溶于水的原因是_______ ;_______ (写出两点即可)。
(2)化学上有一种见解,认为含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越_______ (填“强”或“弱”)。以下各种含氧酸①H3RO4、②(HO)RO3、③H4RO4、④(HO)2RO2的酸性由强到弱的顺序排列为_______ (填序号)。
(3)为了减缓温室效应,科学家设计反应CO2+4H2=CH4+2H2O以减少空气中CO2的排放量。若有1 mol CH4生成,则有_______ mol σ键和_______ mol π键断裂。
(4)已知氮元素是植物生长所需的元素,常见氮肥有铵盐(NH )、尿素
)、尿素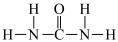 等
等
①尿素分子中四种元素的电负性由大到小顺序是_______ 。
②NH 中H-N-H键角比NH3中H-N-H键角大,原因为
中H-N-H键角比NH3中H-N-H键角大,原因为_______ 。
(5)①与H2O分子互为等电子体的阴离子为_______
②[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为_______ 。
(6)根据对角线规则,铍(Be)与铝性质相似。对铍及其化合物的推断肯定不正确的是_______
a.常温下铍会在浓硫酸中钝化 b.氯化铍是共价化合物
c.氧化铍坚硬难熔 d.氢氧化铍是强碱
(2)化学上有一种见解,认为含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越
(3)为了减缓温室效应,科学家设计反应CO2+4H2=CH4+2H2O以减少空气中CO2的排放量。若有1 mol CH4生成,则有
(4)已知氮元素是植物生长所需的元素,常见氮肥有铵盐(NH
 )、尿素
)、尿素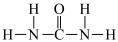 等
等①尿素分子中四种元素的电负性由大到小顺序是
②NH
 中H-N-H键角比NH3中H-N-H键角大,原因为
中H-N-H键角比NH3中H-N-H键角大,原因为(5)①与H2O分子互为等电子体的阴离子为
②[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键。不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为
(6)根据对角线规则,铍(Be)与铝性质相似。对铍及其化合物的推断肯定不正确的是
a.常温下铍会在浓硫酸中钝化 b.氯化铍是共价化合物
c.氧化铍坚硬难熔 d.氢氧化铍是强碱
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素W在周期表中的位置是________ ,XR2的电子式为____ 。
(2)单质X和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为___________ 。Y、W的氢化物沸点高的是_______ (写化学式),原因是___________________ 。
(3)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为___________ 。
请回答下列问题:
(1)元素W在周期表中的位置是
(2)单质X和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为
(3)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐1】化合物A、B、C、D、X之间的转化关系见下图。
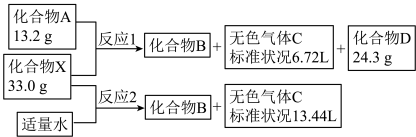
已知:化合物A是一种非金属氧化物,由同周期相邻元素组成,且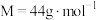 ;化合物
;化合物 含三种元素;化合物D含两种元素,焰色试验呈紫色;化合物B是一种强碱;气体C能使湿润的红色石蕊试纸变蓝色。回答下列问题:
含三种元素;化合物D含两种元素,焰色试验呈紫色;化合物B是一种强碱;气体C能使湿润的红色石蕊试纸变蓝色。回答下列问题:
(1)化合物X中所含的三种元素是___________ ;
(2)化合物D的化学式为___________ ;气体 的电子式为
的电子式为___________ ;
(3)写出化合物X与水反应的化学方程式___________ ;
(4)化合物B的碱性___________ (填“强于”或“弱于”) ,从结构的角度解释可能的原因
,从结构的角度解释可能的原因___________ 。

已知:化合物A是一种非金属氧化物,由同周期相邻元素组成,且
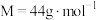 ;化合物
;化合物 含三种元素;化合物D含两种元素,焰色试验呈紫色;化合物B是一种强碱;气体C能使湿润的红色石蕊试纸变蓝色。回答下列问题:
含三种元素;化合物D含两种元素,焰色试验呈紫色;化合物B是一种强碱;气体C能使湿润的红色石蕊试纸变蓝色。回答下列问题:(1)化合物X中所含的三种元素是
(2)化合物D的化学式为
 的电子式为
的电子式为(3)写出化合物X与水反应的化学方程式
(4)化合物B的碱性
 ,从结构的角度解释可能的原因
,从结构的角度解释可能的原因
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐2】A、B、C、D、E、F六种短周期主族元素,其原子序数依次增大,其中B与C同周期,D与E和F周周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D所在周期原子半径最大的主族元素,又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)元素F在周期表中的位置_______________________ ;
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)____________ ;
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有_________ ;检验该化合物中的阳离子的方法是____________________ (用离子方程式表示及文字描述表示)。
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出D元素的最高价氧化物对应的水化物与E的最高价氧化物反应的离子方程式:_______________________ ;若E是非金属元素,其单质在电子工业中有重要应用,请写出其单质溶于强碱溶液的离子方程式:_______________________ 。
(1)元素F在周期表中的位置
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X,X中所含化学键类型有
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出D元素的最高价氧化物对应的水化物与E的最高价氧化物反应的离子方程式:
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4∶1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为2∶1的离子化合物丙。
(1)E在周期表中的位置为___ 。
(2)下列说法正确的有____ 。
①化合物乙分子中只含有极性共价键
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物更稳定
④化合物甲和化合物丙都含有离子键和共价键
(3)将F燃烧的产物通入BaCl2和HNO3的混合溶液中,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应_____ 。
(4)写出一个由以上元素构成的10电子微粒与18电子微粒反应的离子方程式____ 。
(5)A与B可形成一种二元化合物X,其中A元素质量分数为2.33%.据研究X显弱酸性。回答:
①X的电离方程式为_____ 。
②X电离的阴离子结构与二氧化碳相似,则其电子式为__ 。
(1)E在周期表中的位置为
(2)下列说法正确的有
①化合物乙分子中只含有极性共价键
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物更稳定
④化合物甲和化合物丙都含有离子键和共价键
(3)将F燃烧的产物通入BaCl2和HNO3的混合溶液中,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应
(4)写出一个由以上元素构成的10电子微粒与18电子微粒反应的离子方程式
(5)A与B可形成一种二元化合物X,其中A元素质量分数为2.33%.据研究X显弱酸性。回答:
①X的电离方程式为
②X电离的阴离子结构与二氧化碳相似,则其电子式为
您最近一年使用:0次



