元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层的3倍;元素W基态原子的核外电子共有16种运动状态。
(1)在元素周期表中,元素X位于_____ 区,元素Y位于第____ 周期第_____ 族。
Z所在周期中,第一电离能最大的元素是_________ (填元素名称)。
X+的核外电子排布式为_________________________ 。
Y和W两元素最高价氧化物对应的水化物酸性较强的是_________ (填化学式)。
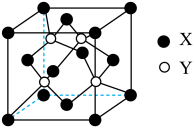
(2)X与Y所形成化合物晶体的晶胞如图所示。在1个晶胞中,X离子的数目为_______ ;该化合物的化学式为______________ 。
(3)在乙醇中的溶解度:Z的氢化物(H2Z)大于H2W,其主要原因是_______________ 。
稳定性: H2Z_____ H2W(填“>”、“<”或“=”),其主要原因是_______ 。
(1)在元素周期表中,元素X位于
Z所在周期中,第一电离能最大的元素是
X+的核外电子排布式为
Y和W两元素最高价氧化物对应的水化物酸性较强的是
(2)X与Y所形成化合物晶体的晶胞如图所示。在1个晶胞中,X离子的数目为

(3)在乙醇中的溶解度:Z的氢化物(H2Z)大于H2W,其主要原因是
稳定性: H2Z
更新时间:2016-12-09 16:29:02
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
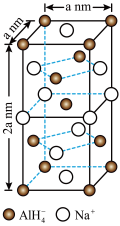
【推荐1】氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如图所示。
(1)基态Ti原子的价电子轨道表示式 为_______ 。
(2)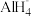 的空间构型为
的空间构型为_______________ ,中心原子Al的轨道杂化方式为_________ ;
(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式 为_________________ (标明配位键)。
(4)NaH的熔点为800℃,不溶于有机溶剂NaH属于_______ 晶体,其电子式为_____________ 。
(5)NaAlH4晶体中,与Na+紧邻且等距的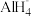 有
有_______ 个;NaAlH4晶体的密度为_________ g·cm-3(用含a的代数式表示)。若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为___________ (填化学式)。
(6)NaAlH4的释氢机理为:每3个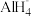 中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为
中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为______________________________________________ 。

(1)基态Ti原子的
(2)
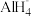 的空间构型为
的空间构型为(3)AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的
(4)NaH的熔点为800℃,不溶于有机溶剂NaH属于
(5)NaAlH4晶体中,与Na+紧邻且等距的
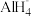 有
有(6)NaAlH4的释氢机理为:每3个
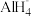 中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为
中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】已知镓(Ga)与铝是同主族元素,它们的化学性质相似。回答下列问题:
(1)镓原子的最外层电子数为___________ 。
(2)下列有关镓和镓的化合物说法正确的是___________ 。
A.Ga的失电子能力比Al弱
B.常温下,Ga可与水剧烈反应放出氢气
C.一定条件下,Ga可溶于盐酸和氢氧化钠溶液
D.一定条件下,Ga2O3可与氢氧化钠溶液反应生成盐
(3)已知酸式电离常数:Ka[Al(OH)3]=2×10-11,Ka[Ga(OH)3]=1.4×10-7,向同浓度的NaGaO2和NaAlO2的混合液中通入适量的CO2气体,先析出的沉淀是___________ ,NaGaO2溶液与CO2反应的离子方程式为___________ 。
(4)已知离子得电子由难到易的顺序为:Zn2+<Ga3+<Fe2+<Cu2+,电解法提纯粗镓(含Zn、Fe、Cu等杂质)原理如图所示。
①电解精炼时,a为电源___________ 极(填“正”或“负”),阳极泥的主要成分是___________ 。
②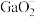 在阴极放电的电极反应式为
在阴极放电的电极反应式为___________ 。

(5)氮化镓(GaN)是一种性能优异的第三代半导体材料,制备的化学方程式为2Ga2O+C+4NH3 4GaN+CO+5H2+H2O制得1molGaN,该反应转移电子为
4GaN+CO+5H2+H2O制得1molGaN,该反应转移电子为___________ mol。
(1)镓原子的最外层电子数为
(2)下列有关镓和镓的化合物说法正确的是
A.Ga的失电子能力比Al弱
B.常温下,Ga可与水剧烈反应放出氢气
C.一定条件下,Ga可溶于盐酸和氢氧化钠溶液
D.一定条件下,Ga2O3可与氢氧化钠溶液反应生成盐
(3)已知酸式电离常数:Ka[Al(OH)3]=2×10-11,Ka[Ga(OH)3]=1.4×10-7,向同浓度的NaGaO2和NaAlO2的混合液中通入适量的CO2气体,先析出的沉淀是
(4)已知离子得电子由难到易的顺序为:Zn2+<Ga3+<Fe2+<Cu2+,电解法提纯粗镓(含Zn、Fe、Cu等杂质)原理如图所示。
①电解精炼时,a为电源
②
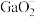 在阴极放电的电极反应式为
在阴极放电的电极反应式为
(5)氮化镓(GaN)是一种性能优异的第三代半导体材料,制备的化学方程式为2Ga2O+C+4NH3
 4GaN+CO+5H2+H2O制得1molGaN,该反应转移电子为
4GaN+CO+5H2+H2O制得1molGaN,该反应转移电子为
您最近半年使用:0次
【推荐3】氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将乙炔催化还原成乙烯。
①基态Fe3+的核外电子排布式为_______ 。
②C、N、O三种元素第一电离能从大到小的顺序是_______ 。
③下列说法正确的有_______ (不定项选择)。
A.C2H2、C2H4都是非极性分子 B.碳负离子CH 呈三角锥形
呈三角锥形
C.NO+电子式为 D.NH3沸点比N2高,主要是因为前者是极性分子
D.NH3沸点比N2高,主要是因为前者是极性分子
(2)NaN3可用于汽车安全气囊。写出两种与N 互为等电子体的分子或离子
互为等电子体的分子或离子_______ 。
(3)烟酰胺是一种含氮有机物,结构简式如图所示,烟酰胺分子中氮原子的杂化轨道类型有_______ ,1 mol该分子中含σ键的数目为_______ 。

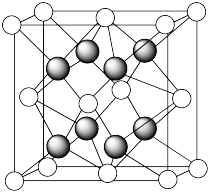
(4)CaF2的晶胞如图所示,若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶胞边长为_______ pm(用含ρ、NA的代数式表示)。
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将乙炔催化还原成乙烯。
①基态Fe3+的核外电子排布式为
②C、N、O三种元素第一电离能从大到小的顺序是
③下列说法正确的有
A.C2H2、C2H4都是非极性分子 B.碳负离子CH
 呈三角锥形
呈三角锥形C.NO+电子式为
 D.NH3沸点比N2高,主要是因为前者是极性分子
D.NH3沸点比N2高,主要是因为前者是极性分子(2)NaN3可用于汽车安全气囊。写出两种与N
 互为等电子体的分子或离子
互为等电子体的分子或离子(3)烟酰胺是一种含氮有机物,结构简式如图所示,烟酰胺分子中氮原子的杂化轨道类型有

(4)CaF2的晶胞如图所示,若该晶体的密度为ρ g/cm3,阿伏加德罗常数的值为NA,则晶胞边长为

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】(NH4)2Fe(SO4)2是分析化学中的重要试剂,受热时分解,产物中含有铁氧化物、SO2,SO3,NH3和水蒸气等。回答下列问题:
(1)Fe2+的电子排布式为______ 。
(2)H,N,O、S的电负性由小到大的顺序是______ 。N、O、S的第一电离能由小到大的顺序是______ 。
(3)H2O2与H2S的相对分子质量相同,但常温下H2O2为液体,H2S为气体,原因是______ 。(NH4)2Fe(SO4)2受热分解时的气态产物中,属于非极性分子的是______ 。
(4)N的一种化合物N2O与CO2互为等电子体,二者结构相似,N2O分子中O只与一个N相连,N2O分子中 键和
键和 键数目之比是
键数目之比是______ 。
(5)(NH4)2Fe(SO4)2溶液中存在多种离子,其中空间结构为正四面体的有______ ;其溶液中存在H3O+离子,该离子中H—O—H的键角______ (填“>”“=”或“<”)单个H2O分子中H—O—H的键角。
(1)Fe2+的电子排布式为
(2)H,N,O、S的电负性由小到大的顺序是
(3)H2O2与H2S的相对分子质量相同,但常温下H2O2为液体,H2S为气体,原因是
(4)N的一种化合物N2O与CO2互为等电子体,二者结构相似,N2O分子中O只与一个N相连,N2O分子中
 键和
键和 键数目之比是
键数目之比是(5)(NH4)2Fe(SO4)2溶液中存在多种离子,其中空间结构为正四面体的有
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】A、B、C、D、E、F六种元素均位于元素周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子占据四个原子轨道;D元素原子的成对电子总数是未成对电子总数的3倍;E与D位于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)基态F核外电子排布式是____ ,最高能级电子的电子云轮廓形状为____ 。
(2)B、C元素的某些氢化物的分子中均含有18个电子,则B元素的这种氢化物的化学式是____ ;B、C元素的这些氢化物的熔、沸点相差较大的主要原因是____ 。
(3)A、B、D可形成分子式为BA2D的某化合物,则该化合物分子中B原子的杂化轨道类型是___ ;A和D还可以形成1:1的化合物,它的电子式为____ 。
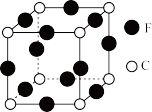
(4)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是____ ,C原子的配位数是____ 。
(1)基态F核外电子排布式是
(2)B、C元素的某些氢化物的分子中均含有18个电子,则B元素的这种氢化物的化学式是
(3)A、B、D可形成分子式为BA2D的某化合物,则该化合物分子中B原子的杂化轨道类型是
(4)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】稀土元素钆(Gd)及其化合物在医药、光学仪器、核反应控制等方面有广泛应用。
(1)钆双胺是新一代安全性高的非离子型磁共振造影剂,其分子结构如图所示。

①钆双胺分子中存在的化学键有_______ 。
A.离子键 B. 氢键 C. 配位键 D. 共价键
②分子中C原子的杂化方式为_______ 。
(2)硫氧化钆GdxOySz(简称GOS)属于离子型六方晶系材料,在辐射检测、增感屏幕和X射线显微镜等方面应用广泛。 GOS晶胞结构如下图所示。

①基态S原子的价电子排布式为_______ 。
②硫氧化钆(GOS)的化学式为_______ 。
③在下图的菱形框中补全该晶胞沿z轴方向的投影图_______ 。

(3)Gd2O3可用于增感荧光材料和核反应堆控制,熔点较高,常温下能与 、CO2等物质发生反应,熔点Gd2O3>H2O>CO2的原因是
、CO2等物质发生反应,熔点Gd2O3>H2O>CO2的原因是_______ 。
(1)钆双胺是新一代安全性高的非离子型磁共振造影剂,其分子结构如图所示。

①钆双胺分子中存在的化学键有
A.离子键 B. 氢键 C. 配位键 D. 共价键
②分子中C原子的杂化方式为
(2)硫氧化钆GdxOySz(简称GOS)属于离子型六方晶系材料,在辐射检测、增感屏幕和X射线显微镜等方面应用广泛。 GOS晶胞结构如下图所示。

①基态S原子的价电子排布式为
②硫氧化钆(GOS)的化学式为
③在下图的菱形框中补全该晶胞沿z轴方向的投影图

(3)Gd2O3可用于增感荧光材料和核反应堆控制,熔点较高,常温下能与
 、CO2等物质发生反应,熔点Gd2O3>H2O>CO2的原因是
、CO2等物质发生反应,熔点Gd2O3>H2O>CO2的原因是
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】元素周期表中的p区元素尽管种类不多,但其化合物种类繁多,在生产、生活和科研中应用广泛。回答下列问题:
(1) 分子的极性
分子的极性_______ (填“大于”或“小于”) ,原因是
,原因是_______ 。
(2)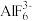 可以稳定存在但是
可以稳定存在但是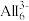 不存在的主要原因是
不存在的主要原因是_______ 。
(3)乙二胺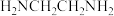 在配合物结构图中常用
在配合物结构图中常用 表示,
表示,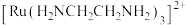 的结构如图所示,中心原子
的结构如图所示,中心原子 的配位数是
的配位数是_______ ,该配离子中的键角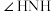
_______ (填“大于”、“等于”或“小于”)乙二胺。
(4)基态 原子的d轨道与p轨道上的电子数之比为
原子的d轨道与p轨道上的电子数之比为_______ 。晶体 (相对分子质量为M)是重要的热电材料之一,该晶体晶胞(以
(相对分子质量为M)是重要的热电材料之一,该晶体晶胞(以 为顶点)的棱长均为
为顶点)的棱长均为 ,棱边夹角均为
,棱边夹角均为 ,
, 和
和 形成类似
形成类似 晶胞的结构,
晶胞的结构, 在
在 形成的四面体空隙处,则晶体的密度为
形成的四面体空隙处,则晶体的密度为_______  (
( 表示阿伏加德罗常数的值),距离
表示阿伏加德罗常数的值),距离 最近的
最近的 有
有_______ 个。纳米材料的量子尺寸效应可以显著提高材料的热电性能,表面原子占总原子数的比例是重要的影响因素,假设某 材料颗粒恰好是由1个上述
材料颗粒恰好是由1个上述 晶胞构成的小立方体,该颗粒的表面原子数与总原子数的最简整数比为
晶胞构成的小立方体,该颗粒的表面原子数与总原子数的最简整数比为_______ 。
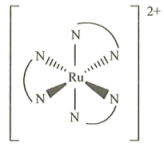
(1)
 分子的极性
分子的极性 ,原因是
,原因是(2)
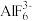 可以稳定存在但是
可以稳定存在但是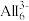 不存在的主要原因是
不存在的主要原因是(3)乙二胺
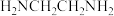 在配合物结构图中常用
在配合物结构图中常用 表示,
表示,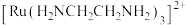 的结构如图所示,中心原子
的结构如图所示,中心原子 的配位数是
的配位数是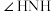
(4)基态
 原子的d轨道与p轨道上的电子数之比为
原子的d轨道与p轨道上的电子数之比为 (相对分子质量为M)是重要的热电材料之一,该晶体晶胞(以
(相对分子质量为M)是重要的热电材料之一,该晶体晶胞(以 为顶点)的棱长均为
为顶点)的棱长均为 ,棱边夹角均为
,棱边夹角均为 ,
, 和
和 形成类似
形成类似 晶胞的结构,
晶胞的结构, 在
在 形成的四面体空隙处,则晶体的密度为
形成的四面体空隙处,则晶体的密度为 (
( 表示阿伏加德罗常数的值),距离
表示阿伏加德罗常数的值),距离 最近的
最近的 有
有 材料颗粒恰好是由1个上述
材料颗粒恰好是由1个上述 晶胞构成的小立方体,该颗粒的表面原子数与总原子数的最简整数比为
晶胞构成的小立方体,该颗粒的表面原子数与总原子数的最简整数比为
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】锰单质及其化合物应用十分广泛。回答下列问题:
(1)Mn在元素周期表中的位置为__ ,基态Mn原子的价电子排布式为__ 。
(2)MnCl2可与NH3反应生成[Mn(NH3)6]Cl2,新生成的化学键为__ 键。NH3分子的空间构型为__ ,其中N原子的杂化轨道类型为__ 。
(3)金属锰有多种晶型,其中δ−Mn的结构为体心立方堆积 ,晶胞参数为αpm。δ−Mn中锰的原子半径为__ pm。已知阿伏加 德罗常数的值为NA,δ−Mn的理论密度ρ=__ g⋅cm−3。(列出计算式)
(4)已知锰的某种氧化物的晶胞如图所示,该氧化物的化学式为__ ,锰离子的配位数为__ 。

(1)Mn在元素周期表中的位置为
(2)MnCl2可与NH3反应生成[Mn(NH3)6]Cl2,新生成的化学键为
(3)金属锰有多种晶型,其中δ−Mn的结构为
(4)已知锰的某种氧化物的晶胞如图所示,该氧化物的化学式为

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】非金属元素虽然种类不多,但是在自然界中的丰度却很大,请回答下列问题:
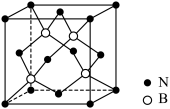
(1)BN(氮化硼,晶胞结构如图)和CO2中的化学键均为共价键,BN的熔点高且硬度大,CO2的晶体干冰却松软且极易升华。由此可以判断: BN可能是_______ 晶体,CO2可能是_______ 晶体,BN晶体中B原子的杂化轨道类型为_______ ,干冰中C原子的杂化轨道类型为_______ 。
(2)磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图甲)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷—石墨复合负极材料,其单层结构俯视图如图乙所示。

回答下列问题:
①根据图甲和图乙的信息,下列说法正确的有_______ (填序号)。
A.黑磷区中P-P键的键能不完全相同。
B.黑磷与石墨都属于混合型晶体
C.由石墨与黑磷制备该复合材料的过程,发生了物理反应
D.复合材料单层中,P原子与C原子之间的作用力属范德华力
②贵金属磷化物Rh2P(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图丙所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为_______ ,晶体的密度为_______ g·cm-3(列出计算式)。
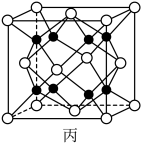
(1)BN(氮化硼,晶胞结构如图)和CO2中的化学键均为共价键,BN的熔点高且硬度大,CO2的晶体干冰却松软且极易升华。由此可以判断: BN可能是

(2)磷及其化合物在电池、催化等领域有重要应用。黑磷与石墨类似,也具有层状结构(如图甲)。为大幅度提高锂电池的充电速率,科学家最近研发了黑磷—石墨复合负极材料,其单层结构俯视图如图乙所示。

回答下列问题:
①根据图甲和图乙的信息,下列说法正确的有
A.黑磷区中P-P键的键能不完全相同。
B.黑磷与石墨都属于混合型晶体
C.由石墨与黑磷制备该复合材料的过程,发生了物理反应
D.复合材料单层中,P原子与C原子之间的作用力属范德华力
②贵金属磷化物Rh2P(化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图丙所示。已知晶胞参数为anm,晶体中与P距离最近的Rh的数目为

您最近半年使用:0次



