A、B、C、D、E、F六种元素均位于元素周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子占据四个原子轨道;D元素原子的成对电子总数是未成对电子总数的3倍;E与D位于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)基态F核外电子排布式是____ ,最高能级电子的电子云轮廓形状为____ 。
(2)B、C元素的某些氢化物的分子中均含有18个电子,则B元素的这种氢化物的化学式是____ ;B、C元素的这些氢化物的熔、沸点相差较大的主要原因是____ 。
(3)A、B、D可形成分子式为BA2D的某化合物,则该化合物分子中B原子的杂化轨道类型是___ ;A和D还可以形成1:1的化合物,它的电子式为____ 。
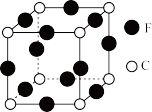
(4)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是____ ,C原子的配位数是____ 。
(1)基态F核外电子排布式是
(2)B、C元素的某些氢化物的分子中均含有18个电子,则B元素的这种氢化物的化学式是
(3)A、B、D可形成分子式为BA2D的某化合物,则该化合物分子中B原子的杂化轨道类型是
(4)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是

更新时间:2022-04-21 18:44:17
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】已知A、B、C、D、E、F均为前四周期元素。A元素的原子价电子排布为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子,B离子与E离子具有相同的电子层结构,可形成E2B2、E2B型化合物。F元素位于元素周期表的ds区,且d亚层电子全满,其原子与E原子具有相同的最外层电子数。
请回答下面的问题:
(1)根据以上信息推断:①B元素为____________ (写元素名称)
②F原子核外的价电子排布为____________ 。
(2)指出在元素周期表中:①D元素在______ 区;②E元素在______ 区。
(3)当n =2时,A与氢元素形成的相对分子质量为26的分子应属于______ 分子(填“极性"或“非极性”),该分子中有______ 个σ键______ 个π键。
(4)当n=3时,A与B形成的晶体属于______ 晶体。A单质的晶体结构中,A原子采用______ 杂化,A原子数与A-A键数之比为____________ 。
(5)DCl2分子中,中心原子D有______ 对孤对电子,用价层电子对互斥模型推测:DCl2分子的空间构型为________ 形。
(6)A—F六种元素中,有一种元素的部分电离能数据如下,它可能是______ (写元素符号)(其中I1 —I7分别表示该元素的第一电离能——第七电离能)。
(7)元素F的某种氧化物的晶体晶胞结构如下图所示,其中实心球表示F原子,则该氧化物的化学式为____________ 。

请回答下面的问题:
(1)根据以上信息推断:①B元素为
②F原子核外的价电子排布为
(2)指出在元素周期表中:①D元素在
(3)当n =2时,A与氢元素形成的相对分子质量为26的分子应属于
(4)当n=3时,A与B形成的晶体属于
(5)DCl2分子中,中心原子D有
(6)A—F六种元素中,有一种元素的部分电离能数据如下,它可能是
| 电离能 | I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| (KJ.mol-1) | 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】(1)计算下列分子或离子中带点“·”原子的价电子对数。
①C Cl4________ ;②B eCl2________ ;③B Cl3________ ;④P Cl3________ 。
(2)计算下列微粒中带点“·”原子的孤电子对数。
①H2S ________ ;②P Cl5________ ;③B F3________ ;④N H3________ 。
①
(2)计算下列微粒中带点“·”原子的孤电子对数。
①H2
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
(1)AsH3的中心原子的杂化轨道类型为___________ ,H2O沸点比H2S的___________ (填“高”或“低”),其判断理由是___________ ,BF3的立体构型为___________ 。
(2)Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为___________ 。
(3)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( ),则原子3的坐标分别为
),则原子3的坐标分别为___________ 。

(1)AsH3的中心原子的杂化轨道类型为
(2)Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为
(3)一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为
 ),则原子3的坐标分别为
),则原子3的坐标分别为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】按要求填空。
(1)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有_______ (填序号),HCHO分子的空间构型是_______ ,易溶于水的有_______ (填序号),理由是:_______ 。
(2)CH3CH=CH2分子中,中间的碳原子的杂化类型为_______ ,该分子中有_______ 个σ键与_______ 个π键。
(3)写出一种与SCN﹣互为等电子的分子____ (用化学式表示),该分子的空间构型为_____
(4)在配合物离子[Fe(SCN)]2+中,提供空轨道接受孤对电子的微粒是_______ ,画出配合物离子[Cu(NH3)4]2+中的配位键_______
(5)配位化学创始人维尔纳发现,将各为1mol的CoCl3•6NH3(黄色),CoCl3•5NH3(紫红色),CoCl3•4NH3(绿色),CoCl3•4NH3(紫色)四种配合物溶于水,加入足量硝酸银溶液,立即沉淀的氯化银分别为3mol,2mol,1mol和1mol,已知上述配合物中配离子的配位数均为6,请根据实验事实用配合物的形式写出COCl3•5NH3的化学式_______
(6)配合物K4[Fe(CN)6]中不存在的作用力_______(填序号)。
(1)在①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有
(2)CH3CH=CH2分子中,中间的碳原子的杂化类型为
(3)写出一种与SCN﹣互为等电子的分子
(4)在配合物离子[Fe(SCN)]2+中,提供空轨道接受孤对电子的微粒是
(5)配位化学创始人维尔纳发现,将各为1mol的CoCl3•6NH3(黄色),CoCl3•5NH3(紫红色),CoCl3•4NH3(绿色),CoCl3•4NH3(紫色)四种配合物溶于水,加入足量硝酸银溶液,立即沉淀的氯化银分别为3mol,2mol,1mol和1mol,已知上述配合物中配离子的配位数均为6,请根据实验事实用配合物的形式写出COCl3•5NH3的化学式
(6)配合物K4[Fe(CN)6]中不存在的作用力_______(填序号)。
| A.共价键 | B.离子键 | C.非极性键 | D.配位键 |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】已知A、B、C、D、E为周期表前四周期原子序数依次增大的五种元素。其中A的基态原子的电子占据2个电子层且原子中成对电子数是未成对电子数的2倍,它的一种单质是天然存在硬度最大的物质;C的基态原子2p能级上的未成对电子数与A原子的相同;D和C位于同一主族,E3+ 离子3d轨道半充满。
(1)E在元素周期表的位置:______________________ 。
(2)在A、B、C三种元素中,第一电离能由大到小的顺序是___________ (用元素符号回答)。
(3)元素B的简单气态氢化物极易溶于水,原因是_____________________ 。
(4)元素C与D所形成的高价化合物分子的立体构型为___________________ 。
(5)化合物X是元素A和C形成的三原子分子,与其互为等电子体的微粒有__________ 。(只写一个)
(6)从原子结构的角度解释E3+比E2+稳定的原因________________________________ 。
(1)E在元素周期表的位置:
(2)在A、B、C三种元素中,第一电离能由大到小的顺序是
(3)元素B的简单气态氢化物极易溶于水,原因是
(4)元素C与D所形成的高价化合物分子的立体构型为
(5)化合物X是元素A和C形成的三原子分子,与其互为等电子体的微粒有
(6)从原子结构的角度解释E3+比E2+稳定的原因
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐3】联合国将2019年定为“国际化学元素周期表年”。元素周期表前四周期的元素a、b、c、d、e、f的原子序数依次增大。a、b、d的价电子层中未成对电子均只有1个,a的基态原子核外有3种不同能量的电子,b、d的单质均能与水剧烈反应,b-和d+核外电子数相差8,c的最外层电子数为其电子层数的2倍,补充维生素D可促进人体对元素e的吸收,f的价电子层中的未成对电子数为4。回答下列问题:
(1)a、b、c的电负性由小到大的顺序为__ (用元素符号表示)。基态f原子的核外电子排布式为___ 。
(2)ab3分子中心原子的杂化方式为__ ,其键角为__ ,ab3的熔点比eb2的熔点低的原因是__ 。
(3)c的简单氢化物与同族相邻两种元素所形成的简单氢化物沸点由高到低的顺序为__ (用化学式表示),理由:__ 。
(4)CO与f形成的f(CO)5常温下是一种浅黄色液体,熔点-20.5℃,沸点103℃,该物质属于__ 晶体,f(CO)5的空间构型为__ ,提供孤电子对的原子是__ (填元素符号),CO分子中σ键与π键数目之比为__ 。
(1)a、b、c的电负性由小到大的顺序为
(2)ab3分子中心原子的杂化方式为
(3)c的简单氢化物与同族相邻两种元素所形成的简单氢化物沸点由高到低的顺序为
(4)CO与f形成的f(CO)5常温下是一种浅黄色液体,熔点-20.5℃,沸点103℃,该物质属于
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】有五种短周期元素A、B、X、D、E,它们的原子序数依次递增,A元素的一种核素可用于考古时判断文物的年代,X是地壳中含量最多的元素,D的氧化物具有两性,E和X同族。F为第四周期的元素,F3+离子的3d能级电子为半充满。根据以上信息,回答下列问题:
(1)元素A基态原子的价电子排布图(轨道表示式)为___________ ,F2+的电子排布式为___________ 。
(2)元素A、B、X电负性由大到小的顺序为___________ (用元素符号表示,下同),基态X原子比基态B原子的第一电离能低的原因是___________ 。
(3)元素E原子核外有___________ 种不同运动状态的电子。 D元素基态原子的最高能级符号为___________ 。
(4)元素B的简单氢化物的沸点比同主族相邻元素氢化物的高,原因是___________ 。
(5)下列说法正确的是___________ (填标号)。
①简单离子半径:X>D
②简单氢化物的稳定性:X<E
③B的氧化物对应的水化物都是强酸
④D和E的简单离子在水溶液中不能大量共存
(1)元素A基态原子的价电子排布图(轨道表示式)为
(2)元素A、B、X电负性由大到小的顺序为
(3)元素E原子核外有
(4)元素B的简单氢化物的沸点比同主族相邻元素氢化物的高,原因是
(5)下列说法正确的是
①简单离子半径:X>D
②简单氢化物的稳定性:X<E
③B的氧化物对应的水化物都是强酸
④D和E的简单离子在水溶液中不能大量共存
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】三磷酸腺苷(ATP)是生物体的供能物质,由腺苷(A)与磷酸反应而成。_____ 。
(2)ATP比A更易溶于水,从微粒间相互作用的角度解释其原因:_____ 。
(3)ATP的碱基中,碳原子的杂化方式为_____ 。
(4)ATP中的碱基与尿嘧啶作用时,形成的氢键的种类可能有_____ 。(用“X—H…Y”表示)。_____ 。
②PO 是一种配体。PO
是一种配体。PO 配位时配位原子是
配位时配位原子是_____ ,理由是_____ 。

(2)ATP比A更易溶于水,从微粒间相互作用的角度解释其原因:
(3)ATP的碱基中,碳原子的杂化方式为
(4)ATP中的碱基与尿嘧啶作用时,形成的氢键的种类可能有


②PO
 是一种配体。PO
是一种配体。PO 配位时配位原子是
配位时配位原子是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】现有几组物质的熔点(℃)数据:
(1)A组中硅晶体的熔点低于金刚石,原因是_______ 。
(2)C组中HF相对分子质量小于 但熔点却高于
但熔点却高于 ,是由于
,是由于_______ 。
(3)D组晶体中 、
、 、
、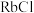 、
、 的熔点由高到低的顺序为
的熔点由高到低的顺序为_______ 。
(4) 晶体的晶胞如图所示,与NaCl的晶胞结构相似。若将
晶体的晶胞如图所示,与NaCl的晶胞结构相似。若将 由顶点转换成体心,则
由顶点转换成体心,则 的位置转换为
的位置转换为_______ 。 晶体在
晶体在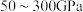 的高压下和
的高压下和 反应生成如图所示的晶胞结构,则该晶体的化学式为
反应生成如图所示的晶胞结构,则该晶体的化学式为_______ 。 的晶胞如图所示,密度为
的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为anm,则
的最近核间距为anm,则 的摩尔质量为
的摩尔质量为_______ 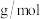 (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
| A组 | B组 | C组 | D组 |
| 金刚石:3550 | Li:181 | HF: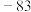 |  |
| 硅晶体:1410 | Na:98 |  : :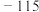 |  |
| 硼晶体:2300 | K:64 |  : :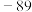 | 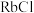 |
| 二氧化硅:1732 | Rb:39 | HI: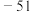 |  |
(1)A组中硅晶体的熔点低于金刚石,原因是
(2)C组中HF相对分子质量小于
 但熔点却高于
但熔点却高于 ,是由于
,是由于(3)D组晶体中
 、
、 、
、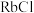 、
、 的熔点由高到低的顺序为
的熔点由高到低的顺序为(4)
 晶体的晶胞如图所示,与NaCl的晶胞结构相似。若将
晶体的晶胞如图所示,与NaCl的晶胞结构相似。若将 由顶点转换成体心,则
由顶点转换成体心,则 的位置转换为
的位置转换为
 晶体在
晶体在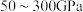 的高压下和
的高压下和 反应生成如图所示的晶胞结构,则该晶体的化学式为
反应生成如图所示的晶胞结构,则该晶体的化学式为
 的晶胞如图所示,密度为
的晶胞如图所示,密度为 ,相邻的两个
,相邻的两个 的最近核间距为anm,则
的最近核间距为anm,则 的摩尔质量为
的摩尔质量为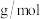 (列出代数式,设
(列出代数式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】铁被称为“第一金属”,硫被称为“生命元素”,它们形成的物质种类非常丰富,在生产、生活中用途广泛。
(1)基态S原子有___ 种能量不同的电子,其价电子排布图为___ 。
(2)硫能形成S2O 、SO
、SO 等多种含氧酸根,试推测S2O
等多种含氧酸根,试推测S2O 的空间构型为
的空间构型为___ ,SO 的中心原子杂化方式为
的中心原子杂化方式为___ 。
(3)SCN-与Fe3+能发生显色反应,该反应常用作检验Fe3+的存在。
①铁元素位于元素周期表的___ 区。
②SCN-的三种元素的电负性由大到小的顺序为___ (用元素符号表示)。写出与SCN-互为等电子体的分子的分子式___ (任写一种)。
③Fe(SCN)3中不存在的化学键有___ (填标号)。
A.离子键B.极性键C.非极性键D.配位键E.σ键F.π键
(4)部分卤化铁的熔点如下表所示:
解释表中物质之间熔点差异的原因___ 。
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B两种方块组成。
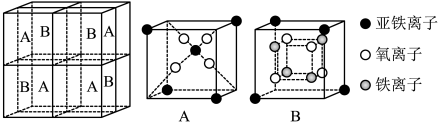
①该氧化物中Fe2+、Fe3+、O2-个数的最简整数比为___ 。
②已知该晶体的密度为dg·cm-3,阿伏加 德罗常数的值为NA,则晶胞参数a为___ nm(用含d和NA的代数式表示)。
(1)基态S原子有
(2)硫能形成S2O
 、SO
、SO 等多种含氧酸根,试推测S2O
等多种含氧酸根,试推测S2O 的空间构型为
的空间构型为 的中心原子杂化方式为
的中心原子杂化方式为(3)SCN-与Fe3+能发生显色反应,该反应常用作检验Fe3+的存在。
①铁元素位于元素周期表的
②SCN-的三种元素的电负性由大到小的顺序为
③Fe(SCN)3中不存在的化学键有
A.离子键B.极性键C.非极性键D.配位键E.σ键F.π键
(4)部分卤化铁的熔点如下表所示:
| 卤化铁 | FeF3 | FeCl3 |
| 熔点/℃ | 1100 | 306 |
解释表中物质之间熔点差异的原因
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B两种方块组成。

①该氧化物中Fe2+、Fe3+、O2-个数的最简整数比为
②已知该晶体的密度为dg·cm-3,阿伏加 德罗常数的值为NA,则晶胞参数a为
您最近一年使用:0次
【推荐2】R、T、W、X、Y、Z为前四周期元素,且W、X、Y、Z的核电荷数依次增大。表中列出它们的性质和结构:
(1)Y原子的核外电子排布式为___________ ,它的核外有___________ 种运动状态不同的电子,Z原子的价电子排布图为___________ 。
(2)R、T、X的第一电离能由大到小的顺序为___________ (用元素符号填空)
(3)WTR分子中的三个原子除W原子外均为8电子构型,根据电子云重叠方式的不同,分子里共价键的类型有___________ 。
(4)与Z同周期的某三价阳离子比其二价阳离子更稳定,其原因是:___________ ;该元素位于周期表___________ 区。
(5)RW3分子的立体构型为___________ ;与TX2互为等电子体的分子有___________ (写两种)。
(6)钛酸钡是一种典型钙钛矿型结构晶体,写出其化学式:___________ 。

| 元素编号 | 元素性质或原子结构 |
| R | 原子价电子排布式为nsnnpn+1 |
| T | 基态原子核外3个能级上有电子,且各能级上的电子数相等 |
| W | 原子电子层数与核外电子数相等 |
| X | 核外s能级上的电子总数与p能级上的电子总数相等 |
| Y | 元素的原子半径在该周期中最大(除稀有气体外) |
| Z | 第四周期未成对电子数最多的元素 |
(2)R、T、X的第一电离能由大到小的顺序为
(3)WTR分子中的三个原子除W原子外均为8电子构型,根据电子云重叠方式的不同,分子里共价键的类型有
(4)与Z同周期的某三价阳离子比其二价阳离子更稳定,其原因是:
(5)RW3分子的立体构型为
(6)钛酸钡是一种典型钙钛矿型结构晶体,写出其化学式:

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】近年来,铅卤钙钛矿太阳能电池的光电转化效率迅速发展,已经接近成熟的光伏技术。
(1)基态 原子的价电子排布式为
原子的价电子排布式为 ______ ,比较第一电离能大小:
______  填“
填“ ”、“
”、“ ”或“
”或“ ”
” 。
。
(2)①钙钛矿电池中某材料的晶胞结构如图 ,沿
,沿 、
、 、
、 轴的投影均为图
轴的投影均为图 ,其中
,其中 位于六个碘离子形成的正八面体中心。其化学式为
位于六个碘离子形成的正八面体中心。其化学式为 ______ 。
②若该材料的最简式的摩尔质量为 ,晶体密度为
,晶体密度为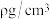 ,则该晶体中相邻的
,则该晶体中相邻的 之间的最短距离为
之间的最短距离为 ______  列出计算式即可,
列出计算式即可, 为阿佛加德罗常数的值
为阿佛加德罗常数的值

(3)我国某研究所于 年研制出一种新型离子液体
年研制出一种新型离子液体 如图
如图 可弥补该电池表面的
可弥补该电池表面的 和
和 缺陷,进一步提高该电池的性能。
缺陷,进一步提高该电池的性能。

①离子液体 中存在的化学键类型是
中存在的化学键类型是 ______  填选项字母
填选项字母 。
。
 离子键
离子键  共价键
共价键  极性共价键
极性共价键  氢键
氢键
②离子液体 中不同杂化方式的碳原子个数比:
中不同杂化方式的碳原子个数比: :
: :
:
______ 。
③相较于传统液态有机溶剂,该离子液体具有难挥发的优点,原因是:______ 。
(1)基态
 原子的价电子排布式为
原子的价电子排布式为 
 填“
填“ ”、“
”、“ ”或“
”或“ ”
” 。
。(2)①钙钛矿电池中某材料的晶胞结构如图
 ,沿
,沿 、
、 、
、 轴的投影均为图
轴的投影均为图 ,其中
,其中 位于六个碘离子形成的正八面体中心。其化学式为
位于六个碘离子形成的正八面体中心。其化学式为 ②若该材料的最简式的摩尔质量为
 ,晶体密度为
,晶体密度为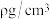 ,则该晶体中相邻的
,则该晶体中相邻的 之间的最短距离为
之间的最短距离为  列出计算式即可,
列出计算式即可, 为阿佛加德罗常数的值
为阿佛加德罗常数的值

(3)我国某研究所于
 年研制出一种新型离子液体
年研制出一种新型离子液体 如图
如图 可弥补该电池表面的
可弥补该电池表面的 和
和 缺陷,进一步提高该电池的性能。
缺陷,进一步提高该电池的性能。 
①离子液体
 中存在的化学键类型是
中存在的化学键类型是  填选项字母
填选项字母 。
。  离子键
离子键  共价键
共价键  极性共价键
极性共价键  氢键
氢键 ②离子液体
 中不同杂化方式的碳原子个数比:
中不同杂化方式的碳原子个数比: :
: :
:
③相较于传统液态有机溶剂,该离子液体具有难挥发的优点,原因是:
您最近一年使用:0次



