(1)计算下列分子或离子中带点“·”原子的价电子对数。
①C Cl4________ ;②B eCl2________ ;③B Cl3________ ;④P Cl3________ 。
(2)计算下列微粒中带点“·”原子的孤电子对数。
①H2S ________ ;②P Cl5________ ;③B F3________ ;④N H3________ 。
①
(2)计算下列微粒中带点“·”原子的孤电子对数。
①H2
更新时间:2018-02-12 13:53:33
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
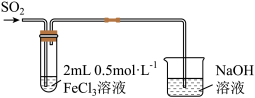
【推荐1】碳元素在自然界中分布很广,是存在形式最复杂的元素。实验室可用邻二氮菲(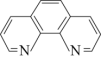 )与
)与 形成的红色配合物(如下图)测定铁的含量。
形成的红色配合物(如下图)测定铁的含量。
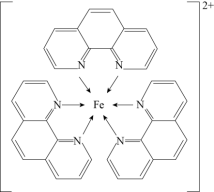
回答下列问题:
(1)基态Fe原子的价层电子排布式为_______ 。
(2)红色配合物中非金属元素的电负性从大到小的顺序为_______ 。
(3)邻二氮菲分子中C和N元素原子的杂化方式分别为_______ 、_______ 。
(4)红色配合物的中心原子的配位数为_______ 。
(5)上世纪末,科学家合成了硬度超过金刚石的 晶体,该晶体的硬度比金刚石大的原因是
晶体,该晶体的硬度比金刚石大的原因是_______ 。
(6)如图是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1 mol La的合金含有Ni的数目为_______ 。
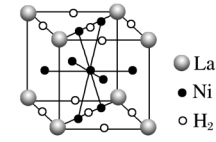
 )与
)与 形成的红色配合物(如下图)测定铁的含量。
形成的红色配合物(如下图)测定铁的含量。
回答下列问题:
(1)基态Fe原子的价层电子排布式为
(2)红色配合物中非金属元素的电负性从大到小的顺序为
(3)邻二氮菲分子中C和N元素原子的杂化方式分别为
(4)红色配合物的中心原子的配位数为
(5)上世纪末,科学家合成了硬度超过金刚石的
 晶体,该晶体的硬度比金刚石大的原因是
晶体,该晶体的硬度比金刚石大的原因是(6)如图是一种镍基合金储氢后的晶胞结构示意图。该合金储氢后,含1 mol La的合金含有Ni的数目为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】铝合金、铝离子电池在材料、能源领域有着重要的作用。回答下列问题。
(1)硬铝合金中含有Si元素,若基态硅原子的电子排布式表示为[Ne]3s23p ,违背了
,违背了____ (填“泡利原理”或“洪特规则”)。
(2)铝离子电池常用离子液体AlCl3/[EMIM]Cl作电解质,其中阴离子有AlCl 、Al2Cl
、Al2Cl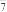 ,阳离子为EMIM+(
,阳离子为EMIM+(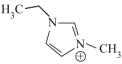 )。
)。
①AlCl 的空间构型为
的空间构型为____ ;Al2Cl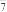 中各原子最外层均达到8电子结构,则其结构式为
中各原子最外层均达到8电子结构,则其结构式为____ 。
②1molEMIM+中所含σ键为____ mol,EMIM+中环上所有原子共面,其中氨原子的杂化方式____ ;为分子中的大π键可用Π 符号:表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
符号:表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π ),则EMIM+中的大π键应表示为
),则EMIM+中的大π键应表示为____ 。
③为使EMIM+以单个形式存在以获得良好的溶解性能,与N原子相连的-CH3、-C2H5,不能被H原子替换,其原因是____ 。
(3)一种金属间化合物的晶胞结构如图所示:
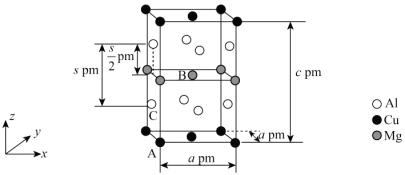
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(0,0,0),B点原子的分数坐标为( ,
, ,
, ),则C点Al原子在z轴方向上的分数坐标z=
),则C点Al原子在z轴方向上的分数坐标z=___ (用含c、s的代数式表示);已知:阿伏加德罗常数的值为NA,则该晶体的密度为____ g•cm-3(列出计算表达式)。
(1)硬铝合金中含有Si元素,若基态硅原子的电子排布式表示为[Ne]3s23p
 ,违背了
,违背了(2)铝离子电池常用离子液体AlCl3/[EMIM]Cl作电解质,其中阴离子有AlCl
 、Al2Cl
、Al2Cl ,阳离子为EMIM+(
,阳离子为EMIM+( )。
)。①AlCl
 的空间构型为
的空间构型为 中各原子最外层均达到8电子结构,则其结构式为
中各原子最外层均达到8电子结构,则其结构式为②1molEMIM+中所含σ键为
 符号:表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
符号:表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π ),则EMIM+中的大π键应表示为
),则EMIM+中的大π键应表示为③为使EMIM+以单个形式存在以获得良好的溶解性能,与N原子相连的-CH3、-C2H5,不能被H原子替换,其原因是
(3)一种金属间化合物的晶胞结构如图所示:

以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(0,0,0),B点原子的分数坐标为(
 ,
, ,
, ),则C点Al原子在z轴方向上的分数坐标z=
),则C点Al原子在z轴方向上的分数坐标z=
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】已知W、X、Y、Z、N是周期表中前四周期元素,它们的核电荷数依次增大。
回答下列问题:
(1)X对应单质的化学式为_______ ,基态Y原子核外电子排布式为_______ 。
(2)X、Y、Z任意两种元素形成的化合物之间发生氧化还原反应的化学方程式为_______ 。
(3)上述五种元素中第一电离能最小的是_______ (填元素符号,下同);W、X、Z三种元素的电负性由大到小的顺序为_______ 。
(4)N2X与N2Z的熔点更高的是_______ 。(填化学式),原因是_______ 。
(5)ZX 和ZX
和ZX 中键角较小的是
中键角较小的是_______ (用离子符号表示),原因是_______ 。
| 元素 | 元素性质或原子结构或离子结构 |
| W | 原子核内无中子 |
| X | 基态原子核外s能级上的电子总数与p能级上的电子总数相等 |
| Y | 元素的原子半径在同周期中最大 |
| Z | 基态原子核外有9种不同空间运动状态的电子,且有2个未成对电子 |
| N | N+的M层全充满 |
(1)X对应单质的化学式为
(2)X、Y、Z任意两种元素形成的化合物之间发生氧化还原反应的化学方程式为
(3)上述五种元素中第一电离能最小的是
(4)N2X与N2Z的熔点更高的是
(5)ZX
 和ZX
和ZX 中键角较小的是
中键角较小的是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】
(1)在配合物Ni(CO)4和 [Cu(NH3)4]2+,[Fe(SCN)]2+配合物离子中,提供空轨道接受孤对电子的原子或离子分别是:_______________ 、___________ 、______________ 。
(2)H3O+的空间构型为:___________________________ ,BCl3的空间构型为:___________
(3)按要求写出第二周期非金属元素构成的中性分子的化学式:(只需写一种)
平面三角形分子________________ ,三角锥形分子_________________________ 。
(1)在配合物Ni(CO)4和 [Cu(NH3)4]2+,[Fe(SCN)]2+配合物离子中,提供空轨道接受孤对电子的原子或离子分别是:
(2)H3O+的空间构型为:
(3)按要求写出第二周期非金属元素构成的中性分子的化学式:(只需写一种)
平面三角形分子
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】I.芦笋中的天冬酰胺(结构如下图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。
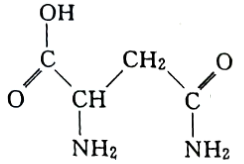
(1)天冬酰胺所含元素中,___________ (填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型为___________ 。
(3)写出铬元素基态原子的电子排布式___________ 。
(4)H2S和H2Se的参数对比见下表。
H2S的键角大于H2Se的原因可能为___________ 。
II.钴的一种配位聚合物的化学式为{[Co(bte)2(H2O)2](NO3)2}n。
(1)bte的分子式为C6H8N6,其结构简式如图所示。
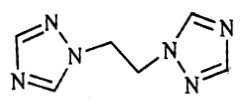
①[Co(bte)2(H2O)2]2+中,与Co2+形成配位键的原子是___________ 和___________ (填元素符号),配位数为___________ 。
②1molbte分子中含σ键的数目为___________ 。
(2)钴的另外四种配合物为CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)。取四种化合物各1mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3mol、2mol、1mol和1mol,请根据实验事实用配合物的形式写出它们的化学式。CoCl3·6NH3___________ ,CoCl3·4NH3(绿色和紫色)___________ 。

(1)天冬酰胺所含元素中,
(2)天冬酰胺中碳原子的杂化轨道类型为
(3)写出铬元素基态原子的电子排布式
(4)H2S和H2Se的参数对比见下表。
| 化学式 | 键长/nm | 键角 | 沸点/°C |
| H2S | 1.34 | 92.3° | -60.75 |
| H2Se | 1.47 | 91.0° | -41.50 |
II.钴的一种配位聚合物的化学式为{[Co(bte)2(H2O)2](NO3)2}n。
(1)bte的分子式为C6H8N6,其结构简式如图所示。

①[Co(bte)2(H2O)2]2+中,与Co2+形成配位键的原子是
②1molbte分子中含σ键的数目为
(2)钴的另外四种配合物为CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)。取四种化合物各1mol,分别溶于水,加入足量硝酸银溶液,立即产生氯化银,沉淀的量分别为3mol、2mol、1mol和1mol,请根据实验事实用配合物的形式写出它们的化学式。CoCl3·6NH3
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】如图是元素周期表的一部分:
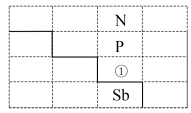
(1)写出元素①的元素符号___________ ,与①同周期的主族元素中,第一电离能比①大的有___________ 种。该周期的某种元素基态原子的核外电子排布式为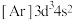 ,则该元素在元素周期表中的位置为
,则该元素在元素周期表中的位置为___________ 。
(2)基态锑(Sb)原子的价电子排布式为___________ 。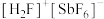 (氟酸锑)是一种超强酸,
(氟酸锑)是一种超强酸, 离子的空间构型为
离子的空间构型为___________ ,写出一种与 互为等电子体的分子
互为等电子体的分子___________ 。
(3)锂电池被广泛应用于储能电源系统。军事等领域。下列Li原子电子排布图表示的状态中,能量最低和最高的分别为___________ 、___________ (填标号)。
A. B.
B.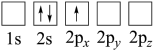
C.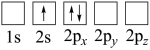 D.
D.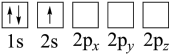
(4)已知基态W原子的价层电子排布式为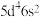 ,与基态Cr原子相比,基态W原子与基态Cr原子的未成对电子数之比为
,与基态Cr原子相比,基态W原子与基态Cr原子的未成对电子数之比为___________ 。
(5)基态Cu原子电子占据的最高能层的符号为________ ,基态Cu原子电子有_________ 种空间运动状态。

(1)写出元素①的元素符号
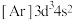 ,则该元素在元素周期表中的位置为
,则该元素在元素周期表中的位置为(2)基态锑(Sb)原子的价电子排布式为
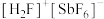 (氟酸锑)是一种超强酸,
(氟酸锑)是一种超强酸, 离子的空间构型为
离子的空间构型为 互为等电子体的分子
互为等电子体的分子(3)锂电池被广泛应用于储能电源系统。军事等领域。下列Li原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B.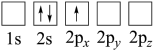
C.
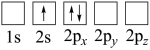 D.
D.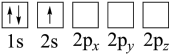
(4)已知基态W原子的价层电子排布式为
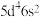 ,与基态Cr原子相比,基态W原子与基态Cr原子的未成对电子数之比为
,与基态Cr原子相比,基态W原子与基态Cr原子的未成对电子数之比为(5)基态Cu原子电子占据的最高能层的符号为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】有A、B、C、D、E五种原子序数增大的元素,只有一种为金属。A、B、C均为第二周期紧邻元素,其第一电离能顺序为B>C>A;B与D同主族;E为第4周期副族元素,其价层电子为全满。
(1)E元素的名称为_________ ,该元素基态原子的价电子排布式为_______________ 。
(2)B与D分别与氢形成最简单氢化物沸点高低顺序为_______ (用化学式表示);原因_________ 。
(3)A、B、C三种元素分别与氢形成化合物中的M-M(M代表A、B、C)单键的键能如下:
上述三种氢化物中,A、B、C元素原子的杂化方式有_____ 种;请解释上表中三种氢化物M-M单键的键能依次下降的原因________________________ 。
(4)D与氯形成的化合物DCl5,加压条件下148℃液化,发生完全电离得到一种能够导电的熔体,测定D-Cl键长为198pm和206pm两种,该熔体中含有一种正四面体结构的阳离子,请写出该条件下DCl5电离的电离方程式_____ ;该熔体中阴离子的空间构型为_________ 。
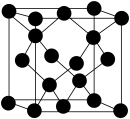
(5)E与C形成的化合物晶体结构有四种,其中一种与金刚石类似,
金刚石晶体结构如下图所示,该晶体的化学式为_____ (用元素符号表示);该晶胞的棱长为a pm则该晶体的密度为________ g·cm-3。
 .
.
(1)E元素的名称为
(2)B与D分别与氢形成最简单氢化物沸点高低顺序为
(3)A、B、C三种元素分别与氢形成化合物中的M-M(M代表A、B、C)单键的键能如下:
| 氢化物 | HxA-AHx | HmB-BHm | HnC-CHn |
| 键能(kJ·mol-1 ) | 346 | 247 | 207 |
(4)D与氯形成的化合物DCl5,加压条件下148℃液化,发生完全电离得到一种能够导电的熔体,测定D-Cl键长为198pm和206pm两种,该熔体中含有一种正四面体结构的阳离子,请写出该条件下DCl5电离的电离方程式
(5)E与C形成的化合物晶体结构有四种,其中一种与金刚石类似,
金刚石晶体结构如下图所示,该晶体的化学式为
 .
.
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】填写下列空白:
(1)下列物质中既有极性键,又有非极性键的极性分子是_______。
(2)BF3的电子式____ ,F—B—F的键角是___ 。BF3和过量的NaF作用可生成NaBF4,BF 的立体构型为
的立体构型为___ 。
(3)甲醇与乙烷的相对分子质量和范德华力均相近,但是二者的沸点相差很大,造成该差异的原因是____ 。
(4)CCl3COOH、C2H5COOH、CF3COOH的酸性由强到弱的顺序为____ 。
(1)下列物质中既有极性键,又有非极性键的极性分子是_______。
| A.SO2 | B.CCl4 | C.H2O2 | D.C2H2 |
 的立体构型为
的立体构型为(3)甲醇与乙烷的相对分子质量和范德华力均相近,但是二者的沸点相差很大,造成该差异的原因是
(4)CCl3COOH、C2H5COOH、CF3COOH的酸性由强到弱的顺序为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某小组探究 与
与 溶液的反应。
溶液的反应。
(1)小组同学预测向 溶液中通入
溶液中通入 ,溶液颜色将由黄色变为浅绿色,预测的依据是
,溶液颜色将由黄色变为浅绿色,预测的依据是___ 。
进行实验
资料: 与
与 可以发生可逆反应,形成红棕色的配离子
可以发生可逆反应,形成红棕色的配离子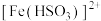 。
。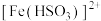 可以将
可以将 还原为
还原为 。
。
(2) 的空间结构是
的空间结构是__________ ,Fe在周期表中属于______________ 区。
(3) 与
与 可以形成配离子的原因是
可以形成配离子的原因是______________________ 。
(4) 溶液中通入
溶液中通入 至饱和,形成
至饱和,形成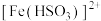 配离子的方程式是
配离子的方程式是_________________ 。
(5)溶液中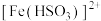 将
将 还原为
还原为 的离子方程式是
的离子方程式是______________________ 。
(6)由实验现象分析,溶液先变为红色,最后慢慢变为浅绿色的可能原因是________ 。
 与
与 溶液的反应。
溶液的反应。(1)小组同学预测向
 溶液中通入
溶液中通入 ,溶液颜色将由黄色变为浅绿色,预测的依据是
,溶液颜色将由黄色变为浅绿色,预测的依据是进行实验
实验装置(夹持仪器略) | 实验现象 |
| 向 溶液中通入 溶液中通入 至饱和,溶液变为红色,静置5min后,溶液的颜色从红色慢慢变为黄色,静置9h后,溶液慢慢由黄色变为浅绿色。 至饱和,溶液变为红色,静置5min后,溶液的颜色从红色慢慢变为黄色,静置9h后,溶液慢慢由黄色变为浅绿色。 |
 与
与 可以发生可逆反应,形成红棕色的配离子
可以发生可逆反应,形成红棕色的配离子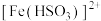 。
。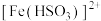 可以将
可以将 还原为
还原为 。
。(2)
 的空间结构是
的空间结构是(3)
 与
与 可以形成配离子的原因是
可以形成配离子的原因是(4)
 溶液中通入
溶液中通入 至饱和,形成
至饱和,形成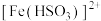 配离子的方程式是
配离子的方程式是(5)溶液中
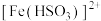 将
将 还原为
还原为 的离子方程式是
的离子方程式是(6)由实验现象分析,溶液先变为红色,最后慢慢变为浅绿色的可能原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】秦始皇帝陵博物院首次在兵马俑的彩绘中发现了古人人工合成的“中国蓝”“中国紫”颜料。人们对这些颜料的研究发现,其成分主要是钡和铜的硅酸盐(BaCuSixOy)。
回答下列问题:
(1)基态铜原子的价电子排布式为___________ 。“中国蓝”的发色中心是以Cu2+为中心的配位化合物,形成该配位键,Cu2+提供___________ ,若“中国蓝”的化学组成中x∶y=2∶5,则其化学式为___________ 。
(2)“中国蓝”“中国紫”中存在SiO 四面体结构,其中Si原子采取的杂化类型为
四面体结构,其中Si原子采取的杂化类型为___________ 。与SiO 不同,CO
不同,CO 的立体构型为
的立体构型为___________ 。
(3)Si和C同主族,但SiO2与CO2的熔沸点差异很大,这是因为SiO2是___________ 晶体,而CO2是___________ 晶体。
(4)BaO的熔沸点___________ MgO(填“>”“<”“=”),原因是___________ 。
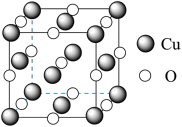
(5)立方CuO晶胞结构如图所示。其中Cu2+的配位数为___________ 。NA代表阿伏加德罗常数的值,晶胞参数为apm,则其晶体密度为___________ g•cm-3(用代数式表示)。
回答下列问题:
(1)基态铜原子的价电子排布式为
(2)“中国蓝”“中国紫”中存在SiO
 四面体结构,其中Si原子采取的杂化类型为
四面体结构,其中Si原子采取的杂化类型为 不同,CO
不同,CO 的立体构型为
的立体构型为(3)Si和C同主族,但SiO2与CO2的熔沸点差异很大,这是因为SiO2是
(4)BaO的熔沸点
(5)立方CuO晶胞结构如图所示。其中Cu2+的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】刀片电池(The blade battery)是比亚迪于2020年3月29日发布的电池产品。正极材料使用了磷酸亚铁锂( ),具有强环境适应性,更安全可靠的特点。磷酸亚铁锂由
),具有强环境适应性,更安全可靠的特点。磷酸亚铁锂由 、
、 (葡萄糖)和
(葡萄糖)和 在高温条件下制备:
在高温条件下制备: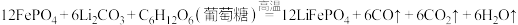 。回答下列问题:
。回答下列问题:
(1)Li位于元素周期表的_____ 区,基态Fe原子的价电子排布式为_________ 。
(2)同周期元素中,第一电离能大于O的原子是_______ 。
(3)有关 叙述正确的是___________。
叙述正确的是___________。
(4) 的空间结构为
的空间结构为______ ,其中P采取____ 杂化方式。
(5)上述反应方程式涉及的物质中最易溶于水的共价化合物是______ ,解释易溶于水的原因_______ 。
 ),具有强环境适应性,更安全可靠的特点。磷酸亚铁锂由
),具有强环境适应性,更安全可靠的特点。磷酸亚铁锂由 、
、 (葡萄糖)和
(葡萄糖)和 在高温条件下制备:
在高温条件下制备: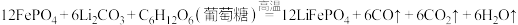 。回答下列问题:
。回答下列问题:(1)Li位于元素周期表的
(2)同周期元素中,第一电离能大于O的原子是
(3)有关
 叙述正确的是___________。
叙述正确的是___________。A.分子中 键和 键和 键个数比为1:1 键个数比为1:1 | B.含有极性键的非极性分子 |
C.分子空间结构与 相同 相同 | D.熔点、沸点高于 |
 的空间结构为
的空间结构为(5)上述反应方程式涉及的物质中最易溶于水的共价化合物是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】钴常见的化合价为+2、+3,钴及其化合物在工业上具有重要的用途。请回答下列问题:
(1)钴在元素周期表中属于___________ 区元素,与钴同周期且基态原子与基态钴原子具有相同未成对电子数的元素是___________ (填元素符号)。
(2)基态Co3+和基态Fe2+分别失去一个电子所需能量较高的是___________ (填离子符号),原因为___________ 。
(3)三氯化六氨合钴(III)是橙黄色单斜晶体,其可以通过如下反应制备:2CoCl2+10NH3+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+2H2O
①H2O2中O原子的杂化方式为___________ 。
②NH3中的H-N-H的键角___________ (填“大于”或“小于”)NH 中H-N-H的键角
中H-N-H的键角
③[Co(NH3)6]Cl3中存在的作用力类型有___________ (填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键 E.金属键
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有___________ mol,该螯合物中N的杂化方式有___________ 种。
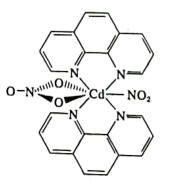
(1)钴在元素周期表中属于
(2)基态Co3+和基态Fe2+分别失去一个电子所需能量较高的是
(3)三氯化六氨合钴(III)是橙黄色单斜晶体,其可以通过如下反应制备:2CoCl2+10NH3+2NH4Cl+H2O2=2[Co(NH3)6]Cl3+2H2O
①H2O2中O原子的杂化方式为
②NH3中的H-N-H的键角
 中H-N-H的键角
中H-N-H的键角③[Co(NH3)6]Cl3中存在的作用力类型有
A.配位键 B.极性键 C.离子键 D.非极性键 E.金属键
(4)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1mol该配合物中通过螯合作用形成的配位键有

您最近一年使用:0次