常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通入少量CO2气体生成HX和NaHCO3;往NaY溶液中通入少量CO2生成HY和Na2CO3。下列有关叙述正确的是
| A.酸性由强至弱:HX>HY>H2CO3 |
| B.结合H+的能力:Y->CO32->X->HCO3- |
| C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3 |
| D.NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |
更新时间:2016-10-20 17:07:46
|
【知识点】 盐类水解规律
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
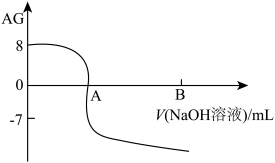
【推荐1】用AG表示溶液的酸度,AG= lg 。常温下,一元酸HA的Ka(HA)=1.0×10-5,实验室中用0.1mol•L-1的NaOH溶液滴定20.00mL某浓度的HA溶液,滴定结果如图所示。下列有关叙述正确的是
。常温下,一元酸HA的Ka(HA)=1.0×10-5,实验室中用0.1mol•L-1的NaOH溶液滴定20.00mL某浓度的HA溶液,滴定结果如图所示。下列有关叙述正确的是
 。常温下,一元酸HA的Ka(HA)=1.0×10-5,实验室中用0.1mol•L-1的NaOH溶液滴定20.00mL某浓度的HA溶液,滴定结果如图所示。下列有关叙述正确的是
。常温下,一元酸HA的Ka(HA)=1.0×10-5,实验室中用0.1mol•L-1的NaOH溶液滴定20.00mL某浓度的HA溶液,滴定结果如图所示。下列有关叙述正确的是
| A.室温下,AG=14-pH |
B.滴定前该HA溶液中HA的电离度为 |
| C.A点时加入NaOH溶液的体积为20.00mL |
| D.若B点时加入NaOH溶液的体积为40.00mL,此时溶液中c(Na+)=c(A-)+c(HA) |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】用pH大小表示溶液的酸碱性相对强弱有许多不足之处.因此,荷兰科学家HenkVanlubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为 与
与 比值的对数,用公式表示为
比值的对数,用公式表示为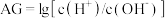 。常温下,在
。常温下,在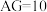 的溶液中能大量共存的离子是( )
的溶液中能大量共存的离子是( )
 与
与 比值的对数,用公式表示为
比值的对数,用公式表示为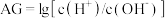 。常温下,在
。常温下,在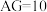 的溶液中能大量共存的离子是( )
的溶液中能大量共存的离子是( )A. 、 、 、 、 、 、 | B. 、 、 、 、 、 、 |
C. 、 、 、 、 、 、 | D. 、 、 、 、 、 、 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】25℃时,用0.0500 mol·L-1H2C2O4溶液滴定 25.00 mL0.l000mol·L-1NaOH溶液所得滴定曲线如图。下列说法正确的是
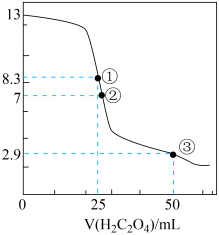

| A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-) |
| B.点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+) |
| C.点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) |
| D.滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
您最近一年使用:0次



