硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO 3、H2O、N2和
3、H2O、N2和__________ 。
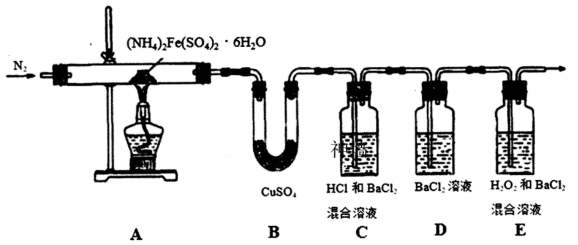
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
①A中固体充分加热较长时间后,通入氮气,目的是__________________________ 。
②为验证A中残留物是否含有FeO,需要选用的试剂有____________ (填字母)。
A.KSCN溶液B.稀硫酸
C.浓盐 酸D.KMnO4溶液
酸D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有________ 气体生成,若含有该气体,观察到的现象为_______________________________________ 。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为b mol,C中沉淀物质的量为a mol,则b________________ (填“大于”“小于”或“等于”)a。
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为___________________________________________ (用离子方程式表示)。
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O的含量,某实验小组做了如下实验:
测定原理:MnO +Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
+Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
测定步骤:步骤一:准确称量20.00 g硫酸亚铁铵晶体,配制成100 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,用0.100 0 mol·L-1KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00 mL。
①如何判断滴定终点?________________________ ;
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为_________________ 。
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO
 3、H2O、N2和
3、H2O、N2和(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。

①A中固体充分加热较长时间后,通入氮气,目的是
②为验证A中残留物是否含有FeO,需要选用的试剂有
A.KSCN溶液B.稀硫酸
C.浓盐
 酸D.KMnO4溶液
酸D.KMnO4溶液③装置B中BaCl2溶液的作用是为了检验分解产物中是否有
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为b mol,C中沉淀物质的量为a mol,则b
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O的含量,某实验小组做了如下实验:
测定原理:MnO
 +Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
+Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)测定步骤:步骤一:准确称量20.00 g硫酸亚铁铵晶体,配制成100 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,用0.100 0 mol·L-1KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00 mL。
①如何判断滴定终点?
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为
更新时间:2016-12-09 17:06:29
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐1】硫酸亚铁铵【(NH4)2Fe(SO4)2·6H2O】,化学名称又名铁铵钒,也称摩尔盐,它是一种浅绿色的单斜晶体,它在空气中比一般的亚铁盐稳定,不易被氧化,易溶于水,工业上常用作废水处理的混凝剂,在定量分析中用作标定重铬酸钾、高锰酸钾等溶液。以硫铁矿(主要成分是FeS2,含少量Al2O3、SiO2和Fe3O4)为原料制备摩尔盐的流程如图:

反应的原理:FeSO4+(NH4)2SO4+6H2O=(NH4)2Fe(SO4)2·6H2O,根据原理回答下列问题
(1)为使硫铁矿充分焙烧,可采取的措施___________ (答出一点即可),滤渣1的主要成分是___________ ,
(2)焙烧过程中可将FeS2转化为Fe2O3,反应的方程式___________ 焙烧过程中产生SO2,用过量的氨水吸收SO2的离子方程式为___________ 。
(3) “除杂”加入的试剂为___________ (写出一个即可)“除杂”的原理:___________ (用离子方程式表示)
(4)已知三种盐的溶解度:
则从溶液中得到摩尔盐【(NH4)2Fe(SO4)2·6H2O】,要经过___________ 、___________ 、过滤、洗涤、干燥一系列步骤,其中用乙醇进行洗涤的优点___________ (至少答出两点)
(5)用(NH4)2Fe(SO4)2·6H2O配置溶液时,需要加入少量的___________ ,目的是___________
(6)已知Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=___________ 。

反应的原理:FeSO4+(NH4)2SO4+6H2O=(NH4)2Fe(SO4)2·6H2O,根据原理回答下列问题
(1)为使硫铁矿充分焙烧,可采取的措施
(2)焙烧过程中可将FeS2转化为Fe2O3,反应的方程式
(3) “除杂”加入的试剂为
(4)已知三种盐的溶解度:
| 温度 | FeSO4 | (NH4)2SO4 | (NH4)2Fe(SO4)2 6H2O 6H2O |
| 10 | 20.0 | 73.0 | 17.2 |
| 20 | 26.5 | 75.4 | 21.6 |
| 30 | 32.9 | 78.0 | 28.1 |
(5)用(NH4)2Fe(SO4)2·6H2O配置溶液时,需要加入少量的
(6)已知Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
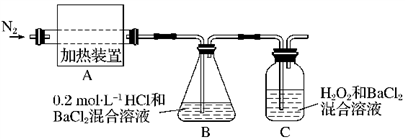
【推荐2】(NH4)2Fe(SO4)2·6H2O俗称“摩尔盐”,是一种 重要的化学试剂。当隔绝空气加热至500℃时,摩尔盐可完全分解,某小组欲探究其分解产物,设计实验如下,请回答:
(1)该小组认为分解产物可能有以下几种情况:
A. Fe2O3、SO3、NH3、H2O
B. FeO、SO3、NH3、H2O
C. FeO、SO2、NH3、H2O
D Fe2O3、SO2、NH3、H2O
E. Fe2O3、SO2、SO3、NH3、H2O
经认真分析,确定猜想_______ 不成立 (填序号)。
(2)为进一步确认分解产物,该小组设计了如下实验装置探究:
①加热前先通一段时间N2,加热至完全分解后再通入过量N2,两次通入氮气的目的是_______ 。
②实验过程中观察到装置D始终无明显现象,装置C和E均产生白色沉淀。写出E中发生反应的离子方程式_______ 。
③甲同学根据装置C产生白色沉淀的现象,判断产物中一定含有SO3,你认为甲同学的判断是否合理(填“合理”或“不合理”)_______ ,若不合理请说明理由:_______ 。
(3)实验结束后,A中的固体变为红棕色,请设计实验验证残留固体中只含有Fe2O3而不含FeO_______ 。
(1)该小组认为分解产物可能有以下几种情况:
A. Fe2O3、SO3、NH3、H2O
B. FeO、SO3、NH3、H2O
C. FeO、SO2、NH3、H2O
D Fe2O3、SO2、NH3、H2O
E. Fe2O3、SO2、SO3、NH3、H2O
经认真分析,确定猜想
(2)为进一步确认分解产物,该小组设计了如下实验装置探究:

①加热前先通一段时间N2,加热至完全分解后再通入过量N2,两次通入氮气的目的是
②实验过程中观察到装置D始终无明显现象,装置C和E均产生白色沉淀。写出E中发生反应的离子方程式
③甲同学根据装置C产生白色沉淀的现象,判断产物中一定含有SO3,你认为甲同学的判断是否合理(填“合理”或“不合理”)
(3)实验结束后,A中的固体变为红棕色,请设计实验验证残留固体中只含有Fe2O3而不含FeO
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】硫酸亚铁铵[(NH4]2Fe(SO4)2]是分析化学中的重要试剂。
[查阅资料]隔绝空气加热至500℃时硫酸亚铁铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。
[实验探究]某化学小组选用下图所示部分装置进行实验(夹持装置略)
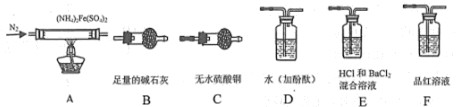
(1)验证分解产物中含有氨气和水蒸气,并探究残留固体成分。
①所选用装置的正确连接顺序为________ (填装置的字母序号)。
②证明有水蒸气生成的实验现象为___________ 。
③证明有氨气生成的实验现象为_______________ 。
④A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3,而不含FeO或Fe3O4:_________ 。
(2)探究分解产物中的硫氧化物,连接装置A-E-F-B进行实验。
①实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出的结论是_________ 。
②B的作用是_________ 。
③实验证明(NH4]2Fe(SO4)2受热分解除上述产物外,还有N2生成,写出A中反应的化学方程式__________________ 。
[查阅资料]隔绝空气加热至500℃时硫酸亚铁铁铵能完全分解,分解产物中含有铁氧化物、硫氧化物、氨气和水蒸气等。
[实验探究]某化学小组选用下图所示部分装置进行实验(夹持装置略)

(1)验证分解产物中含有氨气和水蒸气,并探究残留固体成分。
①所选用装置的正确连接顺序为
②证明有水蒸气生成的实验现象为
③证明有氨气生成的实验现象为
④A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3,而不含FeO或Fe3O4:
(2)探究分解产物中的硫氧化物,连接装置A-E-F-B进行实验。
①实验过程中观察到:E中没有明显现象,F中溶液褪色,据此得出的结论是
②B的作用是
③实验证明(NH4]2Fe(SO4)2受热分解除上述产物外,还有N2生成,写出A中反应的化学方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
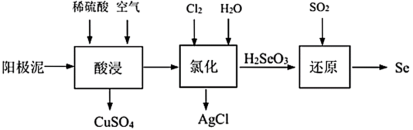
【推荐1】某粗铜精炼得到的阳极泥主要成分为Cu、Se、Ag2Se等,从中提取Se的工艺流程如下:
(1)“酸浸”过程中,加入稀硫酸并通入空气的目的是_______ 。
(2)“氯化”过程中发生如下转化:
①Se转化为H2SeO3,反应方程式为_______ 。
②Ag2Se转化为AgCl,结合化学用语从化学平衡的角度解释原因_______ 。
(3)“还原”过程中发生反应的化学方程式为_______ 。
(4)滴定法测定“酸浸”过程所得CuSO4溶液的浓度,其基本原理为:
第一步:
第二步: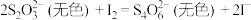
①由反应原理可知滴定所用的指示剂为_______ 。
②若CuSO4溶液体积为25mL,滴定至终点时消耗c mol/L Na2S2O3溶液V mL,则CuSO4溶液的物质的量浓度为_______ mo/L。
③若第一步使用的KI溶液过量,对滴定结果的影响是_______ (填“偏大”或“偏小”或“不影响”)。
| 化学式 | Ag2Se | AgCl |
| Ksp(常温) | 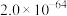 |  |
(2)“氯化”过程中发生如下转化:
①Se转化为H2SeO3,反应方程式为
②Ag2Se转化为AgCl,结合化学用语从化学平衡的角度解释原因
(3)“还原”过程中发生反应的化学方程式为
(4)滴定法测定“酸浸”过程所得CuSO4溶液的浓度,其基本原理为:
第一步:

第二步:
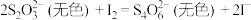
①由反应原理可知滴定所用的指示剂为
②若CuSO4溶液体积为25mL,滴定至终点时消耗c mol/L Na2S2O3溶液V mL,则CuSO4溶液的物质的量浓度为
③若第一步使用的KI溶液过量,对滴定结果的影响是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】碘化钠在医学上被广泛应用于X射线造影剂、甲状腺癌防治等方面。实验室可用铁屑还原法制碘化钠。回答下列问题:
(1)向反应容器中加入30mL40%的NaOH溶液、25.4gI2,搅拌并加热,发生反应:3I2+6NaOH 5NaI+NaIO3+3H2O。将温度控制在60-70℃的最佳加热方法是
5NaI+NaIO3+3H2O。将温度控制在60-70℃的最佳加热方法是___________ ,若温度过高产生的影响是______________________ 。
(2)已知:IO3-+5I-+6H+=3I2+3H2O;NaIO3水溶液呈中性。某同学设计如下方案,检验反应后溶液中存在IO3-,且c(OH-)>c(H+)限选试剂及用品:1 mol·L-1H2SO4、2 mol·L-1HNO3、淀粉KI试纸、红色石蕊试纸、蓝色石蕊试纸
(3)向反应后的溶液中加入铁粉,产生红褐色沉淀,则该反应的离子方程式为___________ 。充分反应后,从混合物中获得NaI固体,首先应进行___________ (填操作名称),若后续操作中直接蒸发结晶往往得不到较纯的NaI固体,可能的原因是___________ 。为将溶液中的NaIO3全部还原成NaI,投入铁屑的质量不少于___________ g(精确到小数点后两位)。
(1)向反应容器中加入30mL40%的NaOH溶液、25.4gI2,搅拌并加热,发生反应:3I2+6NaOH
 5NaI+NaIO3+3H2O。将温度控制在60-70℃的最佳加热方法是
5NaI+NaIO3+3H2O。将温度控制在60-70℃的最佳加热方法是(2)已知:IO3-+5I-+6H+=3I2+3H2O;NaIO3水溶液呈中性。某同学设计如下方案,检验反应后溶液中存在IO3-,且c(OH-)>c(H+)限选试剂及用品:1 mol·L-1H2SO4、2 mol·L-1HNO3、淀粉KI试纸、红色石蕊试纸、蓝色石蕊试纸
| 实验操作 | 实验现象 | 结论 |
| ①用玻璃棒蘸取溶液,点在 | 试纸呈蓝色 | c(OH-)>c(H+) |
| ②用玻璃棒蘸取溶液,点在 | 试纸不变色 | |
| ③向实验②的试纸上滴加 | 试纸呈蓝色 | 溶液中有IO3- |
(3)向反应后的溶液中加入铁粉,产生红褐色沉淀,则该反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】硫代硫酸钠( )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:
(1) 能解毒氰化物的原理为
能解毒氰化物的原理为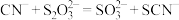 ,为检验该反应产生了
,为检验该反应产生了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入___________ (填化学式),观察到的现象是___________ 。
(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图1,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。
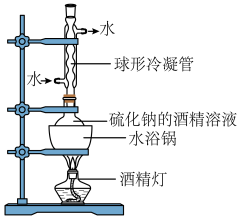
图1
将工业硫化钠溶于酒精并加热时,采取水浴加热优点是___________ 。
(3)利用图2装置制备 。
。
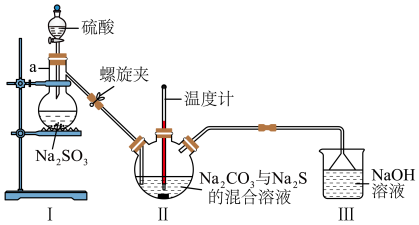
图2
①仪器a的名称为___________ 。
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以___________ 。
③装置Ⅱ处发生反应的总化学方程式为___________ ,停止通入 前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是
前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是___________ 。
④装置 Ⅲ 的作用是___________ 。
(4)实验结束后,经过一系列操作得到粗产品,测定粗产品中 (
( )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用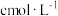 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为VmL。(已知
标准溶液的体积为VmL。(已知 )
)
①滴定达到终点时的现象是___________ 。
②产品中 的质量分数为
的质量分数为___________ %。
 )俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以
)俗称大苏打,广泛用于定影、媒染等领域,临床上用于氰化物解毒。实验室中以 和
和 为主要原料制备
为主要原料制备 。回答下列问题:
。回答下列问题:(1)
 能解毒氰化物的原理为
能解毒氰化物的原理为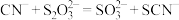 ,为检验该反应产生了
,为检验该反应产生了 ,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入
,最佳方法是取少量反应液,先向其中加入足量的盐酸,再加入(2)工业级硫化钠中混有杂质(重金属硫化物、煤粉等),需进行纯化。纯化实验装置如图1,保持水浴沸腾,回流一段时间后,过滤,将滤液冷却至室温后析出高纯硫化钠。

图1
将工业硫化钠溶于酒精并加热时,采取水浴加热优点是
(3)利用图2装置制备
 。
。
图2
①仪器a的名称为
②实验开始时,打开螺旋夹并适当调节螺旋夹,一方面可以防止倒吸,另一方面可以
③装置Ⅱ处发生反应的总化学方程式为
 前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是
前要控制Ⅱ装置中溶液pH约为7而不能小于7的理由是④装置 Ⅲ 的作用是
(4)实验结束后,经过一系列操作得到粗产品,测定粗产品中
 (
( )的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用
)的质量分数。精确称取0.5g硫代硫酸钠样品,用少量水溶解后滴入1~2滴淀粉溶液,再注入缓冲溶液。用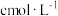 的
的 标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗
标准溶液滴定,待指示剂颜色变化稳定后停止滴定,测得消耗 标准溶液的体积为VmL。(已知
标准溶液的体积为VmL。(已知 )
)①滴定达到终点时的现象是
②产品中
 的质量分数为
的质量分数为
您最近一年使用:0次



