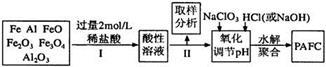
一种新型高效净水剂PAFC(聚合氯化铁铝[AlFe(OH)nC16-n]m),广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取PAFC,设计生产流程如下:
请回答下列问题:
(1)用l0 mol/L的浓盐酸配制2mol/L的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有_________ 。
A.容量瓶 B.烧杯 C.烧瓶 D.胶头滴管
(2)下列关于PAFC的说法中正确的有( )
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水电离出OH—,是碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
(3)步骤Ⅱ中取样分析的目的是( )
A.测定溶液中Fe2+与Fe3+的含量比
B.测定原料是否完全溶解
C.测定溶液中Fe2+的含量,以确定加入NaClO3的量
D.测定溶液中Al3+的含量
(4)写出向溶液中加入NaClO3时,发生反应的离子方程式为______________________ 。
(5)该化工厂的化验室为测定产品PAFC中A1和Fe的含量,进行下列试剂的选择和基本操作:测定时所需的试剂有_______________ 。
A.NH3·H2O B.NaOH C.CO2 D.NaClO3
(6)在测定过程中的操作顺序是: 过滤、___________ 、灼烧、_________ 、称量。(写操作名称)。
(7)测定时,直接称量的是____________ 和_____________ 的质量(填化学式)。

请回答下列问题:
(1)用l0 mol/L的浓盐酸配制2mol/L的稀盐酸,所用玻璃仪器除量筒和玻璃棒外,还有
A.容量瓶 B.烧杯 C.烧瓶 D.胶头滴管
(2)下列关于PAFC的说法中正确的有
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水电离出OH—,是碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
(3)步骤Ⅱ中取样分析的目的是
A.测定溶液中Fe2+与Fe3+的含量比
B.测定原料是否完全溶解
C.测定溶液中Fe2+的含量,以确定加入NaClO3的量
D.测定溶液中Al3+的含量
(4)写出向溶液中加入NaClO3时,发生反应的离子方程式为
(5)该化工厂的化验室为测定产品PAFC中A1和Fe的含量,进行下列试剂的选择和基本操作:测定时所需的试剂有
A.NH3·H2O B.NaOH C.CO2 D.NaClO3
(6)在测定过程中的操作顺序是: 过滤、
(7)测定时,直接称量的是
更新时间:2017/02/17 14:55:51
|
相似题推荐
解答题-工业流程题
|
困难
(0.15)
解题方法
【推荐1】碲(Te)广泛应用于冶金、航空航天、电子等领域。从精炼钢的阳极泥中(主要成分为Cu2Te,还含有金、银、铂等)回收碲的工艺流程如下:
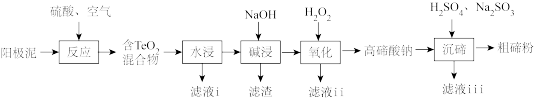
已知:TeO2有强还原性,且TeO2、Cu2TeO4难溶于水;高碲酸钠的化学式:Na2TeO4
回答下列问题:
(1)为提高“反应”效率,可采取的措施为_______ (任答一条)。
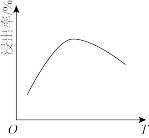
(2)滤液i的主要成分是_______ (写化学式)。滤液i中溶质的浸出率与温度关系如图所示,解释铜的浸出率随温度变化的可能原因_______ 。
(3)“氧化”过程中发生反应的离子方程式为_______ 。滤液ii可循环使用,应将其导入到_______ (写操作单元名称)操作中。
(4)“沉碲”过程中发生反应的离子方程式为_______ 。
(5)粗碲粉中碲质量分数的测定步骤如下:取mg粗碲粉,加入酸使其转化为亚碲酸(H2TeO3),配制成100mL溶液,取25.00mL于锥形瓶中。向锥形瓶中加入V1mLc1mol·L-1酸性K2Cr2O7溶液,充分反应使亚碲酸转化为碲酸(H6TeO6)。用c2mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定剩余的酸性K2Cr2O7溶液,消耗V2mL硫酸亚铁铵标准溶液。该粗碲粉中碲的质量分数为_______ 。

已知:TeO2有强还原性,且TeO2、Cu2TeO4难溶于水;高碲酸钠的化学式:Na2TeO4
回答下列问题:
(1)为提高“反应”效率,可采取的措施为
(2)滤液i的主要成分是

(3)“氧化”过程中发生反应的离子方程式为
(4)“沉碲”过程中发生反应的离子方程式为
(5)粗碲粉中碲质量分数的测定步骤如下:取mg粗碲粉,加入酸使其转化为亚碲酸(H2TeO3),配制成100mL溶液,取25.00mL于锥形瓶中。向锥形瓶中加入V1mLc1mol·L-1酸性K2Cr2O7溶液,充分反应使亚碲酸转化为碲酸(H6TeO6)。用c2mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定剩余的酸性K2Cr2O7溶液,消耗V2mL硫酸亚铁铵标准溶液。该粗碲粉中碲的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
名校
【推荐2】氧钒(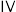 )碱式碳酸铵晶体{
)碱式碳酸铵晶体{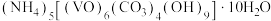 },紫红色,难溶于水和乙醇,是制备多种含钒产品和催化剂的基础原料和前驱体。实验室以
},紫红色,难溶于水和乙醇,是制备多种含钒产品和催化剂的基础原料和前驱体。实验室以 为原料制备该晶体,过程如下:
为原料制备该晶体,过程如下:
请回答:
(1)步骤ⅰ生成 的同时,还生成一种无毒无害的气体,请写出该反应的化学方程式:
的同时,还生成一种无毒无害的气体,请写出该反应的化学方程式: ___________ 。
(2)步骤ⅱ可在如图装置中进行。 溶液的仪器名称为
溶液的仪器名称为___________ 。上述装置依次连接的顺序为
___________ 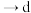 (按气流方向,用各接口小写字母表示)。
(按气流方向,用各接口小写字母表示)。
②实验时,先打开 ,一段时间后,当观察到
,一段时间后,当观察到___________ (填实验现象)时,再关闭 ,打开
,打开 ,进行实验。
,进行实验。
(3)下列说法不正确的是___________。
(4)粗产品中钒元素含量的测定:称取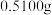 样品于锥形瓶中,用适量稀硫酸溶解后,加入稍过量的
样品于锥形瓶中,用适量稀硫酸溶解后,加入稍过量的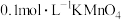 溶液,充分反应后继续加
溶液,充分反应后继续加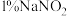 溶液至稍过量,再用尿素除去过量的
溶液至稍过量,再用尿素除去过量的 ,滴入几滴
,滴入几滴 溶液,用
溶液,用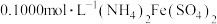 标准溶液滴定至终点,重复三次,消耗标准溶液的平均体积为
标准溶液滴定至终点,重复三次,消耗标准溶液的平均体积为 。
。
已知: 具有还原性,滴定原理为:
具有还原性,滴定原理为: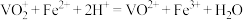 。
。
①滴定终点的现象为___________ 。
②粗产品中钒元素的质量分数为___________ 。
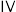 )碱式碳酸铵晶体{
)碱式碳酸铵晶体{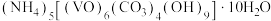 },紫红色,难溶于水和乙醇,是制备多种含钒产品和催化剂的基础原料和前驱体。实验室以
},紫红色,难溶于水和乙醇,是制备多种含钒产品和催化剂的基础原料和前驱体。实验室以 为原料制备该晶体,过程如下:
为原料制备该晶体,过程如下: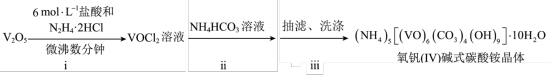
请回答:
(1)步骤ⅰ生成
 的同时,还生成一种无毒无害的气体,请写出该反应的化学方程式:
的同时,还生成一种无毒无害的气体,请写出该反应的化学方程式: (2)步骤ⅱ可在如图装置中进行。
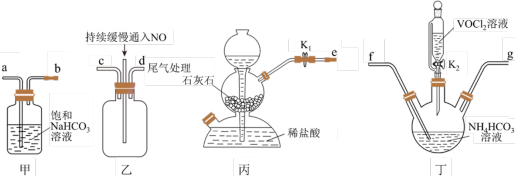
 溶液的仪器名称为
溶液的仪器名称为
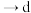 (按气流方向,用各接口小写字母表示)。
(按气流方向,用各接口小写字母表示)。②实验时,先打开
 ,一段时间后,当观察到
,一段时间后,当观察到 ,打开
,打开 ,进行实验。
,进行实验。(3)下列说法不正确的是___________。
A.已知还原性:浓盐酸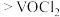 ,步骤ⅰ可用浓盐酸与 ,步骤ⅰ可用浓盐酸与 反应制备 反应制备 ,更经济环保 ,更经济环保 |
B.步骤ⅱ中,盛装 溶液和 溶液和 溶液的位置可以互换 溶液的位置可以互换 |
| C.步骤ⅲ中,可先用冷水洗涤晶体,再用无水乙醇洗涤 |
| D.步骤ⅲ中,为快速得到干燥的产品,可采用高温烘干的方式 |
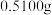 样品于锥形瓶中,用适量稀硫酸溶解后,加入稍过量的
样品于锥形瓶中,用适量稀硫酸溶解后,加入稍过量的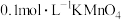 溶液,充分反应后继续加
溶液,充分反应后继续加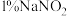 溶液至稍过量,再用尿素除去过量的
溶液至稍过量,再用尿素除去过量的 ,滴入几滴
,滴入几滴 溶液,用
溶液,用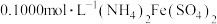 标准溶液滴定至终点,重复三次,消耗标准溶液的平均体积为
标准溶液滴定至终点,重复三次,消耗标准溶液的平均体积为 。
。已知:
 具有还原性,滴定原理为:
具有还原性,滴定原理为: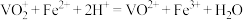 。
。①滴定终点的现象为
②粗产品中钒元素的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
名校
【推荐3】I、在防治新冠肺炎的工作中,过氧乙酸(CH3COOOH)是众多消毒剂中的一种。过氧乙酸可将各种病原微生物杀灭。某同学利用高浓度的双氧水和冰醋酸制备少量过氧乙酸并进行相关实验。
(1)过氧乙酸的制备。向100mL的三颈烧瓶中加入25mL冰醋酸(化学式:CH3COOH),滴加42.5%双氧水15mL,之后加入一定量浓硫酸作催化剂,维持反应温度为40℃,磁力搅拌4h后,室温静置12h。写出三颈烧瓶中制取过氧乙酸的化学反应方程式___________ 。
(2)过氧乙酸质量分数的测定。准确称取1.00g过氧乙酸样品液,定容于100mL容量瓶中,取其中10.00mL溶液调pH后,用KMnO4标准溶液滴定至溶液出现浅红色,以除去过氧乙酸试样中剩余的H2O2,再加入过量KI溶液,摇匀,用0.0200mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液25.00mL。(已知:CH3COOOH+2I-+2H+=I2+CH3COOH+H2O;2Na2S2O3+I2=Na2S4O6+2NaI)
①加入过量KI溶液前,需除去H2O2的原因是___________ (用离子方程式表示)。若H2O2不除,则测得过氧乙酸质量分数将___________ (填“偏大”、“偏小”、“无影响”)。
②滴定时所选指示剂为___________ 。
③制得过氧乙酸溶液中过氧乙酸质量分数为___________ %。
II、沉淀滴定与中和滴定相似。为了测定某三氯化氧磷(POCl3)产品中POCl3的含量:准确称取1.600g样品在水解瓶中摇动至完全水解(POCl3+3H2O=H3PO4+3HCl),将水解液(提示:H3PO4已除去)配成100mL溶液,取10.00mL于锥形瓶中,加入0.2000mo/L的AgNO3溶液20.00mL(Ag++C1-=AgC1↓),再加少许硝基苯,用力振荡,使AgC1沉淀被硝基苯覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000mo/LKSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN-=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
(3)①达到滴定终点的判断方法是___________ 。
②取10.00mL于锥形瓶中,需用___________ 仪器取。
③已知:Ksp(AgC1)=3.2×10-10mol2/L2,Ksp(AgSCN)=2×10-12mol2/L2,若无硝基苯覆盖沉淀表面,测定POCl3的质量分数将___________ (填“偏大”、“偏小”、“无影响”)。
(1)过氧乙酸的制备。向100mL的三颈烧瓶中加入25mL冰醋酸(化学式:CH3COOH),滴加42.5%双氧水15mL,之后加入一定量浓硫酸作催化剂,维持反应温度为40℃,磁力搅拌4h后,室温静置12h。写出三颈烧瓶中制取过氧乙酸的化学反应方程式
(2)过氧乙酸质量分数的测定。准确称取1.00g过氧乙酸样品液,定容于100mL容量瓶中,取其中10.00mL溶液调pH后,用KMnO4标准溶液滴定至溶液出现浅红色,以除去过氧乙酸试样中剩余的H2O2,再加入过量KI溶液,摇匀,用0.0200mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液25.00mL。(已知:CH3COOOH+2I-+2H+=I2+CH3COOH+H2O;2Na2S2O3+I2=Na2S4O6+2NaI)
①加入过量KI溶液前,需除去H2O2的原因是
②滴定时所选指示剂为
③制得过氧乙酸溶液中过氧乙酸质量分数为
II、沉淀滴定与中和滴定相似。为了测定某三氯化氧磷(POCl3)产品中POCl3的含量:准确称取1.600g样品在水解瓶中摇动至完全水解(POCl3+3H2O=H3PO4+3HCl),将水解液(提示:H3PO4已除去)配成100mL溶液,取10.00mL于锥形瓶中,加入0.2000mo/L的AgNO3溶液20.00mL(Ag++C1-=AgC1↓),再加少许硝基苯,用力振荡,使AgC1沉淀被硝基苯覆盖。加入NH4Fe(SO4)2作指示剂,用0.1000mo/LKSCN标准溶液滴定过量的AgNO3至终点(Ag++SCN-=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
(3)①达到滴定终点的判断方法是
②取10.00mL于锥形瓶中,需用
③已知:Ksp(AgC1)=3.2×10-10mol2/L2,Ksp(AgSCN)=2×10-12mol2/L2,若无硝基苯覆盖沉淀表面,测定POCl3的质量分数将
您最近一年使用:0次
解答题-无机推断题
|
困难
(0.15)
解题方法
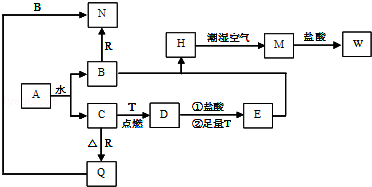
【推荐1】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
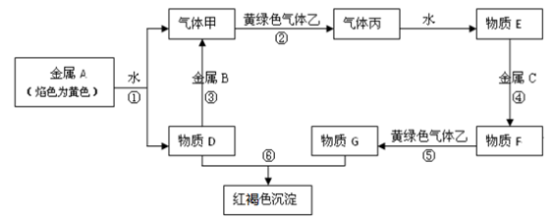
试请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A_____________ 、B____________ 、C____________ 、乙_________
(2)写出下列反应化学方程式:
反应①______________ 反应③___________
(3)写出下列反应离子方程式反应④____________

试请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A
(2)写出下列反应化学方程式:
反应①
(3)写出下列反应离子方程式反应④
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐1】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。以卤块为原料可制得轻质氧化镁,工艺流程如下图:
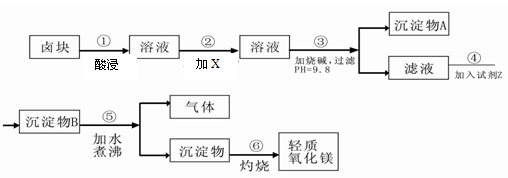
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
表2 化学试剂价格表
(1)在步骤②中加入的试剂X,最佳的选择是 ,原因是 。写出加入X发生反应的离子方程式 。选择 (试剂)来检验Fe2+是否完全氧化为Fe3+
(2)在步骤③中控制pH=9.8,其目的是 。
(3)试剂Z应该是 。
(4)在步骤⑤中发生反应的化学方程式是 。
(5)若在实验室中完成步骤⑥,则沉淀物必需在仪器A中灼烧。A应放置于仪器B上灼烧,灼烧完毕后应用仪器C取下仪器A置于仪器D上冷却。则B、C、D分别是 、 、 。

已知:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常将它氧化为Fe3+,生成Fe(OH)3沉淀除去。若要求产品尽量不含杂质,请根据表1表2提供的资料,填写空白:
表1 生成氢氧化物沉淀的pH
| 试剂 | 价格(元/吨) |
| 漂液(含NaClO,25.2%) | 450 |
| 双氧水(含H2O2 ,30%) | 2400 |
| 烧碱(含98% NaOH) | 2100 |
| 纯碱(含99.5% Na2CO3) | 600 |
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
| 试剂 | 价格(元/吨) |
| 漂液(含NaClO,25.2%) | 450 |
| 双氧水(含H2O2,30%) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
(2)在步骤③中控制pH=9.8,其目的是 。
(3)试剂Z应该是 。
(4)在步骤⑤中发生反应的化学方程式是 。
(5)若在实验室中完成步骤⑥,则沉淀物必需在仪器A中灼烧。A应放置于仪器B上灼烧,灼烧完毕后应用仪器C取下仪器A置于仪器D上冷却。则B、C、D分别是 、 、 。
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
名校
【推荐2】硫脲 在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备 ,然后
,然后 再与CaCN2合成
再与CaCN2合成 ,实验装置(夹持及加热装置略)如图所示。
,实验装置(夹持及加热装置略)如图所示。 易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。
易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。
回答下列问题:
(1)实验前先检查装置气密性,操作为:①在E中加水至浸没导管末端,……;②微热A处三颈烧瓶,观察到E处导管末端有气泡冒出,移走酒精灯;③一段时间后,E处导管末端形成一段水柱,且高度不变。将操作①补充完整_______ 。
(2)检查气密性后加入药品,装置A中的试剂最佳组合是_______ (填字母),打开K2。
A.FeS固体+浓硫酸 B.FeS固体+稀硝酸 C.FeS固体+稀盐酸
装置B中盛装的试剂为_______ 。待A中反应结束后关闭K2,打开K1通N2一段时间,目的是_______ 。
(3)撤走搅拌器,打开K3,水浴加热D处三颈烧瓶,在80℃时合成硫脲,同时生成一种常见的碱。控制温度在80℃的原因是_______ ,D处合成硫脲的化学方程式为_______ 。
(4)将装置D中液体过滤后,结晶得到粗产品。测定粗产品中硫脲纯度:称取mg产品,加水溶解配成500mL溶液,量取25mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用cmol⋅L-1KMnO4标准溶液滴定,滴定至终点时消耗KMnO4标准溶液VmL。
①硫脲 中硫元素的化合价为
中硫元素的化合价为_______ 价。
②滴定时,硫脲转化为CO2、N2、 的离子方程式为
的离子方程式为_______ 。
③样品中硫脲的质量分数为_______ (用含“m,c、V”的式子表示)。
 在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中先制备 ,然后
,然后 再与CaCN2合成
再与CaCN2合成 ,实验装置(夹持及加热装置略)如图所示。
,实验装置(夹持及加热装置略)如图所示。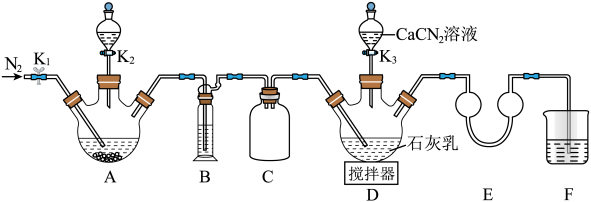
 易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。
易溶于水,易被氧化,受热时部分发生异构化生成NH4SCN。回答下列问题:
(1)实验前先检查装置气密性,操作为:①在E中加水至浸没导管末端,……;②微热A处三颈烧瓶,观察到E处导管末端有气泡冒出,移走酒精灯;③一段时间后,E处导管末端形成一段水柱,且高度不变。将操作①补充完整
(2)检查气密性后加入药品,装置A中的试剂最佳组合是
A.FeS固体+浓硫酸 B.FeS固体+稀硝酸 C.FeS固体+稀盐酸
装置B中盛装的试剂为
(3)撤走搅拌器,打开K3,水浴加热D处三颈烧瓶,在80℃时合成硫脲,同时生成一种常见的碱。控制温度在80℃的原因是
(4)将装置D中液体过滤后,结晶得到粗产品。测定粗产品中硫脲纯度:称取mg产品,加水溶解配成500mL溶液,量取25mL于锥形瓶中,滴加一定量的稀硫酸使溶液显酸性,用cmol⋅L-1KMnO4标准溶液滴定,滴定至终点时消耗KMnO4标准溶液VmL。
①硫脲
 中硫元素的化合价为
中硫元素的化合价为②滴定时,硫脲转化为CO2、N2、
 的离子方程式为
的离子方程式为③样品中硫脲的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
真题
解题方法
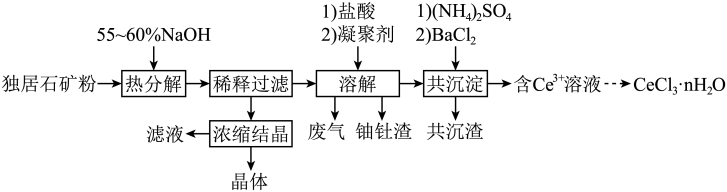
【推荐3】稀土是国家的战略资源之一。以下是一种以独居石【主要成分为CePO4.含有Th3(PO4)4、U3O8和少量镭杂质】为原料制备CeCl3•nH2O的工艺流程图。
ⅱ.镭为第ⅡA族元素
回答下列问题:
(1)关于独居石的热分解,以下说法正确的是_______ (填标号)。
a.降低压强,分解速率增大 b.降低温度,分解速率降低
c.反应时间越长,分解速率越大 d.提高搅拌速度,分解速率降低
(2)Na2U2O7中铀元素的化合价为_______ ,热分解阶段U3O8生成Na2U2O7的化学反应方程式为 _______ 。
(3)浓缩结晶后,得到的晶体产物化学式为_______ ,滤液可用于 _______ 阶段循环利用,避免产生大量的高碱度废水。
(4)溶解阶段,将溶液pH先调到1.5~2.0,反应后再回调至4.5。
①盐酸溶解Ce(OH)4的离子方程式为_______ 。
②当溶液pH=4.5时,c(Th4+)=_______ mol/L,此时完全转化为氢氧化钍沉淀。
(5)以BaSO4为载体形成共沉淀,目的是去除杂质_______ 。
ⅱ.镭为第ⅡA族元素
回答下列问题:
(1)关于独居石的热分解,以下说法正确的是
a.降低压强,分解速率增大 b.降低温度,分解速率降低
c.反应时间越长,分解速率越大 d.提高搅拌速度,分解速率降低
(2)Na2U2O7中铀元素的化合价为
(3)浓缩结晶后,得到的晶体产物化学式为
(4)溶解阶段,将溶液pH先调到1.5~2.0,反应后再回调至4.5。
①盐酸溶解Ce(OH)4的离子方程式为
②当溶液pH=4.5时,c(Th4+)=
(5)以BaSO4为载体形成共沉淀,目的是去除杂质
您最近一年使用:0次