CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为____________ ,S、O、N三种元素的第一电离能由大到小为____________ 。
(2)SO 的立体构型是
的立体构型是________ ,与SO 互为等电子体的一种分子为
互为等电子体的一种分子为____________ (填化学式)。
(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO 中心原子的杂化轨道类型为
中心原子的杂化轨道类型为________ ,[Cu(NH3)4](NO3)2中存在的化学键类型除了极性共价键外,还有____________ 。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是____________ 。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
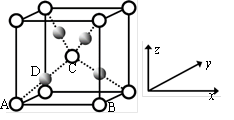
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为( ,
, ,
, )。则D原子的坐标参数为
)。则D原子的坐标参数为________ ,它代表________ 原子。
②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏伽德罗常数值NA=________ 。
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为
(2)SO
 的立体构型是
的立体构型是 互为等电子体的一种分子为
互为等电子体的一种分子为(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO
 中心原子的杂化轨道类型为
中心原子的杂化轨道类型为(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。

①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(
 ,
, ,
, )。则D原子的坐标参数为
)。则D原子的坐标参数为②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏伽德罗常数值NA=
更新时间:2017-02-17 14:57:44
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物。
①CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4]。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为_______ ,与CO互为等电子体的离子为_______ (填化学式)。
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测Ni(CO)4易溶于下列_______ 。
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓的基态原子的电子排布式是_______ ,Ga的第一电离能却明显低于Zn,原因是_______ 。
(3)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是_______ 。
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形
(4)Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
①Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于_______ (填晶体类型)。
②CuSO4·5H2O(胆矾)中含有水合铜离子因而呈蓝色,写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)_______ 。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物。
①CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4]。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测Ni(CO)4易溶于下列
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓的基态原子的电子排布式是
(3)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是
a.直线形;三角锥形 b.V形;三角锥形
c.直线形;平面三角形 d.V形;平面三角形
(4)Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
①Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于
②CuSO4·5H2O(胆矾)中含有水合铜离子因而呈蓝色,写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】北京时间2017年10月4日,地球发生一次小行星撞击事件,撞击地点为我国云南香格里拉县城西北40公里处,爆炸当量相当于540t TNT。很可能有未燃尽的陨石落到地面。全世界已收集到4万多块陨石样品,它们大致可分为三大类:石陨石(主要成分是硅酸盐)、铁陨石(铁镍合金)、和石铁陨石(铁和硅酸盐混合物)。

回答下列问题:
(1)基态铁原子简化的电子排布式为[Ar]_______ 。
(2)TNT的结构简式如图所示。

①TNT分子中碳原子杂化类型是____ 。
②TNT的熔点比硝基苯的熔点__ (填“高”或“低”),理由是___ 。
(3)石陨石中硅酸盐之一是Ca2SiO4。
SiO44-的立体构型是_____ 。电负性:Si___ (填“>”“<”或“=”)O。
(4)K3[Fe(CN)6](铁氰化钾)溶液可以检验铁陨石中铁元素价态。
①铁氰化钾中不存在的作用力有__ (填字母)。
a.离子键 b.极性键 c.非极性键 d.π键 e.配位键 f.氢键
②1mol [Fe(CN)6]3含σ键数目为_____ 。
③CN-能与多种离子形成配合物,碳原子提供孤电子对,而不是氮原子,其原因是___ 。
(5)铁、氮组成磁材料M,其晶胞如图所示。该晶体中氮、铁原子个数之比为____ 。

(6)镍晶体的堆积方式为面心立方最密堆积。已知镍晶体密度为ρ g·cm-3,NA代表阿伏加 德罗常数的值。用含ρ和NA的代数式表示在镍晶胞中最近的两个镍原子之间的核间距D=__ nm。

回答下列问题:
(1)基态铁原子简化的电子排布式为[Ar]
(2)TNT的结构简式如图所示。

①TNT分子中碳原子杂化类型是
②TNT的熔点比硝基苯的熔点
(3)石陨石中硅酸盐之一是Ca2SiO4。
SiO44-的立体构型是
(4)K3[Fe(CN)6](铁氰化钾)溶液可以检验铁陨石中铁元素价态。
①铁氰化钾中不存在的作用力有
a.离子键 b.极性键 c.非极性键 d.π键 e.配位键 f.氢键
②1mol [Fe(CN)6]3含σ键数目为
③CN-能与多种离子形成配合物,碳原子提供孤电子对,而不是氮原子,其原因是
(5)铁、氮组成磁材料M,其晶胞如图所示。该晶体中氮、铁原子个数之比为

(6)镍晶体的堆积方式为面心立方最密堆积。已知镍晶体密度为ρ g·cm-3,NA代表阿伏加 德罗常数的值。用含ρ和NA的代数式表示在镍晶胞中最近的两个镍原子之间的核间距D=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】Al、Ti、Co、Cr、Zn 等元素形成的化合物在现代工业中有广泛的用途。回答下列问题:
(1)下列状态的铝中,电离最外层的一个电子所需能量最小的是_____ (填标号)。
A.[Ne]3s1 B.[Ne]3s2 C.[Ne]3s23p1 D.[Ne] 3s13p2
(2)熔融 AlCl3时可生成具有挥发性的二聚体 Al2Cl6,二聚体 Al2Cl6的结构式为_____ ;(标出配位键)其中 Al 的配位数为_________ 。
(3)与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有_____ 种。
(4)Co2+的价电子排布式_________ 。NH3分子与 Co2+结合成配合物[Co(NH3)6]2+,与游离的氨分子相比,其键角∠HNH_____ (填“较大”,“较小”或“相同”),解释原因_____ 。
(5)已知 CrO5中铬元素为最高价态,画出其结构式:_____ 。
(6)阿伏加 德罗常数的测定有多种方法,X 射线衍射法就是其中的一种。通过对碲化锌晶体的 X 射线衍射图 象分析,可以得出其晶胞如图 1 所示,图 2 是该晶胞沿 z 轴的投影图,请在图中圆球上涂“●”标明 Zn 的位置_____ 。若晶体中 Te 呈立方面心最密堆积方式排列,Te 的半径为 a pm,晶体的密度为 ρg/cm3,阿伏加 德罗常数 NA=_____ mol-1(列计算式表达)。

(1)下列状态的铝中,电离最外层的一个电子所需能量最小的是
A.[Ne]3s1 B.[Ne]3s2 C.[Ne]3s23p1 D.[Ne] 3s13p2
(2)熔融 AlCl3时可生成具有挥发性的二聚体 Al2Cl6,二聚体 Al2Cl6的结构式为
(3)与钛同周期的所有副族元素的基态原子中,最外层电子数与基态钛原子相同的元素有
(4)Co2+的价电子排布式
(5)已知 CrO5中铬元素为最高价态,画出其结构式:
(6)阿伏加 德罗常数的测定有多种方法,X 射线衍射法就是其中的一种。通过对碲化锌晶体的 X 射线衍射图 象分析,可以得出其晶胞如图 1 所示,图 2 是该晶胞沿 z 轴的投影图,请在图中圆球上涂“●”标明 Zn 的位置

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子; 原子核外有3层电子且各层均处于全满状态。
原子核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的价电子排布式为__ 。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为__ (填元素符号),电负性数值由大到小的顺序为__ (填元素符号)。
(3)B元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为__ ,C元素的气态氢化物的VSEPR模型为__ 。B2A4是重要的基本石油化工原料,1molB2A4分子中含__ molσ键。写出与BD2为等电子体关系的分子、阳离子、阴离子各一个__ 、__ 、__ 。
(4)E单质晶胞的形成方式为图1中的哪一种:__ (填ABA或ABC),其空间利用率为__ 。

(5)E的硫酸盐结构如图2,此化合物是__ (写名称),在图中画出以E为中心原子的配位键___ 。

 原子核外有3层电子且各层均处于全满状态。
原子核外有3层电子且各层均处于全满状态。(1)E元素基态原子的价电子排布式为
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
(3)B元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为
(4)E单质晶胞的形成方式为图1中的哪一种:

(5)E的硫酸盐结构如图2,此化合物是

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】氟及其化合物用途十分广泛,回答下列问题:
(1)氟化物OF2、NF3、SiF4、PF5、SF6中,中心原子采取sp3杂化的是__ 。
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸。锑的价电子排布式为__ 。阳离子[H2F]+的空间构型为__ ,写出[H2F]+的等电子体__ (分子和离子各举一例)。
(3)SF6被广泛用于高压电器设备的绝缘介质。根据__ 理论,可判断出其空间构型为正八面体。SF6的键能可通过类似Born-Haber循环能量构建能量图(图甲)计算键能,则S-F的键能为___ kJ•mol-1。

(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3[AlF6]降低Al2O3的熔点。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Na3[AlF6]+3CO2↑+9H2O。
①测定气态HF的摩尔质量时,往往得不到20g•mol-1的数据,原因是__ 。
②冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在__ (填序号)。
a.离子键 b.极性键 c.配位键 d.范德华力
③反应物中元素(氢除外)的第一电离能从大到小的顺序为__ (用元素符号表示)。
④工业上不用电解熔点更低的AlCl3制取铝的原因为__ 。
⑤冰晶石由两种微粒构成,冰晶石的晶胞结构如图乙所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是__ (填具体的微粒符号)。

(1)氟化物OF2、NF3、SiF4、PF5、SF6中,中心原子采取sp3杂化的是
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸。锑的价电子排布式为
(3)SF6被广泛用于高压电器设备的绝缘介质。根据

(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3[AlF6]降低Al2O3的熔点。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Na3[AlF6]+3CO2↑+9H2O。
①测定气态HF的摩尔质量时,往往得不到20g•mol-1的数据,原因是
②冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在
a.离子键 b.极性键 c.配位键 d.范德华力
③反应物中元素(氢除外)的第一电离能从大到小的顺序为
④工业上不用电解熔点更低的AlCl3制取铝的原因为
⑤冰晶石由两种微粒构成,冰晶石的晶胞结构如图乙所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是

您最近一年使用:0次
【推荐3】金属氮化物具有高熔点、高硬度、高化学稳定性以及良好的导热、导电性,目前已经广泛应用于磁学、电子工业 、耐高温结构陶瓷等领域 。回答下列问题
(1)下列不同状态的氮原子其能量最高的是________ (填字母),基态氮原子处于最高能级的电子其电子云轮廓图形状为________
(2)第一电离能I1(N)______ (填“> ”“< ”或“=”)I1(P),其原因是_____________ 。
(3)A和B两种金属的含氮化合物的结构如图所示:
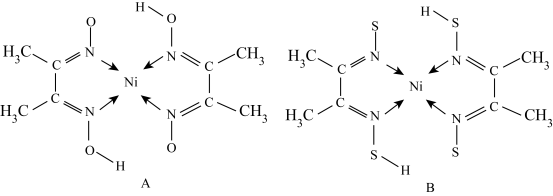
①基态 Ni 原子的核外电子排布式为[ Ar]________________ 。
②物质A 中碳原子的杂化方式为__________________ 。
③A的熔点高于 B 的,具主要原因是_______ 。
④B中含有的化学键类型有_____________ (填字母)。
a.金属键 b. σ建
c.π键 d. 配位键
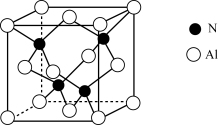
(4)氮化铝晶胞如图所示。氮原子的配位数为_______ ,每个铝原子周围紧邻__________ 个铝原子;已知立方氮化铝晶体密度为ρg• cm-3,晶胞中最近的两个铝原子之间的距离为___ pm(列出计算式即可,阿伏加 德罗常数为6. 02×1023mol -1)。
(1)下列不同状态的氮原子其能量最高的是

(2)第一电离能I1(N)
(3)A和B两种金属的含氮化合物的结构如图所示:

①基态 Ni 原子的核外电子排布式为[ Ar]
②物质A 中碳原子的杂化方式为
③A的熔点高于 B 的,具主要原因是
④B中含有的化学键类型有
a.金属键 b. σ建
c.π键 d. 配位键
(4)氮化铝晶胞如图所示。氮原子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】金属元素Fe、Ni、Pt均为周期表中同族元素,该族元素的化合物在研究和生产中有许多重要用途。
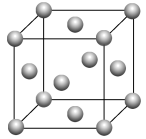
图5
(1)Fe是常见的金属,生活中用途广泛。请回答下列问题:
①Fe在元素周期表中的位置为_____________ 。
②Fe的一种晶胞结构如图5所示,测得晶胞边长为 a pm,
则Fe原子半径为_______ 。
③已知FeO晶体晶胞结构为NaCl型,与O2-距离最近且等距离的亚铁离子围成的空间构型为___________ 。
(2)铂可与不同的配体形成多种配合物,分子式为[Pt(NH3)2Cl4]的配合物的配体
是_________ ;该配合物有两种不同的颜色,其中橙黄色比较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,图6所示的结构示意图中呈亮黄色的是______ (填“A”或“B”),理由是_________________________ 。
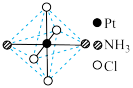
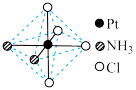
A B
图6
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图7。
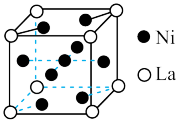
图7
①储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心则形成的储氢化合物的化学式为______________ 。
②测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为______ 。(不必计算出结果)

图5
(1)Fe是常见的金属,生活中用途广泛。请回答下列问题:
①Fe在元素周期表中的位置为
②Fe的一种晶胞结构如图5所示,测得晶胞边长为 a pm,
则Fe原子半径为
③已知FeO晶体晶胞结构为NaCl型,与O2-距离最近且等距离的亚铁离子围成的空间构型为
(2)铂可与不同的配体形成多种配合物,分子式为[Pt(NH3)2Cl4]的配合物的配体
是


A B
图6
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图7。

图7
①储氢原理为:镧镍合金吸附H2,H2解离为原子,H储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心则形成的储氢化合物的化学式为
②测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】第四周期包含18种元素,其中多种元素具有重要的用途,在现代工业中备受青睐。
(l)铁位于元素周期表____ 区,Fe3+的价电子排布式为 ____ 。
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,可用en代表,其能够与Cu2+形成稳定环状配离子,可表示为[Cu(en)2]2+,其中Cu2+的配位数为____ 。1 mol[Cu(en)2]C12中含有σ键的数目为____ 。
(3)气态SeO3为单分子,该分子中Se原子的杂化轨道类型为___ 。用物质结构理论解释H2SeO4比H2SeO3酸性强的原因:______________ 。
(4)如图为Cu2O的晶胞结构,其中黑球表示____ 原子(填元素符号);Cu2O的密度为pg·cm-3则晶胞的边长为 ___ cm。(用NA表示阿伏加 德罗常数的值)
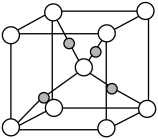
(l)铁位于元素周期表
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,可用en代表,其能够与Cu2+形成稳定环状配离子,可表示为[Cu(en)2]2+,其中Cu2+的配位数为
(3)气态SeO3为单分子,该分子中Se原子的杂化轨道类型为
(4)如图为Cu2O的晶胞结构,其中黑球表示

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】云南是南方丝绸之路的重要节点,有着丰富的铜镍矿石资源。回答下列相关问题:
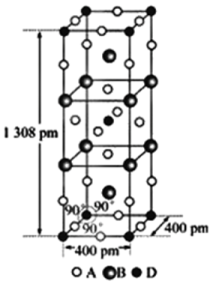
(1)镍在元素周期表中的位置是____ ,其基态原子的电子排布式为_____ ,该原子核外有___ 个未成对电子。
(2)Ni(NH3)4SO4中N的杂化轨道类型是_____ ;1 mol Ni(NH3)42+中含有的 键数目为
键数目为____ 个;SO42-的立体构型是______ 。

(3)氨是_____ 分子(填“极性”或“非极性”),经测定NH4F为分子晶体,类比NH3·H2O表示出NH4F分子中的氢键_____ 。
(4)铜镍合金的立方晶胞结构如图所示,其中原子A的坐标参数为(0,1,0);
①原子B的坐标参数为____ ;
②若该晶体密度为dg/cm3,则铜镍原子间最短距离为____ pm
(1)镍在元素周期表中的位置是
(2)Ni(NH3)4SO4中N的杂化轨道类型是
 键数目为
键数目为
(3)氨是
(4)铜镍合金的立方晶胞结构如图所示,其中原子A的坐标参数为(0,1,0);
①原子B的坐标参数为
②若该晶体密度为dg/cm3,则铜镍原子间最短距离为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,其中C的常见化合价为+3,+2价。回答下列问题:
(1)C3+的电子排布式为___________ ,其单质的晶体中,原子间以___________ (填化学键类型)相互结合
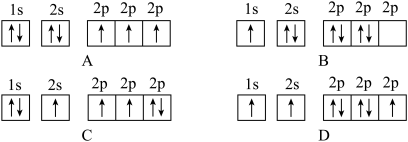
(2)四种元素中第一电离能最小的是____ (填元素名称),电负性最大的元素的核外电子排布图为:____
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。该化合物的化学式为___ ;D的配位数为___ ;
(1)C3+的电子排布式为
(2)四种元素中第一电离能最小的是
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。该化合物的化学式为

您最近一年使用:0次
【推荐2】云南丰富的地热能开发和利用过程中,硫磺温泉常伴有H2S气体生成。H2S为无色、有臭鸡蛋气味的剧毒气体,H2S脱硫技术是当前的重点研究方向。
(1)20世纪30年代,德国法本公司将H2S的氧化分两阶段完成。
第一阶段反应为H2S(g)+ O2(g)=SO2(g)+H2O(g) △H=-518.9kJ•mol-1,
O2(g)=SO2(g)+H2O(g) △H=-518.9kJ•mol-1,
第二阶段反应为2H2S(g)+SO2(g)=2H2O(g)+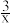 Sx(s) △H=-96.1kJ•mol-1。
Sx(s) △H=-96.1kJ•mol-1。
19世纪英国化学家Claus开发了H2S氧化制硫的方法,即:3H2S(g)+ O2(g)=
O2(g)=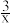 Sx(s)+3H2O(g),△H=-
Sx(s)+3H2O(g),△H=-______ kJ•mol-1。
(2)氧化锌法也是一种传统的脱硫方法,其反应原理如下:ZnO(s)+H2S(g) ZnS(s)+H2O(g) △H=-76.63kJ•mol-1,文献显示,工业上氧化锌法控制温度在300~400℃,分析控制此温度区间的原因:温度过低
ZnS(s)+H2O(g) △H=-76.63kJ•mol-1,文献显示,工业上氧化锌法控制温度在300~400℃,分析控制此温度区间的原因:温度过低_______ ,温度过高_______ 。
(3)热解H2S制H2。根据文献,将H2S和CH4的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
Ⅰ.2H2S(g) 2H2(g)+S2(g) △H1=+170kJ•mol-1
2H2(g)+S2(g) △H1=+170kJ•mol-1
Ⅱ.CH4(g)+S2(g) CS2(g)+2H2(g) △H2=+64kJ•mol-1
CS2(g)+2H2(g) △H2=+64kJ•mol-1
总反应:Ⅲ.2H2S(g)+CH4(g) CS2(g)+4H2(g)
CS2(g)+4H2(g)
投料按体积之比V(H2S)∶V(CH4)=2∶1,并用N2稀释,常压,不同温度下反应相同时间后,测得H2和CS2体积分数如表:
①反应Ⅱ能自发进行的条件是_______ 。
②恒温恒压下,增加N2的体积分数,H2的物质的量______ 。在1000℃,常压下,保持通入的H2S体积分数不变,提高投料比[c(H2S)∶c(CH4)],H2S的转化率_______ (填“增大,减小或不变”)。
③在TK、pkPa反应条件下,只充入H2S和Ar气体进行H2S热分解反应。已知反应一开始,c(H2S)∶c(Ar)=1∶3,平衡时混合气中H2S与H2的分压相等,则平衡常数Kp=_______ kPa。
(4)ZnO晶胞结构如图所示。已知:ZnO晶体的密度为ρg•cm-3,NA代表阿伏加德罗常数的值。氧离子的配位数为______ 。晶胞边长a为______ nm。

(1)20世纪30年代,德国法本公司将H2S的氧化分两阶段完成。
第一阶段反应为H2S(g)+
 O2(g)=SO2(g)+H2O(g) △H=-518.9kJ•mol-1,
O2(g)=SO2(g)+H2O(g) △H=-518.9kJ•mol-1,第二阶段反应为2H2S(g)+SO2(g)=2H2O(g)+
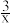 Sx(s) △H=-96.1kJ•mol-1。
Sx(s) △H=-96.1kJ•mol-1。19世纪英国化学家Claus开发了H2S氧化制硫的方法,即:3H2S(g)+
 O2(g)=
O2(g)=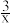 Sx(s)+3H2O(g),△H=-
Sx(s)+3H2O(g),△H=-(2)氧化锌法也是一种传统的脱硫方法,其反应原理如下:ZnO(s)+H2S(g)
 ZnS(s)+H2O(g) △H=-76.63kJ•mol-1,文献显示,工业上氧化锌法控制温度在300~400℃,分析控制此温度区间的原因:温度过低
ZnS(s)+H2O(g) △H=-76.63kJ•mol-1,文献显示,工业上氧化锌法控制温度在300~400℃,分析控制此温度区间的原因:温度过低(3)热解H2S制H2。根据文献,将H2S和CH4的混合气体导入石英管反应器热解(一边进料,另一边出料),发生如下反应:
Ⅰ.2H2S(g)
 2H2(g)+S2(g) △H1=+170kJ•mol-1
2H2(g)+S2(g) △H1=+170kJ•mol-1Ⅱ.CH4(g)+S2(g)
 CS2(g)+2H2(g) △H2=+64kJ•mol-1
CS2(g)+2H2(g) △H2=+64kJ•mol-1总反应:Ⅲ.2H2S(g)+CH4(g)
 CS2(g)+4H2(g)
CS2(g)+4H2(g)投料按体积之比V(H2S)∶V(CH4)=2∶1,并用N2稀释,常压,不同温度下反应相同时间后,测得H2和CS2体积分数如表:
| 温度/℃ | 950 | 1000 | 1050 | 1100 | 1150 |
| H2/V(%) | 0.5 | 1.5 | 3.6 | 5.5 | 8.5 |
| CS2/V(%) | 0.0 | 0.0 | 0.1 | 0.4 | 1.8 |
②恒温恒压下,增加N2的体积分数,H2的物质的量
③在TK、pkPa反应条件下,只充入H2S和Ar气体进行H2S热分解反应。已知反应一开始,c(H2S)∶c(Ar)=1∶3,平衡时混合气中H2S与H2的分压相等,则平衡常数Kp=
(4)ZnO晶胞结构如图所示。已知:ZnO晶体的密度为ρg•cm-3,NA代表阿伏加德罗常数的值。氧离子的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】东晋《华阳国志•南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为___________ ,3d 能级上的未成对电子数为__________ 。
(2) 硫酸镍溶于氨水形成 [ Ni(NH3 )6] SO4蓝色溶液 。
①[Ni(NH3)6]SO4中 的空间立体构型是
的空间立体构型是 _________ 。
②在[Ni(NH3)6]2+中Ni2+与 NH3之间形成的化学键称为__________ 。
③氨的沸点________ (填“高于”或“低于”)膦(PH3),原因是 _______ 。氨分子中,中心原子的轨道杂化类型为 ___________ 。
(3)单质铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:ICu=1958kJ•mol-1、INi= 1753 kJ•mol-l,ICu > INi的原因是_______ 。
(4)某镍白铜合金的立方晶胞结构如图所示。

若合金的密度为dg•cm-3,晶胞参数 a =________ nm 。
(1)镍元素基态原子的电子排布式为
(2) 硫酸镍溶于氨水形成 [ Ni(NH3 )6] SO4蓝色溶液 。
①[Ni(NH3)6]SO4中
 的空间立体构型是
的空间立体构型是 ②在[Ni(NH3)6]2+中Ni2+与 NH3之间形成的化学键称为
③氨的沸点
(3)单质铜及镍都是由金属键形成的晶体,元素铜与镍的第二电离能分别为:ICu=1958kJ•mol-1、INi= 1753 kJ•mol-l,ICu > INi的原因是
(4)某镍白铜合金的立方晶胞结构如图所示。

若合金的密度为dg•cm-3,晶胞参数 a =
您最近一年使用:0次



