X、Y、Z、W、M、N是元素周期表中前四周期原子序数依次增大的六种元素,其相关信息如下表:
(1)红色金属N位于元素周期表中的位置为______________ ,其基态原子的电子排布式为_______________
(2)H2Y分子的立体构型为_____ 形,XY2分子中X原子的杂化轨道的类型是______ ,与XY分子互为等电子体的微粒有__________________ (写一种即可,填化学式)
(3)Y单质和Z单质点燃条件下得到的固体产物为________ (填化学式),其晶体类型为___________ 晶体
(4)与Z同周期且相邻的两种元素的原子与Z比较,三者第一电离能最大的为______ ,X、Y两种元素电负性的大小关系为_____ >_____ (均用元素符号表示)。
(5)写出N的单质在潮湿的空气中生成绿色锈斑的化学方程式__________
(6)W与Y元素同主族且相邻,W的单质在空气中燃烧生成一种无色有刺激性气味的气体。该气体与含1.5 mol M的一种含氧酸(该酸的钾盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是:______________________ 。
元素 | 相关信息 |
X | X的基态原子核外只有三个能级,且各能级电子数相等 |
Y | Ne与Y2-的核外电子数相同 |
Z | Z的基态原子价电子排布为nsn-1 |
N | N的单质是一种常见的红色金属,在潮湿的空气中易生成绿色的锈斑 |
(1)红色金属N位于元素周期表中的位置为
(2)H2Y分子的立体构型为
(3)Y单质和Z单质点燃条件下得到的固体产物为
(4)与Z同周期且相邻的两种元素的原子与Z比较,三者第一电离能最大的为
(5)写出N的单质在潮湿的空气中生成绿色锈斑的化学方程式
(6)W与Y元素同主族且相邻,W的单质在空气中燃烧生成一种无色有刺激性气味的气体。该气体与含1.5 mol M的一种含氧酸(该酸的钾盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是:
更新时间:2017-04-08 14:19:24
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】N、P、As都是ⅤA族元素,且原子序数依次增大,它们的单质和化合物在生产、生活中有广泛应用。请回答下列相关问题。
(1)基态磷原子的价电子排布式为_______________ 。
(2)已知白磷的分子式为P4,其结构如图1所示。科学家目前合成了N4分子,其分子结构与白磷类似。则N原子的杂化轨道类型是_______ ,N—N—N键的键角为_______ 。

(3)硝酸的沸点较低,从氢键的角度推断其可能的原因是_________________ ;请写出两种与 互为等电子体的微粒化学式
互为等电子体的微粒化学式_____________ (请写一个分子和一个离子)。
(4) 与钴形成的配离子[Co(NO2)6]3−可用于检验K+的存在。
与钴形成的配离子[Co(NO2)6]3−可用于检验K+的存在。 离子的VSEPR模型名称为
离子的VSEPR模型名称为___________ ,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_________________ 。
(5)铝和白磷在一定条件下可以制备磷化铝(AlP),磷化铝晶胞的结构如图2所示。磷化铝中,Al原子的配位数为___________ ,若最近两个Al原子之间的距离为a cm,用NA表示阿伏加德罗常数的值,则该晶体的密度为_________ g·cm−3(用含有以上字母的计算式表示)。
(1)基态磷原子的价电子排布式为
(2)已知白磷的分子式为P4,其结构如图1所示。科学家目前合成了N4分子,其分子结构与白磷类似。则N原子的杂化轨道类型是

(3)硝酸的沸点较低,从氢键的角度推断其可能的原因是
 互为等电子体的微粒化学式
互为等电子体的微粒化学式(4)
 与钴形成的配离子[Co(NO2)6]3−可用于检验K+的存在。
与钴形成的配离子[Co(NO2)6]3−可用于检验K+的存在。 离子的VSEPR模型名称为
离子的VSEPR模型名称为(5)铝和白磷在一定条件下可以制备磷化铝(AlP),磷化铝晶胞的结构如图2所示。磷化铝中,Al原子的配位数为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】Ⅰ.碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
回答下列问题:
(1)通常条件下,比较 和
和 的稳定性:
的稳定性:
_______  (填大于、小于或等于)
(填大于、小于或等于)
(2)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是_______ 。
Ⅱ.铍及其化合物的应用正日益被重视。
(3)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为_______ 。
(4)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_______(填字母)。
(5)BeO立方晶胞如图所示。
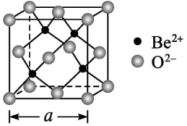
若BeO晶体的密度为d g·cm ,设晶胞参数为anm,设
,设晶胞参数为anm,设 为阿伏加德罗常数的值,则a=
为阿伏加德罗常数的值,则a=_______ nm(列出表达式即可)。
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
键能/kJ·mol | 356 | 413 | 336 | 226 | 318 | 452 |
(1)通常条件下,比较
 和
和 的稳定性:
的稳定性:
 (填大于、小于或等于)
(填大于、小于或等于)(2)硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是
Ⅱ.铍及其化合物的应用正日益被重视。
(3)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为
(4)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_______(填字母)。
| A.都属于p区主族元素 | B.电负性都比镁大 |
| C.第一电离能都比镁大 | D.氯化物的水溶液pH均小于7 |

若BeO晶体的密度为d g·cm
 ,设晶胞参数为anm,设
,设晶胞参数为anm,设 为阿伏加德罗常数的值,则a=
为阿伏加德罗常数的值,则a=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】【化学——选修3:物质结构与性质】磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,下图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。回答下列问题:
(1)上述反应物中的一种元素,其基态原子具有八种不同能量的电子,写出其基态原子的价电子排布式______________ 。
(2)BP中每个B或P原子均形成几个共价键,其中有一个配位键,其中提供孤电子对的是_______ 原子。
(3)磷化硼的晶体类型是________ ,B原子的杂化方式是_______ ,每生成1molBP,共形成_______ molB-P键。
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:P____ B(填“>”、“<”)
(5)BBr3分子中,键角为_______________ ,为__________ (填“极性”或“非极性”)分子。
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是________________ 。
(1)上述反应物中的一种元素,其基态原子具有八种不同能量的电子,写出其基态原子的价电子排布式
(2)BP中每个B或P原子均形成几个共价键,其中有一个配位键,其中提供孤电子对的是
(3)磷化硼的晶体类型是
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:P
(5)BBr3分子中,键角为
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】一种硫酸镍粗品中含有 、
、 、
、 、
、 、
、 等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。
等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。 ;
;
②部分金属离子(起始浓度为0.1 ,沉淀完全的浓度为
,沉淀完全的浓度为 )生成氢氧化物沉淀的pH范围如下表:
)生成氢氧化物沉淀的pH范围如下表:
回答下列问题:
(1)“水浸”时常适当加热,加热的目的是___________ 。
(2)常温下,X是一种气体,则X、 、
、 中键角从大到小的顺序是
中键角从大到小的顺序是___________ (用化学式表示),其原因是______________ 。
(3)“沉铁”时,总反应的离子方程式为______________ ;其中加入 的作用是调节溶液pH=
的作用是调节溶液pH=___________ (填字母)。
A.1.5 B.4.0 C.6.3 D.6.9
(4)若某次工艺生产中,“沉铁”后,1.0t(体积约为 L)滤液中
L)滤液中 ,“沉钙”后,
,“沉钙”后,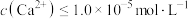 ,则最少加入
,则最少加入___________ g (保留三位有效数字)。
(保留三位有效数字)。
(5)萃取剂P204的结构简式如图1所示,1mol P204中含___________ mol手性碳原子;萃取时,萃取液pH对相关金属离子的影响如图2所示,则最适宜的pH为___________ 。
 、
、 、
、 、
、 、
、 等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。
等杂质离子,采用下列流程可以对硫酸镍进行提纯,并能获取蓝矾。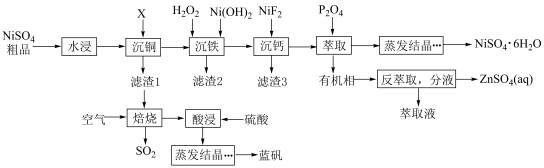
 ;
;②部分金属离子(起始浓度为0.1
 ,沉淀完全的浓度为
,沉淀完全的浓度为 )生成氢氧化物沉淀的pH范围如下表:
)生成氢氧化物沉淀的pH范围如下表:金属离子 |
|
|
|
|
|
|
开始沉淀的pH | 1.5 | 4.2 | 6.2 | 6.3 | 6.9 | 11.8 |
完全沉淀的pH | 2.8 | 6.2 | 8.2 | 8.3 | 8.9 | 13.8 |
(1)“水浸”时常适当加热,加热的目的是
(2)常温下,X是一种气体,则X、
 、
、 中键角从大到小的顺序是
中键角从大到小的顺序是(3)“沉铁”时,总反应的离子方程式为
 的作用是调节溶液pH=
的作用是调节溶液pH=A.1.5 B.4.0 C.6.3 D.6.9
(4)若某次工艺生产中,“沉铁”后,1.0t(体积约为
 L)滤液中
L)滤液中 ,“沉钙”后,
,“沉钙”后,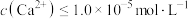 ,则最少加入
,则最少加入 (保留三位有效数字)。
(保留三位有效数字)。(5)萃取剂P204的结构简式如图1所示,1mol P204中含
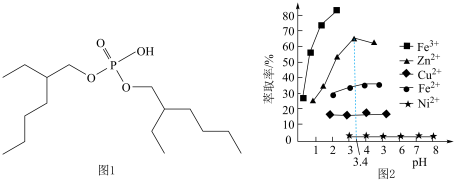
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】掺杂了硒(Se)、 碲(Te) 固溶物的Ag2S是一种具有良好塑性和热电性能的柔性半导体材料,该材料能用于可穿戴式、植入式电子设备的制备。
回答下列问题:
(1)Ag的核外电子排布式是[Kr] 4d105s1,则Ag在元素周期表中的位置是_______ 。下列属于基态Ag+的电子排布式的是_______ (填标号)。
A. [Kr] 4d95s2 B. [Kr] 4dl0 C. [Kr] 4d95s1
(2)S、As、Se、Br在元素周期表中的位置关系如图所示,则As、Se、Br的第一电离能由大到小的顺序为_______ , 的空间构型为
的空间构型为_______ 。
(3)金属Ge也是一种良好的半导体,利用离子液体[EMIM] [AlCl4]可电沉积还原金属Ge,该离子液体的熔点只有7℃,其中EMIM+结构如图所示。
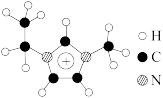
①EMIM+中C原子的杂化类型是_______ 。
②EMIM+中σ键数: π键数=_______ 。
③该离子液体的熔点比较低的原因是_______ 。
(4)ZnS的立方晶胞结构如下图所示:

①ZnS晶体中,与S2-距离最近且等距的Zn2+的个数是_______ 。
②ZnS的晶胞边长为a pm,则晶体的密度为_______ g·cm-3(用含a、NA的代数式表示,NA为阿伏加德罗常数的值)。
回答下列问题:
(1)Ag的核外电子排布式是[Kr] 4d105s1,则Ag在元素周期表中的位置是
A. [Kr] 4d95s2 B. [Kr] 4dl0 C. [Kr] 4d95s1
(2)S、As、Se、Br在元素周期表中的位置关系如图所示,则As、Se、Br的第一电离能由大到小的顺序为
 的空间构型为
的空间构型为| S | ||
| As | Se | Br |

①EMIM+中C原子的杂化类型是
②EMIM+中σ键数: π键数=
③该离子液体的熔点比较低的原因是
(4)ZnS的立方晶胞结构如下图所示:

①ZnS晶体中,与S2-距离最近且等距的Zn2+的个数是
②ZnS的晶胞边长为a pm,则晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】(1)X原子在第二电子层上只有一个空轨道,则X的轨道表示式为______ ;R原子的3p轨道上只有一个未成对电子,则R原子可能是_________ ; Y原子的核电荷数为29,其电子排布式是_____________ ,其在元素周期表中的位置是_______________ 。
(2)指出配合物K3[Co(CN)3]中的中心离子、配位体及其配位数:________ 、________ 、_______ 。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子,______ 。
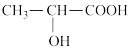
(4)在下列物质①CO2;②NH3;③CCl4;④BF3;⑤H2O;③SO2;⑦SO3;⑧PCl3中,属于非极性分子的是(填序号)______________ 。
(5)试比较下列酸的酸性强弱(填“>”、“<”或“=”):H2SO3______________ H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为______ 杂化, 分子的立体构型为_________ 。
BF3分子中,中心原子的杂化方式为__________ 杂化,分子的立体构型为____________ 。
(7) H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于_______________ 。
(2)指出配合物K3[Co(CN)3]中的中心离子、配位体及其配位数:
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子,
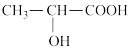
(4)在下列物质①CO2;②NH3;③CCl4;④BF3;⑤H2O;③SO2;⑦SO3;⑧PCl3中,属于非极性分子的是(填序号)
(5)试比较下列酸的酸性强弱(填“>”、“<”或“=”):H2SO3
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为
BF3分子中,中心原子的杂化方式为
(7) H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】A、B、C三种元素的核电荷数都小于18,它们间能形成化合物BA2、CA2,A原子最外电子层的p能级中有一个轨道填充了2个电子,B原子的最外电子层中p能级的电子数等于次外层电子总数,且A和B具有相同的电子层;C与A在周期表中位于同一主族。回答下列问题:
(1)B原子的价电子排布式_________________ 。
(2)CA2的分子式_________ ,分子构型为________________ 。BA2的电子式______________ ,分子构型为___________ ,其中心原子采取___________ 杂化。
(3)B的氢化物中分子构型为正四面体的是_____________ (填名称),其中心原子的杂化方式为_____________ 。
(4)A的氢化物的VSEPR模型为_______ ,分子构型为_______ 。
(1)B原子的价电子排布式
(2)CA2的分子式
(3)B的氢化物中分子构型为正四面体的是
(4)A的氢化物的VSEPR模型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】原子序数由小到大排列的四种短周期元素 X、Y、Z、W,四种元素的原子序数之和为 32,在周期表中 X 是原子半径最小的元素,Y、Z 左右相邻,Z、W 位于同主族。
(1)W 原子的核外电子排布式为__________________ 。
(2)均由 X、Y、Z 三种元素组成的三种常见物质 A.、B、C 分别属于酸、碱、盐,其化学式依次 为________________ 、__________________ 、____________________ ,推测盐中阴离子的空间构型为___________ ,其中心原子杂化方式为_________________________ 。
(3)Z、W 两种元素电负性的大小关系为___________ (填“大于”“等于”或“小于”);Y、Z 两种元素第 一电离能的大小关系为________________ (填“大于”“等于”或“小于”)。
(4)CO 的结构可表示为C≡O,元素Y 的单质Y2 的结构也可表示为Y≡Y。下表是两者的键能数据(单位:kJ⋅mol−1):
①结合数据说明 CO 比 Y2 活泼的原因:_________________________ 。
②意大利罗马大学 FulvioCacace 等人获得了极具研究意义的 Y4 分子,其结构如图所示,请结合上表数 据分析,下列说法中,正确的是_____ 。
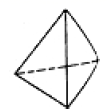
a. Y4 为一种新型化合物
b. Y4 与 Y2 互为同素异形体
c. Y4 的沸点比 P4(白磷)高
d. 1mol Y4 气体转变为 Y2 将放出 954.6kJ 热量
(1)W 原子的核外电子排布式为
(2)均由 X、Y、Z 三种元素组成的三种常见物质 A.、B、C 分别属于酸、碱、盐,其化学式依次 为
(3)Z、W 两种元素电负性的大小关系为
(4)CO 的结构可表示为C≡O,元素Y 的单质Y2 的结构也可表示为Y≡Y。下表是两者的键能数据(单位:kJ⋅mol−1):
| A−B | A═B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| Y2 | 154.8 | 418.4 | 941.7 |
②意大利罗马大学 FulvioCacace 等人获得了极具研究意义的 Y4 分子,其结构如图所示,请结合上表数 据分析,下列说法中,正确的是

a. Y4 为一种新型化合物
b. Y4 与 Y2 互为同素异形体
c. Y4 的沸点比 P4(白磷)高
d. 1mol Y4 气体转变为 Y2 将放出 954.6kJ 热量
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】短周期元素B、C、N等元素可以形成多种物质,呈现出不同的性质,请回答以下问题:
(1)B、C、N三种元素中第一电离能最大的是___________ 。
(2)硅、金刚石和碳化硅晶体的熔点从高到低依次是___________ 。
(3) 的结构与
的结构与 类似、但是性质差异较大。
类似、但是性质差异较大。
① 的空间结构为
的空间结构为___________ 形。N原子的轨道杂化类型为___________ 。
② 具有碱性(可与
具有碱性(可与 结合)而
结合)而 不显碱性,原因是
不显碱性,原因是___________ 。
(4)立方氮化硼晶体结构与金刚石相似,其晶胞如图所示。

①距离硼原子最近的氮原子有___________ 个,氮化硼晶体中含有的微粒间作用力为___________ 。
②已知:立方氮化硼晶体的摩尔质量为ag⋅mol ,密度为ρg⋅cm
,密度为ρg⋅cm ,设
,设 为阿佛加德罗常数的值,则该晶体的晶胞边长为
为阿佛加德罗常数的值,则该晶体的晶胞边长为___________ cm。
(1)B、C、N三种元素中第一电离能最大的是
(2)硅、金刚石和碳化硅晶体的熔点从高到低依次是
(3)
 的结构与
的结构与 类似、但是性质差异较大。
类似、但是性质差异较大。①
 的空间结构为
的空间结构为②
 具有碱性(可与
具有碱性(可与 结合)而
结合)而 不显碱性,原因是
不显碱性,原因是(4)立方氮化硼晶体结构与金刚石相似,其晶胞如图所示。

①距离硼原子最近的氮原子有
②已知:立方氮化硼晶体的摩尔质量为ag⋅mol
 ,密度为ρg⋅cm
,密度为ρg⋅cm ,设
,设 为阿佛加德罗常数的值,则该晶体的晶胞边长为
为阿佛加德罗常数的值,则该晶体的晶胞边长为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】回答下列问题
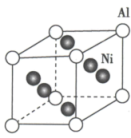
(1)Ni与Al形成的一种合金可用于铸造飞机发动机叶片,其晶胞结构如图所示,该合金的化学式为___________ 。
(2) 的熔点为1238℃,密度为
的熔点为1238℃,密度为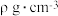 ,其晶胞结构如图所示。该晶体的类型为
,其晶胞结构如图所示。该晶体的类型为___________ 。
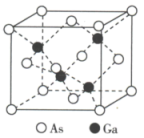
(3)自然界中有丰富的钛矿资源,如图表示的是钡钛矿晶体的晶胞结构,经X射线衍射分析,该晶胞为正方体。写出钡钛矿晶体的化学式:___________

(4)①磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。如图是磷化硼晶体的晶胞,B原子的杂化轨道类型是___________ 。立方相氮化硼晶体的熔点要比磷化硼晶体的高,其原因是___________ 。

②已知磷化硼的晶胞参数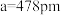 ,晶胞中硼原子和磷原子最近的核间距d为
,晶胞中硼原子和磷原子最近的核间距d为___________ pm。
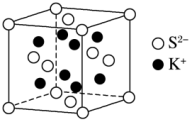
(5)K2S的晶胞结构如图所示。其中K+的配位数为___________ ,S2-的配位数为___________ ;
(1)Ni与Al形成的一种合金可用于铸造飞机发动机叶片,其晶胞结构如图所示,该合金的化学式为

(2)
 的熔点为1238℃,密度为
的熔点为1238℃,密度为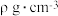 ,其晶胞结构如图所示。该晶体的类型为
,其晶胞结构如图所示。该晶体的类型为
(3)自然界中有丰富的钛矿资源,如图表示的是钡钛矿晶体的晶胞结构,经X射线衍射分析,该晶胞为正方体。写出钡钛矿晶体的化学式:

(4)①磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。如图是磷化硼晶体的晶胞,B原子的杂化轨道类型是

②已知磷化硼的晶胞参数
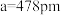 ,晶胞中硼原子和磷原子最近的核间距d为
,晶胞中硼原子和磷原子最近的核间距d为(5)K2S的晶胞结构如图所示。其中K+的配位数为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】A、B、C、D都是短周期主族元素,原子半径:D>C>A>B。已知A、B处于同一周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的4倍。试回答下列问题:
(1)这四种元素分别是A______ ,B______ ,C______ ,D______ (填元素名称);
(2)B、C、D元素的单质的熔点由高到低的顺序是____________ (填化学式);
(3)C的单质是______ (填“原子”“离子”或“分子”,下同)晶体,B的单质和D的单质在常温下反应得到的生成物属于______ 晶体。
(1)这四种元素分别是A
(2)B、C、D元素的单质的熔点由高到低的顺序是
(3)C的单质是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】碱金属及碳族元素在科研领域、生活和生产方面有广泛的应用。回答下列问题:
(1)在元素周期表中,与Li的化学性质最相似的邻族元素是__________ (填元素符号),该元素基态原子最外层电子的自旋状态___________ (填“相同”或“相反”)。
(2)碳和硅的有关化学键键能如下所示:
SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________ 。
(3)天然硅酸盐都是由[SiO4]四面体以顶角氧原子相连而成,可成链状也可成环,所以硅酸盐种类繁多。下图a代表SiO44-,b、c是硅氧四面体形成的环状结构。
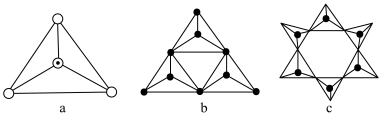
硅氧四面体中Si的轨道杂化类型为____________ ; 图b环状结构硅酸根的化学式为______________ 若在环状结构中硅的原子数为n,写出环状结构中硅酸根的通式_____________ 。
(4)钾与溴作用能形成溴化钾晶体,该晶体类型为___________ ,其晶格能可通过下图的Borm-Haber循环计算得到。
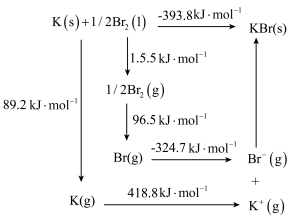
从上图可知,K原子的第一电离能为_____ kJ/mol, Br-Br键键能为______ kJ/ mol,KBr的晶格能为______ kJ/mol,晶格能越大,该晶体的熔点越______ 。
(1)在元素周期表中,与Li的化学性质最相似的邻族元素是
(2)碳和硅的有关化学键键能如下所示:
| 化学键 | C-H | C-O | Si-H | Si-O |
| 键能/kJ▪mol-1 | 413 | 336 | 318 | 452 |
SiH4的稳定性小于CH4,更易生成氧化物,原因是
(3)天然硅酸盐都是由[SiO4]四面体以顶角氧原子相连而成,可成链状也可成环,所以硅酸盐种类繁多。下图a代表SiO44-,b、c是硅氧四面体形成的环状结构。

硅氧四面体中Si的轨道杂化类型为
(4)钾与溴作用能形成溴化钾晶体,该晶体类型为

从上图可知,K原子的第一电离能为
您最近一年使用:0次




